rhGH对老年多器官功能不全患者CD47、L-选择素及高级氧化蛋白产物表达的影响
2015-08-28刘军甄平李旭升李慎松田琦杨洁何晓乐
刘军,甄平,李旭升,李慎松,田琦,杨洁,何晓乐
老年多器官功能不全综合征(multiple organ dysfunction syndrome in the elderly,MODSE)是指老年人在器官老化和患有多种慢性疾病的基础上,由某种诱因激发,在短时间内出现2个或2个以上器官序贯或同时发生功能不全或衰竭的临床综合征[1]。尽管当今全球医学不断发展,但对MODSE高危患者的防治仍相对乏力。最新研究表明,膜糖蛋白CD47和L-选择素(L-selectin)与MODSE的发生发展密切相关[2-3],高级氧化蛋白产物(AOPPs)作为反映机体氧化应激状态的新指标和新型炎性介质,也逐渐受到临床和基础研究的重视[4]。重组人生长激素(recombination human growth hormone,rhGH)可提高T淋巴细胞的增殖和巨噬细胞的吞噬能力[5],并有学者认为其能增强患者的体液免疫及细胞免疫功能[6]。本研究观察MODSE患者应用rhGH后膜糖蛋白CD47﹑L-选择素和血清AOPPs浓度的改变,探讨rhGH的临床疗效及其可能机制。
1 资料与方法
1.1 临床资料 纳入2013年10月-2014年10月在第四军医大学西京医院住院并符合美国胸科医师学会和危重病医学会联席会议(ACCP/CCM)联合倡议提出的MODSE诊断标准[7]的患者共66例,其中男40例,女26例,年龄65~101岁,平均82岁。排除艾滋病﹑肿瘤﹑结缔组织疾病和精神疾病患者。所有患者于采血前2周无静脉注射或口服维生素C﹑维生素E或其他有明确抗氧化作用药物史。对MODSE患者在治疗前及治疗后的第3﹑14﹑28天进行急性生理学与慢性健康状况(APACHE)Ⅲ评分,且于治疗后的第3﹑14﹑28天统计MODSE患者生存或病死率。
1.2 研究方法及观察指标 随机将患者分为治疗组(n=33)及对照组(n=33)。对照组患者给予常规治疗,治疗组患者从入院当天开始即在常规治疗基础上给予皮下注射rhGH,0.4U/(kg.d),1/d,连续28d。两组患者分别于治疗前及治疗后的第3﹑14﹑28天清晨在空腹﹑安静状态下采集外周静脉血8ml,置于无菌EDTA抗凝管。取其中5ml,用10%氯化铵裂解红细胞,单克隆抗体染色后,采用流式细胞仪检测CD47表达:分别加入对照管及rhGH治疗管中各5μl,加入PBS缓冲液30μl,rhGH治疗管加抗CD47-FITC 20μl,4℃避光孵育20min,PBS缓冲液洗3次,1%多聚甲醛固定,在流式细胞仪上检测红细胞表面CD47阳性率。L-选择素﹑AOPPs试剂盒购自上海蓝基生物工程公司。血浆L-选择素水平按照ELISA试剂盒说明书进行测定。采用分光光度法检测血清AOPPs浓度:以20mmol/L PBS(pH7.4)按l:5比例稀释血清(新鲜的血液样本1ml抗凝后经3000r/min低温离心10min所获),吸取20μl稀释血清(剩余的血清置于–70℃冰箱贮存),加入20μl醋酸,摇匀后即刻于340nm下测定吸光度(A)值,血清AOPPs浓度从氯胺-T(0~200μmol/L)制得的标准曲线上求得,并用PBS空白校正。实验所用仪器主要包括721分光光度计(上海第三仪器厂)﹑TOSHIBA RF40生化分析仪(日本东芝公司)﹑Facscalibur流式细胞分析仪(美国BD公司)。两组均以28d为1个疗程,每疗程前后均检查血常规﹑肝肾功能,观察疗效及不良反应。
1.3 统计学处理 采用SPSS 16.0软件进行统计分析。计量资料以±s表示,两组间比较采用成组t检验,多组间比较采用重复测量方差分析,组间多重比较采用LSD-t检验;计数资料率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组病死率比较 治疗后第3﹑14及28天,治疗组病死率(分别为9.10%﹑15.15%﹑18.18%)与对照组(分别为12.12%﹑21.21%﹑30.30%)比较均明显降低,差异有统计学意义(P<0.05)。
2.2 两组患者APACHE Ⅲ评分比较 与治疗前相比,对照组和治疗组患者治疗后的APACHE Ⅲ评分均明显降低(P<0.05)。对照组和治疗组患者治疗3﹑14﹑28d后,其APACHE Ⅲ评分均呈下降趋势,尤以治疗组(53.2±2.55﹑45.35±1.80﹑40.60±1.50)下降明显(P<0.05),提示患者病情严重程度均明显改善。治疗组第14天的APACHE Ⅲ评分较治疗第3天时明显下降,且第28天时APACHE Ⅲ评分较治疗第14天时明显下降,差异均有统计学意义(P<0.05,表1)。
2.3 两组患者CD47﹑L-选择素及AOPPs的比较与治疗前相比,对照组和治疗组患者治疗后CD47阳性率升高,L-选择素水平下降,AOPPs浓度降低,差异均有统计学意义(P<0.05)。治疗后第3﹑14﹑28天,治疗组CD47阳性率与对照组比较均明显升高(P<0.05),且治疗后第14天治疗组CD47阳性率明显高于第3天,第28天CD47阳性率明显高于第14天,差异均有统计学意义(P<0.05)。治疗第3﹑14﹑28天,治疗组L-选择素水平﹑AOPPs浓度与对照组比较均明显降低(P<0.05),且治疗后第14天治疗组的L-选择素水平﹑AOPPs浓度明显低于第3天(P<0.05),第28天L-选择素水平﹑AOPPs浓度明显低于第14天,差异均有统计学意义(P<0.05,表2)。
表1 两组患者APACHE Ⅲ评分比较(±s)Tab.1 Comparison of APACHE Ⅲ scores between the two groups (±s)
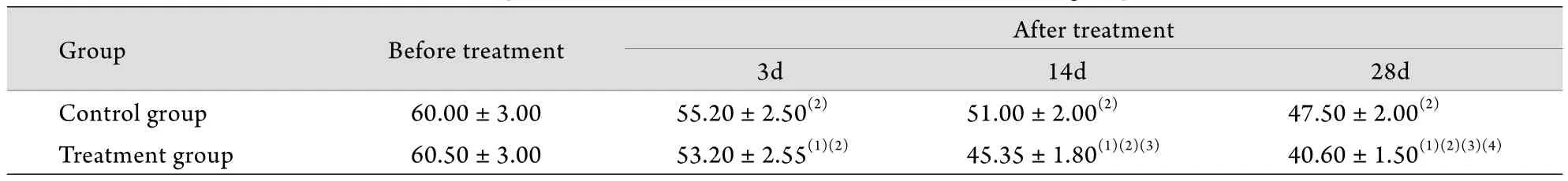
表1 两组患者APACHE Ⅲ评分比较(±s)Tab.1 Comparison of APACHE Ⅲ scores between the two groups (±s)
The number of cases in control group before treatment and 3, 14, 28 days after treatment was 33, 29, 26 and 23, and that in treatment group was 33, 30, 28 and 27, respectively. (1)P<0.05 compared with control group; (2)P<0.05 compared with before treatment; (3)P<0.05 compared with 3 days after treatment; (4)P<0.05 compared with 14 days after treatment
Group Before treatment After treatment 3d 14d 28d Control group 60.00±3.00 55.20±2.50(2) 51.00±2.00(2) 47.50±2.00(2)Treatment group 60.50±3.00 53.20±2.55(1)(2) 45.35±1.80(1)(2)(3) 40.60±1.50(1)(2)(3)(4)
表2 两组患者CD47阳性率﹑L-选择素水平和AOPPs浓度变化比较(±s)Tab.2 Changes of CD47 expression, serum L-selectin level and AOPPs concentration in the two groups (±s)
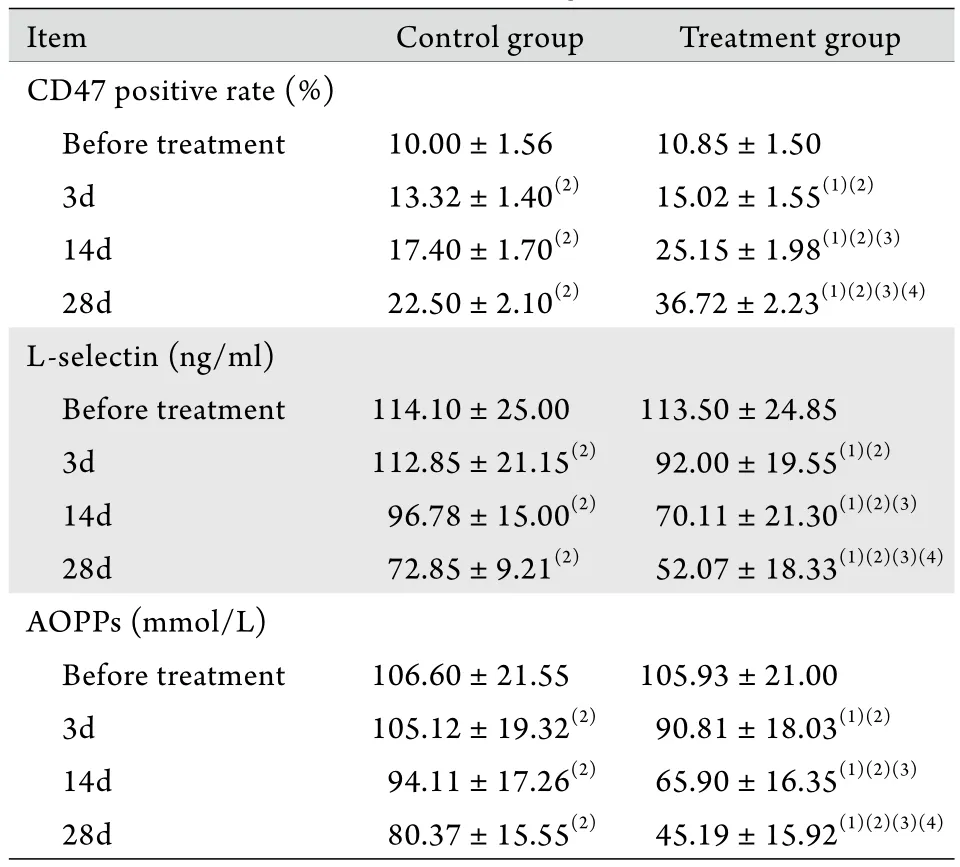
表2 两组患者CD47阳性率﹑L-选择素水平和AOPPs浓度变化比较(±s)Tab.2 Changes of CD47 expression, serum L-selectin level and AOPPs concentration in the two groups (±s)
The number of cases in control group before treatment and 3, 14,28 days after treatment was 33, 29, 26 and 23, and that in treatment group was 33, 30, 28 and 27, respectively. (1)P<0.05 compared with control group; (2)P<0.05 compared with before treatment; (3)P<0.05 compared with 3 days after treatment; (4)P<0.05 compared with 14 days after treatment
Item Control group Treatment group CD47 positive rate (%)Before treatment 10.00±1.56 10.85±1.50 3d 13.32±1.40(2) 15.02±1.55(1)(2)14d 17.40±1.70(2) 25.15±1.98(1)(2)(3)28d 22.50±2.10(2) 36.72±2.23(1)(2)(3)(4)L-selectin (ng/ml)Before treatment 114.10±25.00 113.50±24.85 3d 112.85±21.15(2) 92.00±19.55(1)(2)14d 96.78±15.00(2) 70.11±21.30(1)(2)(3)28d 72.85±9.21(2) 52.07±18.33(1)(2)(3)(4)AOPPs (mmol/L)Before treatment 106.60±21.55 105.93±21.00 3d 105.12±19.32(2) 90.81±18.03(1)(2)14d 94.11±17.26(2) 65.90±16.35(1)(2)(3)28d 80.37±15.55(2) 45.19±15.92(1)(2)(3)(4)
3 讨 论
目前已明确,外科MODSE的发生与应激反应或系统性炎症反应相关,内科疾病诱发的MODSE虽表现多样,如老年心功能不全患者罹患MODSE的第一原因是感染,但究其本质,与年龄因素﹑多种慢性病﹑营养不良等所致的免疫力低下明显相关的各种感染性疾病是MODSE发展的关键诱因。免疫力降低导致的感染是这些系统衰竭的共同通道,延缓了机体免疫力的改善,影响康复。尽管抗生素的大量联合应用似乎可以控制感染,但却治标不治本,提高患者免疫力才是根本举措。
rhGH是近年来利用DNA技术合成的生长激素,它的作用及生物动力学与垂体分泌的内源性生长激素相同。其已明确的功能包括通过促进巨噬细胞和多形核中性粒细胞释放超氧化物阴离子的方式来杀灭病原微生物,通过作用于肝细胞膜上的生长激素受体(growth hormone receptor,GHR),合成胰岛素样生长因子-Ⅰ(insulin-like growth factor-Ⅰ,IGF-Ⅰ),上调GH-IGF-Ⅰ轴活性,增强白细胞吞噬等细胞免疫功能等[8]。
CD47是一种普遍存在于人类细胞表面的膜糖蛋白,属于免疫球蛋白(immunoglobulin,Ig)超家族,原被称为整合素相关蛋白。CD47在人体未成熟和成熟树突细胞(dendritic cells,DC)表面均有高表达(94%~98%),可帮助DC高效地摄取﹑加工处理和递呈抗原,在机体免疫应答中起关键的引导和调节作用[9]。CD47可以通过与信号调节蛋白α(signalregulatoryproteinα,SIRPα)﹑受体整合素及凝血酶敏感蛋白结合来调节细胞的凋亡﹑增殖﹑黏附和迁移等[10]。CD47分子作用复杂,不仅介导吞噬白细胞凋亡﹑合成细胞因子[11],还可与白细胞受体αMβ2(CD11b/CD18)结合而促进T细胞活化及白细胞从血管内向炎症部位浸润[12]。国外研究发现,CD47缺陷小鼠易产生炎症反应[13]。Cázares-Delgadillo等[14]研究发现CD47表达的变化与MODSE和炎症反应呈负相关,即CD47低表达患者MODSE的发生率较高。本研究结果提示,治疗组在rhGH的干预下CD47表达增高,患者的炎症反应得到明显改善,并发多种感染的风险明显降低,其机制可能为CD47有效介导炎症细胞因子如白细胞介素-12(IL-12)﹑肿瘤坏死因子-α(TNF-α)﹑干扰素-γ(IFN-γ)的释放[15],而rhGH显著增高CD47的表达,进而减少炎症递质的合成和释放。CD47作为一种重要的免疫因子,在机体免疫调节中发挥着重要作用,本实验中rhGH治疗组患者免疫功能的提高与CD47表达增高后影响DC的成熟有关。在rhGH作用下,CD47表达增高促使DC保持在未成熟状态,从而限制炎症反应的强度及持续时间;CD47表达增高也可使中性粒细胞﹑单核细胞等由接触抗原的外周组织跨膜迁移进入次级淋巴器官,与T细胞接触并激发免疫应答,达到维持机体免疫水平的目的。此外,Seo等[16]报道外源性的rhGH可直接刺激B细胞合成免疫球蛋白,且在促进机体淋巴细胞DNA合成方面具有重要作用,进而影响胸腺﹑骨髓的成熟及分化,在改善患者整体状况的基础上进一步提高免疫功能,但其具体作用靶点仍须进一步研究。
L-选择素是一种细胞黏附分子,只表达于白细胞,对白细胞黏附具有关键的介导作用,其mRNA稳定地表达于T细胞,有丝分裂原刺激后可增加其表达量。在细胞激活过程中,L-选择素表达变化迅速,这种变化既发生在转录水平,亦发生在翻译水平。L-选择素在创伤过程﹑休克反应﹑脓毒血症中起着重要作用,最新研究结果表明,L-选择素和MODSE密切相关[17]。休克反应时,白细胞嵌塞毛细血管,引起血流停止;治疗后,当灌流压恢复时,仍可有白细胞嵌塞,因此它是无复流的原因之一。白细胞在脏器中被截留俘获,进而损害实质细胞,是休克后期引起多器官功能衰竭的机制之一[18]。L-选择素与其配体或者抗体的交联能增强TNF-α和IL-8的表达[19],此外,L-选择素与其抗体结合能够引起具有调节炎症反应作用的CSF-1基因的表达[20]。有研究表明,rhGH可抑制黏附分子(ICAM-1)蛋白的表达[21],但与ICAM-1同为黏附分子的L-选择素与rhGH之间的作用关系尚无报道。本实验中MODSE患者经过治疗后,L-选择素水平显著降低(P<0.01),患者免疫功能提高,其机制可能为:①可溶性L-选择素是L-选择素在白细胞表面脱落的部分,与临床疾病密切相关,在机体中起负反馈免疫调节作用,rhGH抑制可溶性L-选择素的生成;②rhGH通过作用于L-选择素而增强T淋巴细胞的功能和促进T淋巴细胞在胸腺中的发育;③rhGH可阻断L-选择素与其内皮配体的结合,从而减少白细胞趋化黏附于活化的内皮细胞。
AOPPs是蛋白质氧化修饰的产物,在体内发挥炎症介质作用,是评价氧化应激的特异性﹑灵敏度和预后评估的有效指标。AOPPs与内皮功能紊乱有关,外源性AOPPs可促进单核细胞分泌TNF-α,体外实验证实其可促进内皮细胞分泌单核细胞趋化因子[22],AOPPs水平异常增高提示患者机体发生了严重的氧化应激反应,甚至诱发一系列相关脏器的损伤,加快MODSE的进展。熊艳等[23]﹑Kremidas等[24]前期临床研究发现AOPPs参与了MODSE的发病过程,可作为判断MODSE器官功能障碍程度和预后的重要指标,Yuan等[25]报道rhGH能通过增加抗氧化分子水平﹑降低自由基活化程度而明显改善患者的负氮平衡及预后。Van den Berg等[26]研究发现,rhGH可抑制TNF-α的生成和释放,抑制败血症大鼠血浆中iNOS的活力,从而降低NO水平。本实验中,rhGH治疗组AOPPs浓度较对照组明显降低,表明rhGH可减轻MODSE患者的氧化应激反应,其机制可能如下:①肠黏膜屏障在应激状态下会出现功能障碍,从而使细菌移位,内毒素﹑细菌透过屏障入血,发生氧化应激反应,导致全身炎症反应综合征(SIRS),使机体功能进一步紊乱,成为触发MODSE的主要原因。rhGH可发挥对肠黏膜的保护作用,增强机体的防御能力,减轻内毒素对肝脏网状内皮系统的刺激,改善脏器微循环,降低多器官炎症反应。②rhGH具有防止抗炎介质水平下降﹑维持抗炎介质水平的作用[27]。
从本研究可看出,rhGH可调节MODSE患者机体的膜糖蛋白﹑黏附因子及蛋白氧化应激,从而改善机体细胞免疫功能紊乱,改善患者的不良状况和预后,为rhGH在临床危重患者中的使用提供了一定的依据。但由于本研究无大样本的数据,临床疗效尚需进一步证实。
[1] Wang SW, Wang JD, Chen KJ, et al. Multiple organ function of senile in sufficiency syndrome (MODSE) diagnostic criteria(Trial draft, 2003)[J]. Chin Crit Care Med, 2004, 16(1): 1.[王士雯, 王今达, 陈可冀, 等. 老年多器官功能不全综合征(MODSE)诊断标准(试行草案, 2003)[J]. 中国危重病急救医学, 2004, 16(1): 1.]
[2] van Griensven M, Barkhausen T, Hildebrand F, et al. L-selectin shows time and gender dependency in association with MODS[J]. Injury, 2004, 35(11): 1087-1095.
[3] Wang GQ, Zhang Y, Wu HQ, et al. Reduction of CD47 on monocytes correlates with MODS in burn patients[J]. Burns,2011, 37(1): 94-98.
[4] Assimakopoulos SF, Tsamandas AC, Louvros E, et al. Intestinal epithelial cell proliferation apoptosis and expression of tight junction proteins in patients with obstructive jaundice[J]. Eur J Clin Invest, 2011, 41(2): 117-125.
[5] Ding PJ, Duan CE, Zhang SJ, et al. Effect of recombinant human growth hormone on production of IL-1, IL-6, and TNF-α from human macrophages[J]. J Zhengzhou Univ (Med Sci), 2011,46(5): 684-686. [丁培杰, 段长恩, 张世杰, 等. 重组人生长激素对人巨噬细胞分泌IL-1﹑IL-6和TNF-α的影响[J]. 郑州大学学报(医学版), 2011, 46(5): 684-686.]
[6] Rashid N, Saenger P, Wu YL, et al. Erratum to: switching to Omnitrope® from other recombinant human growth hormone therapies: a retrospective study in an integrated healthcare system[J]. Biol Ther, 2014, [Epub ahead of print].
[7] Bone RC, Balk RA, Cerra FB, et al. The ACCP/SCCM consensus conference committee. Definition for sepsis and organ failure and guidelines for use of innovative therapies in sepsis[J]. Chest,1992, 101(6): 1644-1655.
[8] Grossberg AJ, Scarlett JM, Marks DL. Hypothalamic mechanisms in cachexia[J]. Physiol Behav, 2010, 100(5): 478-489.
[9] Doessing S, Heinemeier KM, Holm L, et al. Growth hormone stimulates the collagen synthesis in human tendon and skeletal muscle without affecting myofibrillar protein synthesis[J]. J Physiol, 2010, 588(2): 341-351.
[10] Gao SF, Zhang SR, Xu L, et al. Effect of small interfering RNA targeting CD47 gene mediated by lentivirus vectors on proliferation and apoptosis of human laryngocarcinoma Hep-2 cells[J]. Med J Chin PLA, 2013, 38(8): 634-638. [高树峰, 张少容, 徐莲, 等. 慢病毒介导的siRNA靶向CD47基因对人喉癌细胞Hep-2增殖﹑凋亡的影响[J]. 解放军医学杂志, 2013,38(8): 634-638.]
[11] Wang N, Yu H, Ma J, et al. Evidence for tight junction protein disruption in intestinal mucosa of malignant obstructive jaundice patients[J]. Scand J Gastr Oenterol, 2010, 45(2): 191-199.
[12] McKie PM, Cataliotti A, Lahr BD, et al. The prognostic value of N-terminal pro-B-type natriuretic peptide for death and cardiovascular events in healthy normal and stage A/B heart failure subjects[J]. J Am Coll Cardio, 2010, 55(19): 2140-2147.
[13] Kirana G, Ciralik H, Ozbag D, et al. Comparison of transforming growth factor β1 concentrations in the ovaries of rats stimulated by human menopausal gonadotropin or recombinant folliclestimulating hormone[J]. Eur J Obstet Gynecol Reprod Biol,2012, 163(1): 35-38.
[14] Cázares-Delgadillo J, Ganem-Rondero A, Kalia YN. Human growth hormone: new delivery systems, alternative routes of administration, and their pharmacological relevance[J]. Eur J Pharm Biopharm, 2011, 78(2): 278-288.
[15] Ren T, Yuan W, Zhao H, et al. Sustained-release polylactideco-glycolide microspheres loaded with pre-formulated protein polysaccharide nanoparticles[J]. Micro Nano Lett, 2011, 6(2):70-74.
[16] Seo BB, Park MR, Chun C, et al. The biological efficiency and bioavailability of human growth hormone delivered using injectable, ionic, thermosensitive poly (organophosphazene)-polyethylenimine conjugate hydrogels[J]. Biomaterials, 2011,32(32): 8271-8280.
[17] Polgreen LE, Thomas W, Orchard PJ, et al. Effect of recombinant human growth hormone on changes in height, bone mineral density, and body composition over 1-2 years in children with Hurler or Hunter syndrome[J]. Mol Genet Metab, 2014, 111(2):101-106.
[18] Rong X, Mo X, Ren T, et al. Neuroprotective effect of erythropoietin-loaded composite microspheres on retinal ganglion cells in rats[J]. Eur Pharm Sci, 2011, 43(4): 334-342.
[19] Sarfati M, Fortin G, Raymond M, et al. CD47 in the immune response: role of thrombospondin and SIRP-alpha reverse signaling[J]. Curr Drug Targets, 2008, 9(10): 842-850.
[20] Eftekhar M, Aflatoonian A, Mohammadian F, et al. Adjuvant growth hormone therapy in antagonist protocol in poor responders undergoing assisted reproductive technology [J].Areh Gynecol Obstet, 2013, 287(5): 1017-1021.
[21] Kang J, Wu F, Cai YP, et al. Development of recombinant human growth hormone (rhGH) sustained-release microspheres by a low temperature aqueous phase/aqueous phase emulsion method[J]. Eur J Pharm Sci, 2014, 62: 141-147.
[22] Gardai SJ, McPhillips KA, Fraseh SC, et al. Cell surface calreticulin initiates clearance of viable or apoptotic cells throrlSh trans activation of LRP on the phagocyte[J]. Cell, 2005,123(2): 321-334.
[23] Xiong Y, Tang H, Li X, et al. Multiple organ dysfunction syndrome in patients with advanced oxidation protein products and its clinical significance[J]. Chin Crit Care Med, 2008,20(9): 542-545. [熊艳, 唐皓, 李欣, 等. 多器官功能障碍综合征患者高级氧化蛋白产物的表达及其临床意义[J]. 中国危重病急救医学, 2008, 20(9): 542-545.]
[24] Kremidas D, Wisniewski T, Divino VM, et al. Administration burden associated with recombinant human growth hormone treatment: perspectives of patients and caregivers[J]. J Pediatr Nurs, 2013, 28(1): 55-63.
[25] Yuan W, Hu Z, Su J, et al. Preparation and characterization of recombinant human growth hormone-Zn2+-dextran nanoparticles using aqueous phase-aqueous phase emulsion[J].Nanomedicine, 2012, 8(4): 424-427.
[26] van den Berg TK, van der Schot CE. Innate immun 'self'recognition: a role for CD47-SIRPa interactions in hematopoietic stein cell transplantation[J]. Trends Immunol, 2008, 29(5): 203-206.
[27] Mooney JT, Fredericks DP, Zhang C, et al. Purification of a recombinant human growth hormone by an integrated IMAC procedure[J]. Protein Expr Purif, 2014, 94(2): 85-94.
