真核起始因子(eIF6)对M2型巨噬细胞炎性介质表达的影响
2015-06-28文帅胡晓红张小容黄勇贺伟峰罗高兴吴军
文帅,胡晓红,张小容,黄勇,贺伟峰,罗高兴,吴军
真核起始因子(eIF6)对M2型巨噬细胞炎性介质表达的影响
文帅,胡晓红,张小容,黄勇,贺伟峰,罗高兴,吴军
目的探讨真核细胞起始因子(eIF6)基因对M2型巨噬细胞纤维化相关因子分泌及重要蛋白酶表达的影响。方法采用eIF6野生型(eIF6+/+)及敲降型(eIF6+/-)C57BL/6雄性小鼠,腹腔灌洗获得巨噬细胞,通过白介素4(IL-4)诱导形成M2型巨噬细胞。应用基因芯片比较eIF6+/+与eIF6+/-小鼠M2型巨噬细胞基因表达谱的差异,并通过RT-PCR及ELISA对芯片检测结果进行验证。结果基因芯片检测结果显示,与eIF6+/-小鼠组比,eIF6+/+小鼠M2型巨噬细胞中血管内皮生长因子(VEGF)及金属蛋白酶抑制剂2(TIMP-2)基因表达显著下调,基质金属蛋白酶2(MMP-2)基因表达显著上调。RT-PCR及ELISA检测结果显示,与eIF6+/-小鼠相比,eIF6+/+小鼠M2型巨噬细胞中VEGF、TIMP-2 mRNA及蛋白表达水平明显下降(P<0.05),而MMP-2 mRNA及蛋白表达水平明显上升(P<0.05)。结论eIF6可能通过抑制VEGF生成而防止血管及肉芽组织过度增生,同时通过调节MMP-2/TIMP-2的比例以平衡细胞外基质的降解与沉积,从而缓解瘢痕形成。
真核细胞起始因子6;巨噬细胞;纤维化
瘢痕形成(纤维化)是伤口或创面自然愈合过程中的一种正常的、必然的生理反应,但它严重影响患者的生活质量,是临床上急需解决的难题之一。在创面愈合及纤维化过程中,巨噬细胞发挥了重要作用[1]。Lucas等[2]研究发现,清除巨噬细胞后创面肉芽组织显著减少,再上皮化过程受阻,创面愈合延迟。Sindrilaru等[3]将创面巨噬细胞分离后进行培养发现,在创面修复过程中巨噬细胞对创面局部不同的微环境刺激可产生不同的表型。巨噬细胞在整个创面愈合过程中均表达经典激活(classic activation)型(M1型)和选择性激活(alternative activation)型(M2型)表面标记,其中在炎症反应早期主要是M1型,在修复期主要是M2型[4-5]。M2型巨噬细胞被认为是一种促纤维化细胞,可分泌大量的细胞因子激活成纤维细胞向肌成纤维细胞转化,导致肉芽组织增生、细胞外基质(ECM)沉积,进而促进瘢痕形成[6]。
真核细胞起始因子6(eukaryotic initiation factor-6,eIF6)可对真核生物的翻译起始阶段进行调控。在细胞核内,eIF6与核糖体60s亚基结合,抑制核糖体80s亚基形成[7]。蛋白翻译起始阶段,作为真核起始因子的eIF6在CK1-PKC作用下发生磷酸化,从核糖体60s亚基解聚下来,促进40s亚基和60s亚基结合形成80s亚基,从而启动蛋白质的翻译[8]。实验室前期实验比较了eIF6+/+与eIF6+/-小鼠创面愈合情况,结果发现eIF6+/-小鼠创面肉芽组织、胶原明显增多,提示eIF6对皮肤纤维化具有抑制作用(结果尚未发表)。但eIF6通过何种机制对巨噬细胞产生作用,进而影响创面愈合及瘢痕形成目前尚未见报道。本研究通过基因芯片技术对eIF6+/+与eIF6+/-小鼠M2型巨噬细胞基因表达谱进行比较,寻找相关基因。
1 材料与方法
1.1 实验动物及主要试剂 eIF6野生型(eIF6+/+)及敲降型(eIF6+/-)C57BL/6雄性小鼠(8~10周龄,体重15~20g)。细胞培养基RPMI 1640、胎牛血清购于Gibco公司,小鼠重组白介素4(IL-4)购于R&D公司,anti-F4/80-Percp、anti-CD11b-FITC、anti-Cd11c-PE、anti-CD206 (MR)-FITC、anti-CD16/32购于三箭公司,RNeasy Mini kit购于Qiagen公司,反转录试剂盒AMV3.0购于大连TaKaRa公司,基因芯片(Affymetrix GeneChip Mouse Gene 1.0 ST Array)购于Affymetrix公司,检测由英潍捷基(上海)贸易有限公司完成。
1.2 方法
1.2.1 腹腔巨噬细胞培养 小鼠引颈处死,75%乙醇消毒后打开腹腔,用10ml预冷的RPMI 1640培养基反复灌洗腹腔。收集灌洗液于无菌离心管中(置冰上),4℃下1000r/min离心10min获得细胞沉淀,用2ml RPMI 1640培养基(含10%胎牛血清)重悬,接种于6孔板中,每孔5×106个细胞。细胞培养箱中培养12h,洗去未贴壁细胞,获得的贴壁细胞即为巨噬细胞[9]。流式细胞仪检测显示F4/80、CD11b双阳性细胞比例达94%(图1f)。刺激组加入IL-4(40ng/ml)刺激24h,获得M2型巨噬细胞,未刺激组加等量PBS,余培养条件一致。
1.2.2 巨噬细胞纯度检测 将培养的巨噬细胞用0.5%胰酶消化计数,5×105个/管,PBS洗1次,100μl PBS重悬,加入1μl anti-CD16/32孵育10min,阻断Fc受体,再加入1μl anti-F4/80-Percp和1μl anti-CD11b-FITC室温孵育30min,1ml PBS洗去游离抗体后,用0.3ml PBS重悬,Attune流式细胞仪(ABI公司)检测细胞表面F4/80、CD11b的表达。
1.2.3 M2型巨噬细胞表面标记检测 将刺激后的巨噬细胞用0.5%胰酶消化计数,5×105个/管,PBS洗1次,100μl PBS重悬,加入1μl anti-CD16/32 孵育10min,阻断Fc受体,再加入anti-F4/80-Percp、anti-CD11c-PE、anti-CD206(MR)-FITC各1μl室温孵育30min,1ml PBS洗去游离抗体后,用0.3ml PBS重悬,Attune流式细胞仪(ABI公司)检测细胞表面F4/80、CD11c、CD206的表达。
1.2.4 基因芯片检测 分别取来自eIF6+/+与eIF6+/-小鼠的M2巨噬细胞,抽提RNA,行基因芯片检测,重复3次。具体信息见http://www.affymetrix. com。
1.2.5 实时荧光定量PCR(RT-PCR)检测 应用RNeasy Mini kit试剂盒提取巨噬细胞总RNA,进行反转录和RT-PCR反应,检测转化生长因子-β1(TGF-β1)、精氨酸酶1(arginase-1)、基质金属蛋白酶2(MMP-2)、金属蛋白酶抑制剂2(TIMP-2)、血管内皮生长因子(VEGF)。引物由上海生工生物有限公司合成,序列如下:GAPDH正义3'-GGGGAAGGTGAAGGTCGGAGTC-5',反义3'-TCGCTCCTGGAAGATGGTGATG-5';TGF-β1正义3'-TGGAAACCCACAACGAAATCTATGA-5',反义3'-TGGAAACCCACAACGAAATCTATGA-5';精氨酸酶1正义3'-CTCCAAGCCAAAGTCCTTAGAG-5',反义3'-GGAGCTGTCATTAGGGACATCA-5';MMP-2正义3'-ACCTGAACACTTTCTATGGCTG-5',反义3'-CTTCCGCATGGTCTCGATG-5';TIMP-2正义3'-GCAACCCCATCAAGAGGATTC-5',反义3'-GGGGCCGTGTAGATAAACTCG-5';VEGF正义3'-GCCAGACAGGGTTGCCATAC-5',反义3'-GGAGTGGGATGGATGATGTCAG-5'。以GAPDH作为内参照,结果以2-ΔΔCt法表示。实验均重复3次。
1.2.6 ELISA检测 收集IL-4刺激24h后的巨噬细胞培养上清,采用VEGF、MMP-2、TIMP-2、ELISA试剂盒(武汉博士德公司)检测VEGF、MMP-2、TIMP-2的表达,具体操作按试剂盒说明书进行。实验均重复3次。
1.3 统计学处理 采用SPSS 13.0软件进行统计分析,数据结果以表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 M2型巨噬细胞表面分子表达及纯度检测 巨噬细胞经IL-4刺激24h后,其形态发生明显改变,树枝状分支减少,细胞逐渐变圆,且折光性下降。流式细胞仪检测发现,与未刺激组比较,IL-4刺激组CD206表达明显增强,而CD11c表达无明显改变(图1G、H)。所获M2巨噬细胞纯度为72.9%(图1E)。
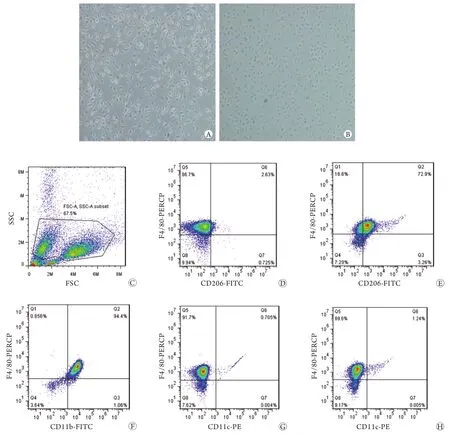
图1 巨噬细胞纯度及M2表面标志物检测情况Fig. 1 Purity of macrophage and expression of M2 macrophage surface markers
2.2 M2型巨噬细胞功能检测 在体外培养条件下,参照经典方法以IL-4刺激巨噬细胞24h诱导形成M2型巨噬细胞[10]。RT-PCR检测显示,经IL-4刺激后,eIF6+/+与eIF6+/-小鼠巨噬细胞精氨酸酶1、TGF-β1的表达均明显上升(P<0.05,图2)。
2.3 基因芯片检测 通过基因芯片对eIF6+/+及eIF6+/-小鼠的M2巨噬细胞基因表达谱进行检测,最终筛选出1716个差异表达基因,其中与eIF6+/+小鼠比较,在eIF6+/-小鼠M2巨噬细胞中下调的基因有851个,上调的基因有865个(图3)。与eIF6+/-相比,eIF6野生型小鼠M2巨噬细胞中纤维化相关基因VEGF显著下调(eIF6+/+/eIF6+/-=0.75,P<0.05)、MMP-2显著上调(eIF6+/+/eIF6+/-=1.3,P<0.05)、TIMP-2显著下调(eIF6+/+/eIF6+/-=0.65,P<0.05),其他与创面愈合及纤维化相关的细胞因子如表皮生长因子(EGF)、TGF-β1、成纤维细胞生长因子(FGF)、血小板衍生因子(PDGF)等差异无统计学意义(数据未列出)。
2.4 RT-PCR验证芯片检测结果 RT-PCR检测显示,与eIF6+/-小鼠相比,eIF6+/+小鼠M2巨噬细胞中VEGF、TIMP-2表达下降(P<0.05),MMP-2表达上升(P<0.05),与基因芯片结果吻合(图4),而EGF、TGF-β1、FGF、PDGF等两组之间表达差异无统计学意义(数据未列出)。
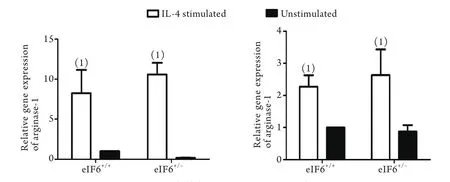
图2 M2巨噬细胞中精氨酸酶1、TGF-β1的表达(RT-PCR)Fig. 2 Expression of arginase-1 and TGF-β1in M2 macrophages (RT-PCR)
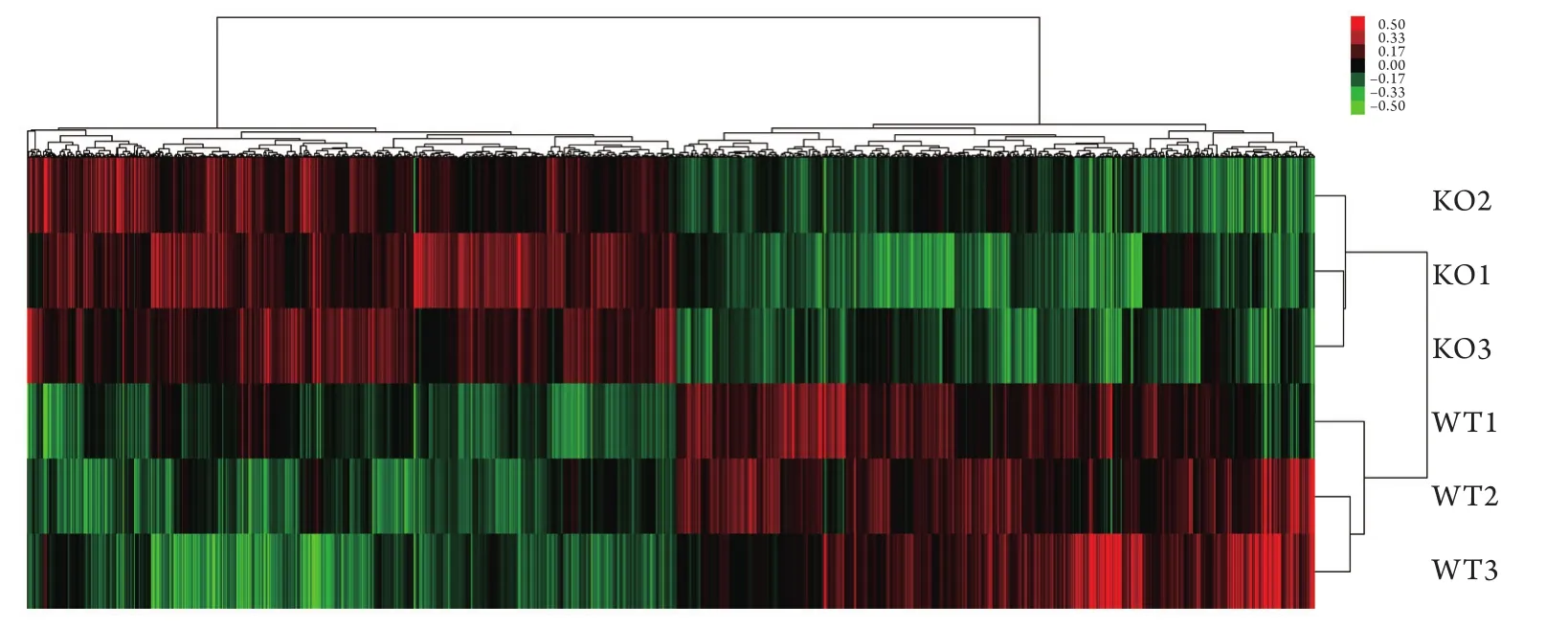
图3 芯片检测色码图Fig. 3 The cluster of gene chip
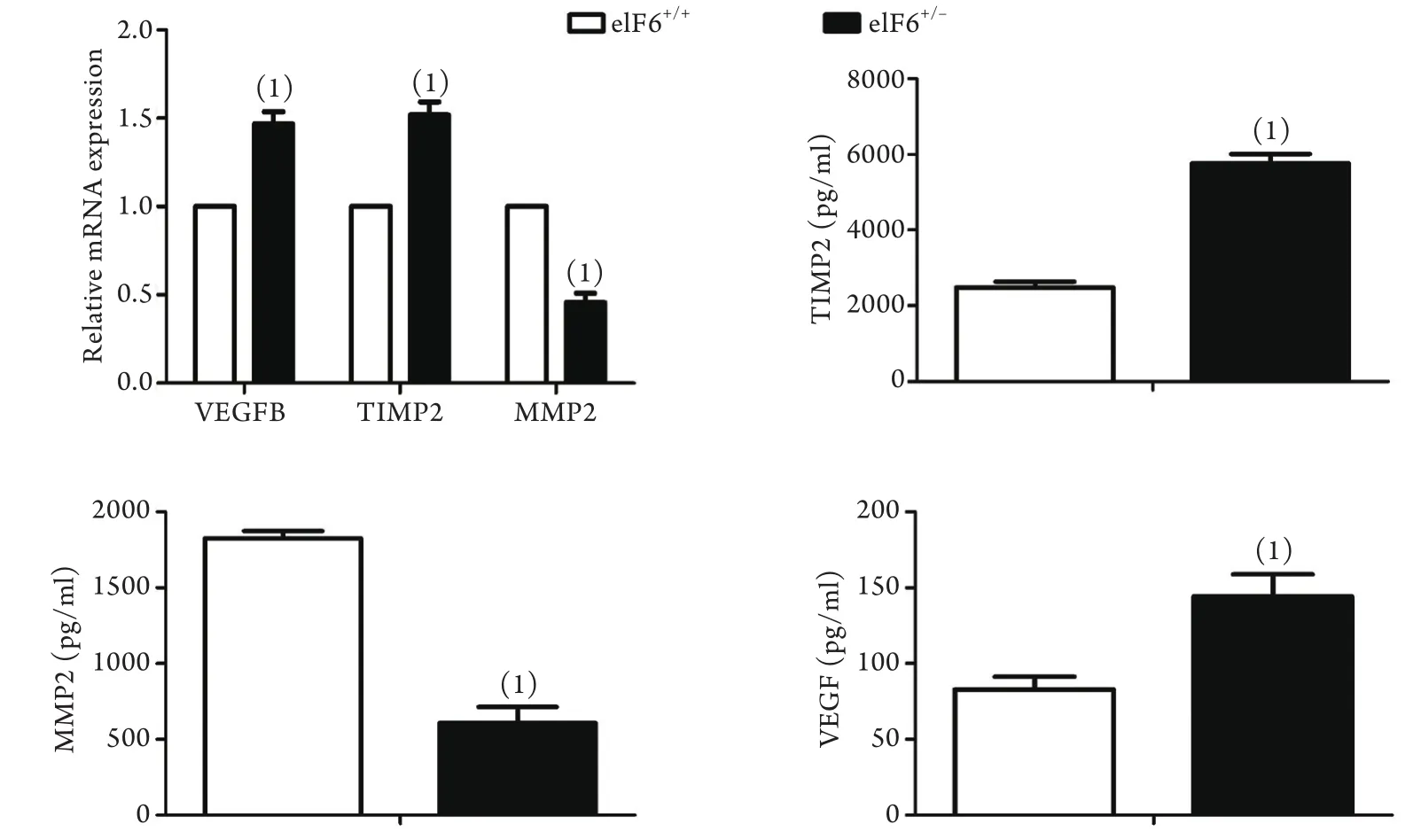
图4 M2巨噬细胞中TIMP-2、MMP-2和VEGF mRNA(RT-PCR)及蛋白(ELISA)的表达Fig. 4 Expression of TIMP-2, MMP-2 and VEGF mRNA (RT-PCR) and protein (ELISA) in M2 macrophages
2.5 ELISA验证芯片检测结果 分别收集eIF6+/+与eIF6+/-M2巨噬细胞培养上清。ELISA检测结果显示,与eIF6+/-小鼠相比,eIF6+/+小鼠M2巨噬细胞中VEGF、TIMP-2表达明显下降(P<0.05),MMP-2表达明显上升(P<0.05,图4),与基因芯片结果吻合。
3 讨 论
eIF6是一种具有抑制纤维化作用的基因,但其作用机制尚不明确,而巨噬细胞在创面愈合及纤维化过程中具有重要作用,为此本研究观察了eIF6对巨噬细胞的作用,旨在探讨其影响纤维化过程的具体机制。
巨噬细胞作为一种具有可塑性的多功能细胞群体,可分泌大量细胞因子激活成纤维细胞,同时能调节MMP-2/TIMP-2的平衡,参与ECM的代谢[11]。在体外培养条件下,采用Th2型细胞因子(IL-4、IL-13)可诱导产生M2型巨噬细胞[5-6]。细胞膜蛋白表达的差异是鉴定不同类型巨噬细胞的重要方法。文献报道F4/80+CD11c–CD206+的巨噬细胞为M2型巨噬细胞[12-13]。M2巨噬细胞能表达精氨酸酶1,参与精氨酸酶代谢,介导其损伤修复功能,另外还能分泌抗炎因子(IL-10、TGF-β1等)[14]。本实验通过分离腹腔巨噬细胞,加入IL-4(40ng/ml)刺激24h获得M2型巨噬细胞,应用流式细胞技术及RT-PCR对其标志物进行检测,发现CD206、精氨酸酶1、TGF-β1的表达与创面中M2型巨噬细胞一致[5]。
肉芽组织主要由成纤维细胞、炎性细胞、新生血管、ECM等组成[15],在创面愈合前期可填补创面缺损并促进创面愈合,最终转变为瘢痕组织,因此肉芽组织的多少决定了后期瘢痕的严重程度[16]。血管生成对肉芽组织的形成具有重要作用[17]。VEGF的一个重要功能就是促进血管内皮细胞的迁移和增殖,加快创面中血管的形成[18-19],而巨噬细胞能够分泌VEGF,启动血管生成[20]。研究显示,在增生性瘢痕中有大量微血管形成,同时VEGF的表达也明显上升[21]。另外有研究发现抑制VEGF能通过PI3K-Akt信号通路阻断TGF-β1产生,从而抑制肺纤维化的形成[22]。上述研究表明VEGF在瘢痕形成及纤维化过程发挥重要作用。本研究结果显示,与eIF6+/-小鼠比较,eIF6+/+小鼠M2型巨噬细胞中VEGF的表达明显下降,表明eIF6能抑制巨噬细胞中VEGF的产生,从而减少血管生成,影响瘢痕组织的形成。
瘢痕的另一个重要特征就是大量ECM沉积,ECM的代谢受基质金属蛋白酶(MMPs)的调节。MMPs是一类能够降解ECM的蛋白质,其中MMP-2又称明胶酶,是MMPs家族成员之一,在ECM重塑中具有重要作用[23],能水解Ⅰ/Ⅳ/Ⅴ型胶原、纤连蛋白、层粘连蛋白等ECM成分[24-25]。TIMPs为MMPs的特异性抑制因子,能与MMPs的锌离子活性中心结合,形成MMP-TIMP复合物,从而阻断MMP与底物结合,MMPs与TIMPs间的平衡是影响组织修复、新生表皮细胞爬行的重要影响因素。本研究观察了MMP-2与TIMP-2之间的比例,结果显示,与eIF6+/-小鼠相比,eIF6+/+小鼠M2巨噬细胞中MMP-2表达上升而TIMP-2表达下降,提示eIF6能调节MMP-2/TIMP-2之间的平衡,加快ECM的代谢,减少ECM沉积,减轻纤维化程度。
综上所述,本研究结果显示,eIF6能抑制VEGF产生,防止血管及肉芽组织过度增生,同时调节MMP-2/TIMP-2的平衡,促进ECM降解,减少ECM沉积,减轻纤维化(瘢痕)程度。eIF6作为一种新发现的抑纤维化基因,对其功能进行研究可能为减轻瘢痕形成及纤维化提供新的途径。
[1] Ploeger DT, Hosper NA, Schipper M,et al. Cell plasticity in wound healing: paracrine factorsof M1/M2 polarized macrophages influence thephenotypical state of dermal fibroblasts[J]. Cell Commun Signal, 2013, 11(1): 29.
[2] Lucas T, Waisman A, Ranjan R,et al. Differential roles of macrophages in diverse phases of skin repair[J]. J Immunol, 2010, 184(7): 3964-3977.
[3] Sindrilaru A, Peters T, Wieschalka S,et al. An unrestrained proinflammatory M1 macrophage population induced by iron impairs wound healing in humans and mice[J]. J Clin Invest, 2011, 121(3): 985-987.
[4] Mantovani A, Biswas SK, Galdiero MR,et al. Macrophage plasticity and polarization in tissue repair and remodelling[J]. J Pathol, 2012, 229(2): 176-185.
[5] Daley JM, Brancato SK, Thomay AA,et al. The phenotype of murine wound macrophages[J]. J Leukoc Biol, 2010, 87(1): 59-67.
[6] Sindrilaru A, Scharffetter-Kochanek K. Disclosure of the culprits: macrophages-versatile regulators of wound healing[J]. Adv Wound Care (New Rochelle), 2013, 2(7): 357-368.
[7] Miluzio A, Beugnet A, Volta V,et al. Eukaryotic initiation factor 6 mediates a continuum between 60S ribosome biogenesis and translation[J]. EMBO Rep, 2009, 10(5): 459-465.
[8] Ceci M, Gaviraghi C, Gorrini C,et al. Release of eIF6 (p27BBP) from the 60S subunit allows 80S ribosome assembly[J]. Nature, 2003, 426(6966): 579-584.
[9] Ray A, Dittel BN. Isolation of mouse peritoneal cavity cells[J]. J Vis Exp, 2010, (35): 1488.
[10] Raes G, De Baetselier P, Noël W,et al. Differential expression of FIZZ1 and Ym1 in alternatively versus classically activated macrophages[J]. J Leukoc Biol, 2002, 71(4): 597-602.
[11] Nishimura S, Manabe I, Nagasaki M,et al. CD8+effector T cells contribute to macrophage recruitment and adipose tissue inflammation in obesity[J]. Nat Med, 2009, 15(8): 914-920.
[12] Lee S, Huen S, Nishio H,et al. Distinct macrophage phenotypes contribute to kidney injury and repair[J]. J Am Soc Nephrol, 2011, 22(2): 317-326.
[13] Gordon S. Alternative activation of macrophages[J]. Nat Rev Immunol, 2003, 3(1): 23-35.
[14] Wynn TA, Barron L. Macrophages: master regulators of inflammation and fibrosis[J]. Semin Liver Dis, 2010, 30(3):245-257.
[15] Gautam MK, Purohit V, Agarwal M,et al.In vivohealing potential of Aegle marmelos in excision, incision, and dead space wound models[J]. Sci World J, 2014, 2014: 740107.
[16] Li L, Lv KY, Wu GS,et al. Advances in research on mechanisms of the effect of negative pressure wound treatment in wound healing[J]. Med J Chin PLA, 2014, 39(8): 664-668. [李磊, 吕开阳, 伍国胜, 等. 负压创伤治疗促进创面修复的作用机制研究进展[J]. 解放军医学杂志, 2014, 39(8): 664-668.]
[17] Rajkumar VS, Shiwen X, Bostrom M,et al. Platelet-derived growth factor-beta receptor activation is essential for fibroblast and pericyte recruitment during cutaneous wound healing[J]. Am J Pathol, 2006, 169(6): 2254-2265.
[18] Mori R, Tanaka K, de Kerckhove M,et al. Reduced FOXO1 Accelerates skin wound healing and attenuates scarring[J]. Am J Pathol, 2014, 184(9): 2465-2479.
[19] Senger DR, Ledbetter SR, Claffey KP,et al. Stimulation of endothelial cell migration by vascular permeability factor/ vascular endothelial growth factor through cooperative mechanisms involving the alphavbeta3 integrin, osteopontin, and thrombin[J]. Am J Pathol, 1996, 149(1): 293-305.
[20] Goto F, Goto K, Weindel K,et al. Synergistic effects of vascular endothelial growth factor and basic fibroblast growth factor on the proliferation and cord formation of bovine capillary endothelial cells within collagen gels[J]. Lab Invest, 1993, 69(5): 508-517.
[21] Chun Q, Zhiyong W, Fei S,et al. Dynamic biological changes in fibroblasts during hypertrophic scar formation and regression[J]. Int Wound J, 2014 [Epub ahead of print].
[22] Shin IS, Shin HK, Kim JC,et al. Role of Klotho, an antiaging protein, in pulmonary fibrosis[J]. Arch Toxicol, 2014 [Epub ahead of print].
[23] Swiderski RE, Dencoff JE, Floerchinger CS,et al. Differential expression of extracellular matrix remodeling genes in a murine model of bleomycin-induced pulmonary fibrosis[J]. Am J Pathol, 1998, 152(3): 821-828.
[24] McCawley LJ, Matrisian LM. Matrix metalloproteinases: they're not just for matrix anymore[J]! Curr Opin Cell Biol, 2001, 13(5): 534-540.
[25] Shen W, Li LB, Lu JY. Role of TGF-β, MMPs and TIMPs in persistent atrial fibrillation associated with rheumatic mitral stenosis[J]. Med J Chin PLA, 2014, 39(8):614-617. [盛炜, 李力兵, 陆江阳. TGF-β、MMPs和TIMPs在风湿性心脏病二尖瓣狭窄合并持续性房颤中的作用[J]. 解放军医学杂志, 2014, 39(8): 614-617.]
Effects of eIF6 on the expression of pro-inflammatory mediators derived from M2 macrophages
WEN Shuai, HU Xiao-hong, ZHANG Xiao-rong, HUANG Yong, HE Wei-feng, LUO Gao-xing, WU Jun*
Institute of Burn Research, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
*Corresponding author, E-mail: junwupro@126.com
This work was supported by the National High Technology Research and Development Program of China (863 Program) (2012AA020504), and the National Natural Science Foundation of China (81372082)
ObjectiveTo explore the effects of eukaryotic translation initiation factor 6 (eIF6) on the expression of fibrotic cytokines and metabolic enzymes derived from M2 macrophages.MethodseIF6 wild type mice (eIF6+/+) and eIF6 knock out mice (eIF6+/-) were used. Macrophages were collected from peritoneal lavage fluid, and they were stimulated with IL-4 for enrichment of M2 macrophages. The differential gene expressions of eIF6+/+and eIF6+/-M2 macrophages were studied with gene chip. The differential expression of genes was further confirmed with both RT-PCR and ELISA.ResultsThe gene chip showed that the expressions of VEGF and TIMP-2 were down-regulated in eIF6+/+macrophages compared with those in eIF6+/-M2 macrophages, while the expression of MMP-2 was up-regulated in eIF6+/+M2 macrophages (P<0.05). The result of RT-PCR and ELISA had confirmed that the RNA and protein expressions of VEGF and TIMP-2 were decreased in eIF6+/+macrophages compared with those in eIF6+/-M2 macrophages, while the RNA and protein expressions of MMP-2 were up-regulated in eIF6+/+M2 macrophages (P<0.05).ConclusioneIF6 not only inhibits the expression of VEGF, reduces angiogenesis and granulation tissue formation, but also enhances the extracellular matrix degradation and deposition by regulating the balance of MMP2/TIMP2, and thus attenuating the degree of fibrosis (scar formation).
eukaryotic initiation factor-6; macrophages; fibrosis
R644
A
0577-7402(2015)02-0104-06
10.11855/j.issn.0577-7402.2015.02.04
2014-11-05;
2015-01-18)
(责任编辑:胡全兵)
国家高技术研究发展计划(8 6 3计划)项目(2012AA020504);国家自然科学基金(81372082)
文帅,医学硕士。主要从事烧伤创面愈合与瘢痕方面的研究
400038 重庆 第三军医大学西南医院全军烧伤研究所(文帅、胡晓红、张小容、黄勇、贺伟峰、罗高兴、吴军)
吴军,E-mail:junwupro@126.com
