沉默TCF7L2对胰岛素抵抗HepG2细胞胰岛素降解酶表达的调控作用观察
2015-06-28夏佳佳郑晓雅刘婵胡钰梅任伟
夏佳佳,郑晓雅,刘婵,胡钰梅,任伟
沉默TCF7L2对胰岛素抵抗HepG2细胞胰岛素降解酶表达的调控作用观察
夏佳佳,郑晓雅,刘婵,胡钰梅,任伟
目的探讨沉默转录因子7类似物2(TCF7L2)对胰岛素抵抗(IR)HepG2细胞胰岛素降解酶(IDE)表达的调控作用及可能机制。方法将HepG2细胞分为空白组、TCF7L2干扰组、空载体组、IR组、IR+TCF7L2干扰组、IR+空载体组。采用高浓度胰岛素(5×10-6mol/L)持续作用24h诱导IR模型(IR-HepG2细胞)生成。以人TCF7L2 mRNA编码序列为干扰靶点构建TCF7L2特异性小干扰RNA慢病毒载体(LV-TCF7L2-siRNA)转染空白组及IR组细胞,空载体病毒转染空载体组及IR+空载体组细胞。qRT-PCR法检测各组细胞TCF7L2及IDE mRNA的表达,Western blotting检测各组细胞TCF7L2、IDE、胰岛素刺激后蛋白激酶B(AKT)、磷酸化蛋白激酶B(p-AKT)蛋白表达的变化,流式细胞术检测各组2-脱氧-D-葡萄糖(2-NBDG)荧光葡萄糖摄取率。结果与空白组比较,IR组细胞葡萄糖消耗量及2-NBDG摄取率均明显降低(P<0.01),证明IR细胞模型建立成功。qRT-PCR及Western blotting结果显示,IR组TCF7L2及IDE mRNA种蛋白表达水平均明显低于空白组(P<0.05),TCF7L2干扰组TCF7L2、IDE mRNA和蛋白表达水平较空白组、空载体组明显下降,IR+TCF7L2干扰组TCF7L2、IDE mRNA和蛋白表达水平较IR组、IR+空载体组均明显下降(P<0.05)。生理剂量胰岛素刺激后,IR组、IR+TCF7L2干扰组p-AKT蛋白水平较空白组明显下降(P<0.01),各组总AKT水平差异无统计学意义。TCF7L2干扰组2-NBDG荧光葡萄糖摄取率较空白组和空载体组明显下降,IR+TCF7L2干扰组2-NBDG荧光葡萄糖摄取率较IR组、IR+空载体组明显下降(P<0.01)。结论TCF7L2联合IDE致肝细胞IR,其机制可能与减少胰岛素信号通路关键酶p-AKT蛋白的表达有关。
糖尿病,2型;胰岛素抗药性;转录因子7样蛋白2;胰岛素溶酶
2型糖尿病(type 2 diabetes mellitus,T2DM)是遗传、环境及个体易感性相互作用所致的慢性疾病。全基因组关联研究(genome-wide association studies,GWAS)发现转录因子7类似物2(transcription factor 7-like 2,TCF7L2)及胰岛素降解酶(insulin degrading enzyme,IDE)基因突变可显著增加T2DM的发病风险。因此,减少风险基因的致病作用具有重要的临床意义。
TCF7L2是Wnt信号通路的重要组成部分,是迄今发现的与T2DM相关性最强的易感基因[1-2],携带TCF7L2风险基因可使葡萄糖刺激胰岛素分泌减少、肝糖异生及肝糖输出增加,最终使血糖水平升高[3-4]。IDE能特异性地降解胰岛素,维持体内胰岛素浓度的稳定。IDE基因突变或蛋白功能改变会影响胰岛素的代谢和降解,继而影响胰岛β细胞分泌及肝细胞降解胰岛素,导致胰岛素抵抗(insulin resistance,IR)及胰岛β细胞功能失常,从而导致T2DM[5]。Morrison等[6]检测了ob/ob糖尿病小鼠模型体内多个T2DM风险基因的表达,肝脏及脂肪组织中TCF7L2的表达及脂肪组织中IDE的表达与较瘦小鼠相比明显降低。本课题小组前期通过免疫共沉淀(chromatin immunoprecipitation,ChIP)技术发现TCF7L2与IDE基因启动子存在结合位点[7],但两者在致细胞IR过程中的相互影响及TCF7L2风险基因联合IDE易感基因的确切机制尚不清楚,且无相关研究报道。本研究通过转染外源性人TCF7L2小干扰RNA下调TCF7L2表达,探讨下调TCF7L2对肝细胞IDE表达的影响,并初步验证TCF7L2与IDE之间的相互关系和作用机制,为主要风险基因等致T2DM的发病机制研究及防治提供新的思路。
1 材料与方法
1.1 实验材料与试剂 猪胰岛素(Sigma公司);2-脱氧-D-葡萄糖(2-NBDG,Invitrogen公司);葡萄糖测定试剂盒(南京建成公司);细胞培养基RPMI 1640、胰酶(Gibco公司);胎牛血清(Hyclone公司);PBS缓冲液(博士德公司);TCF7L2、磷酸化蛋白激酶B(p-AKT)及蛋白激酶B(AKT)抗体(Cell Signaling Technology公司);IDE抗体(Abcam公司);β-actin一抗(Protein-tech公司);鼠、兔二抗(中杉金桥公司);总RNA提取、反转录、PCR扩增试剂盒及引物(TaKaRa公司);总蛋白提取试剂盒(碧云天公司)。
1.2 细胞培养及HepG2-IR模型建立 人肝癌HepG2细胞株由重庆医科大学生命科学院提供,在含10%FBS的RPMI 1640培养基37℃、5%CO2、95%空气条件下培养,取对数生长期细胞置96孔板用于实验,待细胞生长至80%~90%融合度,用无血清RPMI 1640培养液饥饿12h。空白组为无细胞及血清的RPMI 1640培养液;对照组为无血清培养的细胞;实验组为胰岛素终浓度分别为5×10-9、5×10-8、5×10-7、5×10-6、5×10-5mol/L的培养液。各组细胞孵育24h,收集细胞培养上清液,用葡萄糖测定试剂盒(God-Pod法)检测上清液的葡萄糖浓度。以空白组为参照,计算24h各组细胞的葡萄糖消耗量。根据所得结果,选取形成IR且对细胞伤害最小的胰岛素浓度,观察该浓度胰岛素作用不同时间对HepG2细胞IR的影响。
1.3 HepG2细胞IR模型的鉴定 用GOD-POD法检测培养液上清的葡萄糖含量[8]。以空白组为参照,计算24h葡萄糖消耗量。每组6孔,实验重复3次。用荧光标记的2-NBDG检测两组细胞的葡萄糖摄取率。每组3孔,实验重复3次。用荧光标记的2-NBDG进行葡萄糖摄取实验,方法参考文献[9]并稍作改进。按1×104/孔密度将HepG2细胞接种到96孔板,对照组给予RPMI 1640培养液,IR组给予含5×10-6mol/L胰岛素RPMI 1640培养液,分别孵育24h后可进行2-NBDG检测。孵育24h后,移除原有细胞培养液,用KRH溶液洗涤3次,用荧光酶标仪(激发波长488nm,发射波长520nm)测定荧光值,记为Fa。用2-NBDG(50μmol/L)于37℃孵育细胞15min,用KRH洗涤5次至2-NBDG液变澄清,用荧光酶标仪测定荧光值,记为Fb。用含100nmol/L胰岛素的2-NBDG(50μmol/L)于37℃孵育15min,用KRH洗涤5次至2-NBDG液变澄清,用荧光酶标仪测定荧光值,记为Fc。最后用MTT比色法测定细胞密度,用普通酶标仪测定其吸光度(A)值。葡萄糖摄取率计算公式为:(Fc-Fb)/(Fb-Fa)/A[10]。
1.4 TCF7L2基因干扰载体的构建、鉴定及慢病毒包装 根据人TCF7L2基因序列(GenBank NM-001198525)、siRNA原理设计并合成siRNA。正义链:5'-CCGGTAGCTGAGTGCACGTTGAAAGCTC GAGCTTTCAACGTGCACTCAGCTATTTTTG-3';反义链:5'-AATTCAAAAATAGCTGAGTGCACG TTGAAAGCTCGAGCTTTCAACGTGCACTCAGC TA-3'。由上海生博生物工程有限公司合成干扰质粒并用慢病毒包装,同时合成对照慢病毒,并验证序列的正确性。
1.5 TCF7L2慢病毒转染细胞 将细胞以1×105/ml密度接种于6孔板中(1ml/孔)进行IR诱导,培养24h,根据病毒滴度及最佳MOI值,分别加入TCF7L2基因RNAi慢病毒及空载体病毒上清液,与HepG2及IR-HepG2细胞共培养12h后换液,48h后加入嘌呤霉素(1.0μg/ml)建立稳定细胞株,用荧光显微镜观察转染效率。转染后提取各组细胞总RNA及蛋白用于实验。实验分组:空白组(A组),TCF7L2干扰组(LV-TCF7L2-siRNA转染组,B组),空载体组(乱序慢病毒转染组,C组),IR组(用含5×10-6mol/L胰岛素处理组,D组),IR+TCF7L2干扰组(IR+ LVTCF7L2-siRNA转染组,E组),IR+空载体组(IR+乱序慢病毒转染组,F组)。生理剂量胰岛素刺激后重新分组为:空白组(a组),TCF7L2干扰组+胰岛素刺激组(b组),TCF7L2干扰组-胰岛素刺激组(c组),IR+胰岛素刺激组(d组),IR+TCF7L2干扰+胰岛素刺激组(e组),IR+TCF7L2干扰组-胰岛素刺激组(f组)。
1.6 实时定量PCR检测各组细胞TCF7L2及IDE mRNA的表达量 根据GenBank中TCF7L2、IDE及GAPDH基因序列设计引物。人TCF7L2:上游5'-TGCGTTCGCTACATACAAGGTG-3',下游5'-TCTGTGACTTGGCGTCTCGG-3',产物长度127bp;人IDE:上游5'-GCTCCTCAAAGACTCACT CAACG-5',下游5'-TTGGCTGCTTGTCATTGTAAC CT-3',产物长度125bp;人G A PDH:上游5'-CTTTGGTATCGTGGAAGGACTC-3',下游5'-GTAGAGGCAGGGATGATGTTCT-3',产物长度323bp。Trizol法提取细胞总RNA,测RNA浓度、纯度,反转录合成cDNA,以cDNA为模板进行扩增,以GAPDH为内参。用SYBR Green荧光定量PCR进行分析。扩增条件:95℃ 30s,95℃ 5s,58℃ 30s;72℃ 45s,共40个循环;72℃ 10min。分析熔解及扩增曲线。采用Opticon2-Real-time-PCR仪(美国Bio-Rad公司)检测TCF7L2及IDE表达量(2-ΔΔCt值)。实验重复3次。
1.7 Western blotting检测各组细胞目的蛋白的表达量 提取各组细胞总蛋白,采用BCA试剂盒测定蛋白浓度。蛋白定量后行SDS-PAGE电泳,将蛋白电转至硝酸纤维素膜,5%BSA封闭后加入一抗(TCF7L2、IDE、p-AKT Rabbit mAb及AKT Rabbit mAb),4℃过夜后,TBST洗膜,与相应二抗孵育2h,ECL化学发光法显影。采用Quantity-One软件分析图像灰度值。ATCF7L2/Aβ-actin值表示TCF7L2蛋白的相对表达量,AIDE/Aβ-actin值表示IDE蛋白的相对表达量。
1.8 流式细胞术检测各组细胞2-NBDG摄取率按5×105/孔密度将HepG2细胞接种到6孔板,孵育24h,给予相应处理因素后,移除细胞原有培养液,分别加入配好的2-NBDG溶液,孵育2h后移除2-NBDG溶液,用KRH溶液洗涤3次直至2-NBDG澄清,胰酶消化各组细胞,终止,离心,用1ml PBS重悬于EP管中,用流式细胞仪检测各组细胞2h的2-NBDG摄取率。
1.9 统计学处理 采用SPSS 17.0软件进行统计分析。计量资料数据以表示,多组间比较采用单因素方差分析(One-way ANOVA),两组间比较采用独立样本Tukey检验。P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度胰岛素对各组HepG2细胞葡萄糖消耗量的影响 采用GOD-POD法检测各组葡萄糖消耗量,孵育24h后,各组间差异有统计学意义(P<0.05)。胰岛素浓度由5×10-9mol/L增加至5×10-5mol/L时,细胞培养液中葡萄糖含量依次增加,即细胞葡萄糖消耗量逐渐减少,5×10-6mol/L时达到最小(P<0.01,图1)。

图1 不同浓度胰岛素对HepG2细胞糖消耗的影响(n=6,±s)Fig.1 Effects of different concentrations insulin on the glucose consumption of HepG2 cells (n=6,±s)
2.2 胰岛素作用不同时间对HepG2细胞葡萄糖消耗的影响 以5×10-6mol/L的胰岛素培养HepG2细胞,随作用时间延长,胰岛素组葡萄糖消耗与对照组比较明显降低,IR状态从24h开始持续到60h,差异均有统计学意义(P<0.01,图2)。

图2 胰岛素作用不同时间对HepG2细胞葡萄糖消耗的影响(n=6,±s)Fig.2 Effect of the acting time of insulin on glucose consumption of HepG2 cells (n=6,±s)
2.3 两组HepG2细胞葡萄糖摄取率比较 2-NBDG法检测显示,与对照组(82.5%±8.2%)相比,IR组细胞葡萄糖摄取率(37.4%±6.5%)明显减少,荧光显微镜显示空白细胞胞内摄取2-NBDG明显增加,IR-HepG2细胞内2-NBDG显著减少,都集中在胞膜上,与正常对照组细胞比较差异有统计学意义(P<0.05,n=3,图3)。
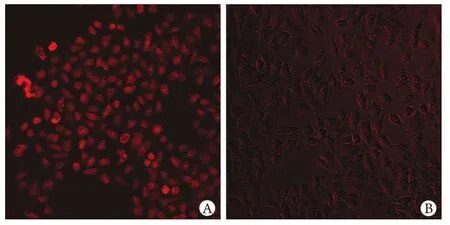
图3 两组细胞2-NBDG葡萄糖摄取率(荧光显微镜)Fig.3 2-NBDG glucose uptake rate of cells in two groups (Fluorescence microscope)
2.4 TCF7L2干扰慢病毒转染细胞效率观察 采用荧光显微镜观察TCF7L2干扰慢病毒对两组细胞的转染效果,结果显示,转染慢病毒并用嘌呤霉素筛选后,几乎所有细胞均带有GFP绿色荧光蛋白,表明转染效果良好(图4)。

图4 重组慢病毒转染HepG2的荧光图像(×200)Fig.4 Fluoroscopic image of HepG2 infected with recombinant lentivirus (×200)
2.5 HepG2细胞内TCF7L2、IDE mRNA的表达与空白组相比,IR组TCF7L2、IDE mRNA表达明显减少(P<0.01);与空白组、空载体及IR组、IR+空载体组相比,TCF7L2干扰组及IR+TCF7L2干扰组TCF7L2、IDE mRNA表达明显减少(P<0.01,图5)。
2.6 沉默TCF7L2对HepG2细胞蛋白表达影响 与空白组相比,IR组TCF7L2、IDE蛋白表达明显增加(P<0.01);与空白组、空载体组相比,TCF7L2干扰组TCF7L2、IDE蛋白表达明显减少(P<0.05,P<0.01);与IR组、IR+空载体组相比,IR+TCF7L2干扰组TCF7L2、IDE蛋白表达明显减少(P<0.01,图6)。生理剂量胰岛素(100nmol/L)刺激后,与空白组相比,IR组、TCF7L2干扰组及IR+TCF7L2干扰组p-AKT表达均明显减少(P<0.01);与IR组相比,IR+TCF7L2干扰组p-AKT表达明显减少(P<0.01);各组之间总AKT表达差异无统计学意义(P>0.05,图7)。
2.7 各组细胞2-NBDG摄取率比较 流式细胞仪检测结果显示,与空白组、空载体组相比,TCF7L2干扰组2-NBDG荧光葡萄糖摄取率明显降低(P<0.01);与IR组、IR+空载体组相比,IR+TCF7L2干扰组2-N B D G荧光葡萄糖摄取率明显降低(P<0.01);与空白组相比,IR组、IR+空载体组、IR+TCF7L2干扰组2-NBDG荧光葡萄糖摄取率明显降低(P<0.01,图8)。
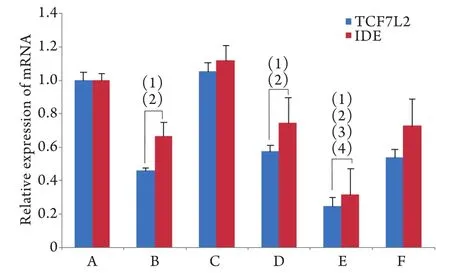
图5 HepG2细胞TCFL2、IDE mRNA表达Fig.5 Expressions of TCF7L2 and IDE mRNA in HepG2 cells
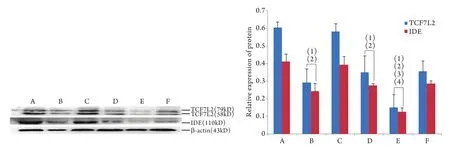
图6 各组HepG2细胞TCF7L2、IDE蛋白的表达Fig.6 Expressions of TCF7L2 and IDE protein in HepG2 cells

图7 各组HepG2细胞p-AKT、AKT蛋白的表达Fig.7 Expressions of p-AKT and AKT protein in HepG2 cells
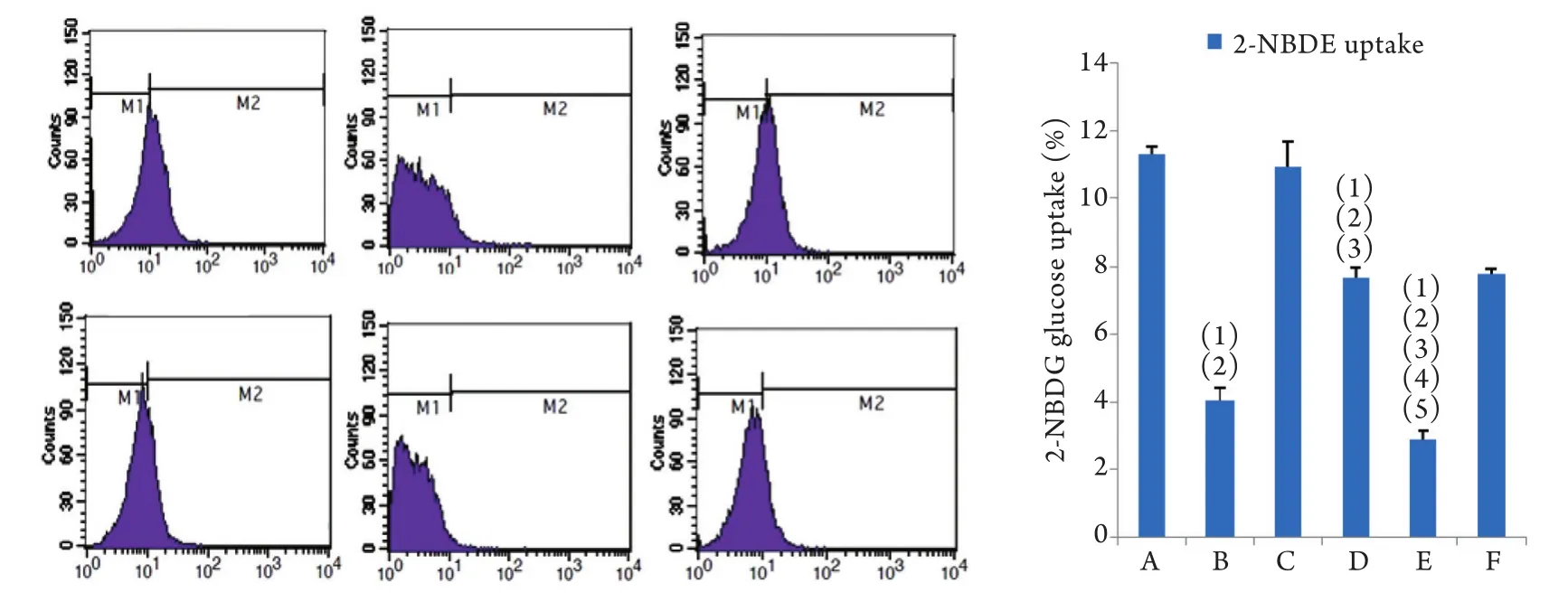
图8 流式细胞仪检测各组细胞2-NBDG摄取率Fig.8 2-NBDG uptake rate in each group of HepG2 cells (Flow cytometry)
3 讨 论
随着生活水平的不断提高,糖尿病发病率逐年升高,并呈年轻化趋势,严重威胁人类的生命健康及生活质量[11]。IR即胰岛素敏感性下降,是T2DM主要的发病机制之一[12],表现为体内胰岛素介导的葡萄糖利用率下降.肝细胞是形成IR的主要场所,并已在多种人群中得到验证[13-15]。GWAS发现多种基因参与了IR形成,如TCF7L2及IDE基因突变会增加T2DM的发病风险。
TCF7L2基因又称T细胞转录因子4(TCF-4),位于人类染色体10q25.3[16]。TCF7L2基因突变可致胰岛β细胞分化、成熟障碍,并阻断前胰岛素转化为生物活性胰岛素,使血胰岛素分泌减少,血糖升高。Takamoto等[17]研究发现,TCF7L2基因突变小鼠体内胰岛β细胞体积及胰岛素分泌显著减少,证实TCF7L2通过调节β细胞数量而在糖代谢中发挥重要作用。Oh等[18]研究发现,IR小鼠TCF7L2表达量明显减少,下调TCF7L2可增加肝糖异生基因的表达,使血糖水平升高,过表达TCF7L2可增加肝胰岛素信号通路中PI3K/AKT磷酸化水平,使肝葡萄糖摄取增加,从而提高肝脏合成糖原的能力。本研究结果显示,IR-HepG2细胞TCF7L2 mRNA及蛋白表达量均明显减少,胰岛素刺激后的p-AKT水平也显著降低,与上述研究结果一致,进一步证实了TCF7L2在肝糖调节中发挥着重要作用。
IDE基因位于人类染色体10q23-q25,IDE蛋白可高度特异性地降解胰岛素,促进胰岛素受体再循环和新的胰岛素分泌,维持体内胰岛素浓度稳定[19-20]。肝脏是胰岛素降解的主要器官,IDE表达减少可引起胰岛素降解障碍,增加高胰岛素血症、IR等T2DM表型的发生[21]。Galagovsky等[22]对果蝇的研究证实,IDE是胰岛素信号通路中的重要调节分子,IDE表达下降使AKT磷酸化水平降低,导致胰岛素敏感性下降。Abdul-Hay等[23]认为IDE表达减少使肝胰岛素受体受损,其机制可能与胰岛素信号通路中活性成分抑制致高胰岛素血症有关。Maianti等[24]发现了可特异性阻断IDE降解的小分子化合物并阐明了其分子结构,IDE抑制剂可提高糖耐量、降低血糖水平,故IDE抑制剂可成为糖尿病治疗的一个靶点。本研究结果显示,IR-HepG2细胞中IDE mRNA及蛋白表达量均明显减少,再次验证了IDE减少与IR密切相关。
单个T2DM易感基因的致病作用是微弱的,近年来的研究热点开始转为易感基因的联合作用。TCF7L2和IDE均位于人类10号染色体上,全基因组关联研究显示两者有强大的连锁效应,在致T2DM上有联合作用。Nordman等[25]研究发现TCF7L2基因rs7903146与IDE基因rs2251101联合作用可显著增加T2DM的易感性(P=0.0257,OR=1.398)。Kirkpatrick等[26]研究表明,在人的胰岛β细胞中TCF7L2和IDE基因的mRNA和蛋白表达水平呈正相关(r分别为0.509、0.720,P<0.05)。本课题小组在前期研究中采用染色质免疫共沉淀技术(ChIP),在HepG2细胞中发现并证实特异性TCF7L2抗体可以与IDE基因转录启动子的特异区域结合,并采用RNA干扰技术特异性沉默TCF7L2基因的表达,证实TCF7L2表达减少可引起IDE mRNA及蛋白表达水平明显下降,从而证实TCF7L2是IDE基因表达调控中的重要转录因子[27]。以上研究均提示TCF7L2与IDE关系密切,但目前TCF7L2和IDE基因之间的联合作用及具体机制尚不完全清楚。
本研究采用特异性TCF7L2-siRNA慢病毒载体,分别在对照及IR细胞下调TCF7L2的表达后观察IDE的变化,结果显示:IR细胞模型TCF7L2及IDE均明显低于对照组;下调TCF7L2基因的表达后,对照组及IR组IDE的表达明显减少;采用生理剂量胰岛素刺激后,下调TCF7L2表达可使p-AKT水平降低,使肝脏主要胰岛素信号通路之一受阻;IR组及下调TCF7L2表达可明显降低细胞葡萄糖摄取率。正常生理条件下,血糖调节依赖胰岛素水平,糖负荷增加促使胰岛β细胞分泌胰岛素,胰岛素与靶腺上的胰岛素受体结合,从而激活PI3K/AKT信号通路磷酸化,增加糖摄取、糖储存、糖利用[28]。故PI3K-AKT信号通路是肝脏调节葡萄糖转运的重要调控点。本研究下调TCF7L2表达后,IDE表达量明显减少,使胰岛素降解减少,导致外周IR,胰岛素介导的AKT激活被抑制,p-AKT蛋白表达水平下降,致下游信号分子与靶细胞胰岛素受体结合,从而抑制酪氨酸磷酸化激活,使细胞葡萄糖摄取减少。该现象提示TCF7L2联合IDE是调控胰岛素信号通路的一个关键因子。
综上所述,TCF7L2可通过IDE表达水平影响IR的形成,TCF7L2表达下降可能参与IR发生的始动环节,而采用生物学方法干预TCF7L2表达,改变IDE水平则可能有助于改善IR。
[1] Liu Z, Habener JF. Wnt signaling in pancreatic islets[J]. Adv Exp Med Biol, 2010, 654: 391-419.
[2] Grant SF, Hakonarson H, Schwartz S. Can the genetics of type 1 and type 2 diabetes shed light on the genetics of latent autoimmune diabetes in adults[J]? Endocr Rev, 2010, 31(2): 183-193.
[3] Ip W, Shao W, Chiang YT,et al. The Wnt signaling pathway effector TCF7L2 is upregulated by insulin and represses hepatic gluconeogenesis[J]. Am J Physiol Endocrinol Metab, 2012, 303(9): E1166-E1176.
[4] Zheng XY, Ren W, Zhang SH,et al. Correlation between single nucleotide polymorphisms of rs7903146 and rs11196218 at TCF7L2 gene and the early phase insulin secretion of newly diagnosed patients with type 2 diabetes[J]. Med J Chin PLA, 2011, 36(3): 269-272. [郑晓雅, 任伟, 张素华, 等. TCF7L2基因rs7903146和rs11196218单核苷酸多态性与新诊断2型糖尿病患者早相胰岛素分泌的相关性分析[J]. 解放军医学杂志, 2011, 36(3): 269-272.]
[5] Groves CJ, Wiltshire S, Smedley D,et al. Association and haplotype analysis of the insulin-degrading enzyme (IDE) gene, a strong positional and biological candidate for type 2 diabetes susceptibility[J]. Diabetes, 2003, 52(5): 1300-1305.
[6] Morrison F, Locke J, Arif M,et al. Expression profiling of type 2 diabetes susceptibility genes in the pancreatic islets, adipose tissue and liver of obese mice[J]. Exp Clin Endocrinol Diabetes, 2013, 121(7): 413-419.
[7] Xu D, Ren W, Zheng XY,et al. Detection of TCF7L2 binding to IDE gene promoters by chromatin immunoprecipitation[J]. Life Sci Res, 2012, 16(1): 54-58. [许丹, 任伟, 郑晓雅, 等. 染色质免疫沉淀技术分析HePG2细胞TCF7L2蛋白与IDE 基因转录启动子的结合[J]. 生命科学研究, 2012, 16(1): 54-58.]
[8] Chen Q, Xia YP, Qiu ZY. Establishment of insulin-resistant HepG2 cell model induced by high concentration of insulin[J]. Chin J Cell Biol, 2005, 27(3): 334-338. [陈秋, 夏永鹏, 邱宗荫.胰岛素耐受HepG2细胞模型的建立[J]. 细胞生物学杂志, 2005, 27(3): 334-338.]
[9] Wang L, Xu ML, Rasmussen SK,et al. Vomifoliol 9-O-αarabinofuranosyl (1→6)-β-D-glucopyranoside from the leaves of Diospyros Kaki stimulates the glucose uptake in HepG2 and 3T3-L1 cells[J]. Carbohydr Res, 2011, 346(10): 1212-1216.
[10] Yang S, Lv Q, Luo T,et al. Metformin inhibits expression and secretion of PEDF in adipocyte and hepatocyteviapromoting AMPK phosphorylation[J]. Mediators Inflamm, 2013, 2013: 429207.
[11] Temelkova-Kurktschiev T, Stefanov T. Lifestyle and genetics in obesity and type 2 diabetes[J]. Exp Clin Endocrinol Diabetes, 2012, 120(1): 1-6.
[12] Liu Y, Li L, Yang GY,et al. Correlation between plasma adipose triglyceride lipase levels and obesity and insulin resistance relevant factors[J]. Med J Chin PLA, 2010, 35(7): 871-874. [刘颖, 李伶, 杨刚毅, 等. 血浆脂肪甘油三酯脂酶水平与肥胖、胰岛素抵抗相关因素的关系研究[J]. 解放军医学杂志, 2010, 35(7): 871-874.]
[13] Morris AP, Voight BF, Teslovich TM,et al. Large-scale association analysis provides insights into the genetic architecture and pathophysiology of type 2 diabetes[J]. Nat Genet, 2012, 44(9): 981-990.
[14] Saxena R, Elbers CC, Guo Y,et al. Large-scale gene-centric metaanalysis across 39 studies identifies type 2 diabetes loci[J]. Am J Hum Genet, 2012, 90(3): 410-425.
[15] Tan JT, Ng DP, Nurbaya S,et al. Polymorphisms identified through genome-wide association studies and their associations with type 2 diabetes in Chinese, Malays, and Asian-Indians in Singapore[J]. J Clin Endocrinol Metab, 2010, 95(1): 390-397.
[16] Duval A, Busson-Leconiat M, Berger R,et al. Assignment of the TCF-4 (TCF7L2) to human chromosome band 10q25.3[J]. Cytogenet Cell Genet, 2000, 88(3-4): 264-265.
[17] Takamoto I, Kubota N, Nakaya K,et al. TCF7L2 in mouse pancreatic beta cells plays a crucial role in glucose homeostasis by regulating beta cell mass[J]. Diabetologia, 2014, 57(3): 542-553.
[18] Oh KJ, Park J, Kim SS,et al. TCF7L2 modulates glucose homeostasis by regulating CREB- and FoxO1-dependent transcriptional pathway in the liver[J]. PLoS Genet, 2012, 8(9): e1002986.
[19] Kuo WL, Ronser MR, Perman BK,et al. Function of Zincbinding domain of human insulin-degrading enzyme[J]. J Biol Chem, 1999, 274(12): 3943-3946.
[19] Pascoe L, Tura A, Patel KS,et al. Common variants of the novel type 2 diabetes genes CDKAL1 and HHEX/IDE are associated with decreased pancreatic beta-cell function[J]. Diabetes, 2007, 56(12): 3101-3104.
[20] Liu YZ, Gao ML, Ma L,et al. Influence of anesthesia and surgery on the expression of transport receptors and catabolic enzymes of amyloid β-protein in aged rats[J]. Med J Chin PLA, 2014, 39(9): 720-724. [刘永哲, 高明龙, 马丽, 等. 麻醉和手术对老年大鼠脑内淀粉样β蛋白转运相关受体及降解酶表达的影响[J]. 解放军医学杂志, 2014, 39(9): 720-724.]
[21] Pascoe L, Tura A, Patel KS,et al. Common variants of the novel type 2 diabetes genes CDKAL1 and HHEX/IDE are associated with decreased pancreatic beta-cell function[J]. Diabetes, 2007, 56(12): 3101-3104.
[22] Galagovsky D, Katz M J, Acevedo J M,et al. The Drosophila insulin-degrading enzyme restricts growth by modulating the PI3K pathway in a cell autonomous manner[J]. Mol Biol Cell, 2014, 25(6): 916-924.
[23] Abdul-Hay SO, Kang D, McBride M,et al. Deletion of Insulindegrading enzyme elicits antipodal, age-dependent effects on glucose and insulin tolerance[J]. PLoS One, 2011, 6(6): e20818.
[24] Maianti JP, McFedries A, Foda ZH,et al. Anti-diabetic activity of insulin-degrading enzyme inhibitors mediated by multiple hormones[J]. Nature, 2014, 511(7507): 94-98.
[25] Nordman S, Ostenson CG, Efendic S,et al. Loci of TCF7L2, HHEX and IDE on chromosome 10q and the susceptibility of their genetic polymorphisms to type 2 diabetes[J]. Exp Clin Endocrinol Diabetes, 2009, 117(4): 186-190.
[26] Kirkpatrick CL, Marchetti P, Purrello F,et al. Type 2 diabetes susceptibility gene expression in normal or diabetic sorted human alpha and beta cells: correlations with age or BMI of islet donors[J]. PLoS One, 2010, 5(6): e11053.
[27] Xu D, Ren W, Zheng XY,et al. Regulation effects of transcription factor TCF7L2 on expression of IDE[J]. Word Sci-Tech R&D, 2012, 34(3): 485-488. [许丹, 任伟, 郑晓雅, 等. 转录因子TCF7L2在HepG2细胞IDE表达调控中的作用[J]. 世界科技研究与发展, 2012, 34(3): 485-488.]
[28] Leto D, Saltiel AR. Regulation of glucose transport by insulin: traffic control of GLUT4[J]. Nat Rev Mol Cell Biol, 2012, 13(6): 383-396.
Regulation effect of TCF7L2 gene silence on the expression of insulin degrading enzyme in insulin resistant HepG2 cells
XIA Jia-jia, ZHENG Xiao-ya, LIU Chan, HU Yu-mei, REN Wei*
Department of Endocrinology, First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
*Corresponding author, E-mail: weiren67@aliyun.com
This work was supported by the Medical Science and Technology Research Project of Chongqing Health Bureau (2008-2-96), the Ministry of Education Fund Project (20135503120001), and the National Key Clinical Specialties Construction Program of China (2011)
ObjectiveTo evaluate the effects of transcription factor 7-like 2 (TCF7L2) silence on the expression of insulin degrading enzyme (IDE) in insulin resistance (IR) model HepG2 cells and its possible mechanism.MethodsThe HepG2 cells were divided into blank group, TCF7L2 interference group, empty vector group, IR group, IR+TCF7L2 interference group and IR+empty vector group. IR-HepG2 cell model was induced byin vitrocultivation of the cells in high concentration of insulin (5×10-6mol/L) for 24 hours; GOD-POD and 2-NBDG method was used to verify successful reproduction of IR-cell model. TCF7L2 specific siRNA lentivirus vector (LV-TCF7L2-siRNA) was constructed with TCF7L2 mRNA coding sequence as the interference target, and it was used to transfect the cells in blank group and IR group. Empty vector virus was used to transfect the cells in empty vector group and IR+empty vector group. The expressions of TCF7L2 and IDE mRNA were detected by qRT-PCR, and the changes in the expression of TCF7L2, IDE, insulin stimulated protein kinase B(AKT) and phosphorylated protein kinase B(p-AKT) were detected by Western blotting. The uptake rate of 2-deoxy-D-glucose (2-NBDG) was analyzed by flow cytometry.ResultsCompared with that in control group, the glucose consumption and the uptake rate of 2-NBDG significantly decreased in IR group (P<0.01), provingthat the IR cell model had been reproduced successfully. Western blo tt ing and qRT-PCR revealed that the expression levels of TCF7L2 and IDE mRNA and protein were obviously decreased in IR group compared with that in blank group (P<0.05), in TCF7L2 interference group than in blank group and empty vector group, and in IR+TCF7L2 interference group than in blank group and IR+empty vector group (P<0.05). A ft er physiological insulin stimulation, the expression levels of p-AKT protein decreased more signi fi cantly in IR group and IR+TCF7L2 interference group than in blank group (P<0.01), while no statistically signi fi cant di ff erence in the total AKT protein level was found among all the groups. 2-NBDG uptake rate was significantly decreased in TCF7L2 interference group as compared with that in blank group and empty vector group, and also in IR+TCF7L2 interference group than in IR group and IR+empty vector group, respectivelyP<0.01.ConclusionThe mechanism of IR induced by the interaction of TCF7L2 and IDE might be related to the decreased expression of the insulin signaling pathway key enzyme p-AKT protein.
diabetes mellitus, type 2; insulin resistance; transcription factor 7-like 2 protein; insulinase
R587.1
A
0577-7420(2015)02-0110-07
10.11855/j.issn.0577-7402.2015.02.05
�2014-09-16;
2014-12-08)
(责任编辑:张小利)
重庆市卫生局医学科学技术项目(2008-2-96);教育部基金项目(20135503120001);国家临床重点专科建设项目(2011)
夏佳佳,硕士研究生。主要从事成人生长激素缺乏症及2型糖尿病胰岛素抵抗方面的研究
400016 重庆 重庆医科大学附属第一医院内分泌科(夏佳佳、郑晓雅、刘婵、胡钰梅、任伟)
任伟,E-mail:weiren67@aliyun.com
