聚天冬酰胺衍生物的合成及细胞毒性研究
2015-08-24杨翠红韩京华刘金剑张玉民高红林董文慧王燕铭
杨翠红,韩京华,刘金剑,张玉民,高红林,董文慧,王燕铭△
聚天冬酰胺衍生物的合成及细胞毒性研究
杨翠红1,韩京华2,刘金剑1,张玉民1,高红林1,董文慧2,王燕铭2△
目的 合成一种聚天冬酰胺衍生物并对其细胞水平的安全性进行评价,为其作为药物载体应用提供研究基础。方法 通过L-天冬氨酸热缩聚合成聚琥珀酰亚胺,利用苯丙氨酸甲酯盐酸盐和乙醇胺对聚琥珀酰亚胺进行开环反应得到载体PSI-Phe-EA;利用1H NMR进行聚合物结构表征;采用内标法磁氢谱计算其开环率;通过水溶性的比较验证其亲水性变化;采用MTT法对聚合物的细胞增殖抑制进行研究,利用倒置显微镜观察聚合物对细胞微观形态的影响;利用碘化丙啶(PI)染色法通过流式细胞仪研究聚合物对细胞周期的影响。结果1H NMR确证了开环衍生物PSI-Phe-EA的结构,PSI的开环率为40%;乙醇胺开环后聚合物的亲水性得到了明显改善;MTT实验表明,PSI-Phe-EA在所检测浓度范围内(<100 mg/L),对NIH3T3和HepG2两种细胞的24 h细胞存活率均在80%以上;倒置显微镜观察表明,50 mg/L的PSI-Phe-EA孵育24 h后以上两种细胞的形态与对照组无明显差异;细胞周期分析表明PSI-Phe-EA处理与否对细胞周期分布的影响无明显差异。结论 合成的聚天冬酰胺衍生物PSI-Phe-EA亲水性明显提高,且对细胞的存活、微观形态以及周期分布均无明显影响,是一种安全的高分子材料。
天冬酰胺;苯丙氨酸;乙醇胺;药物载体;细胞周期;聚天冬酰胺衍生物;细胞毒性
使用天然氨基酸合成的聚肽如聚赖氨酸[poly (L-lysine),PLL]、聚天冬氨酸[poly(α,β-L-aspartic acid),Pasp]等具有较好的生物相容性、生物可降解性、非抗原性及可修饰性[1-2],作为药物载体材料在药物传递领域被广泛研究。其中,聚天冬氨酸衍生物通过对前体聚合物聚琥珀酰亚胺(polysuccinimide,PSI)直接进行开环修饰得到,而PSI通过L-天冬氨酸热缩聚合成,其合成简便,可修饰性强。采用不同的“开环”试剂,可以很方便地对PSI进行衍生化,得到具有一种或多种衍生官能团的聚合物,从而赋予Pasp衍生物更加广阔的应用前景。L-苯丙氨酸(LPhenylalanine,Phe)是一种必需氨基酸,其在医药、食品领域被广泛使用。Phe结构上具有苯环、羧基、氨基等官能团,其等电点为5.38。Tang等[3]使用L-天冬氨酸和L-苯丙氨酸共聚合成聚肽,用于包载疏水抗肿瘤药物ATPR形成纳米颗粒,能够有效延长药物在体内的作用时间。本研究利用L-苯丙氨酸甲酯上的氨基对PSI进行开环,使PSI在开环后带有苯丙氨酸甲酯侧枝。另外,使用乙醇胺对剩余的琥珀酰亚胺开环,从而利用羟基来调节聚合物的亲疏水性。L-苯丙氨酸的苯环一方面增加与疏水性药物的结合能力,另一方面可与一些带有苯环的药物分子如阿司匹林、布洛芬等形成π-π共轭作用[4],增大聚合物对药物的承载能力。苯丙氨酸甲酯水解后使聚合物带有羧基,在一定的pH环境中,有利于药物载体的解组装,从而加快药物的释放。
1 材料与方法
1.1 试剂 L-天冬氨酸、环丁砜、均三甲苯、L-苯丙氨酸和乙醇胺(Alfa Aesar,美国);氯化亚砜、二甲基甲酰胺和三乙胺(天津试剂六厂);细胞培养板和培养皿(Corning,美国);滤膜、胎牛血清、无水乙醇(北京鼎国昌盛生物技术有限公司);RPMI 1640细胞培养基、胰蛋白酶、3-(4,5)-双甲基-2-噻唑-(2,5)-二苯基溴化四氮唑蓝(MTT)、二甲基亚砜(DMSO,Gibco,美国);碘化丙啶(Propidium Iodide,PI,Sigma,美国)。
1.2 主要仪器 电子分析天平(BT124S,Sartorius,德国);集热式恒温加热磁力搅器(DF-101S,予华仪器);旋转蒸发器(SB-1000,东京理化器械,日本);循环水真空泵(SHZ-DIII,予华仪器);凝胶渗透色谱仪(1525,Waters,美国);电热真空干燥箱(DZG-043,天宇实验仪器厂);冷冻干燥机(北京博医康);磁共振仪(1H NMR,Bruker ARX 400,瑞士);倒置荧光显微镜(DMI 3000B,Leica,德国);全波长多功能酶标仪(Varioskan Flash,THERMO,美国);流式细胞仪(Accuri C6,Accuri Cytometers,美国)。
1.3 PSI-Phe-OMe化学合成及表征 (1)PSI合成方法。L-天冬氨酸13.3 g和磷酸0.7 mL加入研钵中充分研磨均匀,转入圆底烧瓶中,加环丁砜10 mL,均三甲苯34 mL,圆底烧瓶连接分水器和冷凝管,氮气保护下加热至180℃反应5 h。抽滤后用适量二甲基甲酰胺(DMF)溶解固体,再次抽滤除去不溶物后,将澄清滤液滴入乙醇中沉淀,得到白色粉末状固体,真空干燥备用。(2)苯丙氨酸甲酯盐酸盐(Phe-OMe·HCl)合成方法。在0℃下向40 mL无水甲醇中逐滴加入8.8 mL氯化亚砜,滴加完毕后温度上升至室温,继续搅拌0.5 h,然后缓慢加入L-苯丙氨酸,温度上升至80℃,回流反应10 h。反应液冷却后滴入乙醚中得到白色沉淀苯丙氨酸甲酯盐酸盐备用。(3)PSI-Phe-OMe合成方法。取PSI 500 mg溶于5 mL DMF中,加入3.69 g Phe-OMe·HCl,三乙胺2.8 mL,于60℃下反应96 h,将反应液冷却后滴入无水乙醚中沉淀,得到淡黄色固体粉末。(4)聚合物PSI-Phe-EA合成方法。取PSIPhe-OMe 500 mg溶于5 mL DMF中,缓慢加入乙醇胺0.62 mL,室温下搅拌反应24 h。将反应液用5 mL蒸馏水稀释,转入截留分子质量为6~8 ku的透析袋中透析48 h。最终冻干得到淡黄色固体。以上各聚合物均经过磁共振氢谱进行结构表征确证。
1.4 水溶性测试 为了验证PSI-Phe-OMe经乙醇胺开环后的亲水性是否得到改善,将聚合物PSI-Phe-OMe和开环衍生物PSI-Phe-EA分别溶解于超纯水中配制成浓度为1 000、500、250 mg/L的溶液于玻璃瓶中,充分溶解后通过液体的浑浊度比较二者溶解度的差异并照相。
1.5 细胞培养 小鼠胚胎成纤维细胞系NIH3T3和人肝癌细胞HepG2为本实验室自有,用RPMI 1640培养基(含10%胎牛血清,100 U/mL青霉素和100 mg/L链霉素)在37℃,5% CO2的培养箱中培养。
1.6 细胞毒性分析 细胞生长至80%~90%融合度时消化收集细胞,按8×103个/孔铺96孔板,37℃,5%CO2培养箱培养24 h。用无血清的RPMI 1640培养基(含100 U/mL青霉素和100 mg/L链霉素)配制不同浓度梯度的聚合物溶液,吸弃原细胞培养液,加入新鲜的含不同浓度聚合物的RPMI 1640培养液,继续培养24 h。用0.1 mol/L pH 7.4的PBS溶液配制5 g/L的MTT溶液,超声助溶,用0.22 μm滤膜过滤除菌,按照20 μL/孔加入到细胞培养液中继续培养4 h,吸弃培养液,用PBS洗1次,加入150 μL/孔二甲基亚砜,室温避光震荡10 min后用酶标仪测定光密度(OD490),按照以下公式计算细胞存活率。细胞存活率(%)=实验组OD490/对照组OD490×100。通过倒置显微镜观察聚合物处理后的细胞形态。用含聚合物浓度为50 mg/L的RPMI 1640培养基(含100 U/mL青霉素和100 mg/L链霉素)培养NIH3T3细胞和HepG2细胞24 h后于倒置显微镜下观察,照相。
1.7 细胞周期分析 将NIH3T3和HepG2细胞按1.0×105个/孔铺6孔板,37℃,5%CO2培养箱培养24 h。用无血清RPMI 1640培养基配制浓度为50 mg/L的聚合物溶液,吸弃原细胞培养液,加入含聚合物的RPMI 1640培养液,继续培养24 h。离心收集细胞,用冷PBS洗2次,加入4℃预冷的70%乙醇,于4℃固定过夜。离心收集细胞,PBS洗1次,加入500 μL碘化丙啶(PI,50 mg/L,含100 mg/L RNase A和0.2%Triton X-100)染液,4℃避光孵育0.5 h,流式细胞仪上机检测,计数2万个细胞,结果用ModFit软件进行分析。
1.8 统计学方法 使用SPSS 13.0软件进行统计学分析,计量数据用均数±标准差(±s)表示,2组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PSI-Phe-EA的化学合成 具体合成路线见图1。经乌氏黏度法测定PSI的分子质量约为50 ku。由于L-苯丙氨酸溶解性较差,故先将其甲酯化,得到的苯丙氨酸甲酯溶解性较好。苯丙氨酸甲酯开环反应由于空间位阻较大,开环率偏低,采用内标法磁氢谱计算其开环率约为40%,见图2。

Fig.1 Chemical structure of PSI,Phe-OMe·HCl and PSI-Phe-EA图1 聚合物化学结构式

Fig.21H NMR spectrum of PSI(A)and PSI-Phe-EA(B)图2 PSI和PSI-Phe-EA磁共振氢谱
2.2 PSI-Phe-EA的磁共振表征 PSI磁共振氢谱图显示5.29 ppm(ppm:百万分之一化学位移的单位)处为连接环之间的次甲基峰,2.5~3.3 ppm范围内的多重峰为琥珀酰亚胺环上的亚甲基信号,见图2A。PSI-Phe-EA磁共振氢谱图可见7.20 ppm处的苯环信号峰和3.54 ppm处的甲基峰。另外还有4.46~4.62 ppm处乙醇胺两个亚甲基的信号峰。同时原来5.29 ppm处信号峰消失,琥珀酰亚胺环已经完全打开,见图2B。
2.3 水溶性的改善 1 000、500和 250 mg/L时PSI-Phe-EA溶液透明清澈,均表现出良好的溶解度,而PSI-Phe-OMe在250 mg/L时仍不能够全部溶解,为浑浊溶液。由此可见,经乙醇胺开环反应后聚合物的溶解度得到了明显的提高,亲水性得到了改善,见图3。

Fig.3 The solubility of PSI-Phe-OMe(A)and PSI-Phe-EA(B)图3 PSI-Phe-OMe(A)和PSI-Phe-EA(B)的水溶性比较
2.4 细胞毒性分析 对于NIH3T3细胞和HepG2细胞,PSI-Phe-EA在正常使用浓度范围内(<100 mg/L)的细胞存活率均在80%以上,见图4。倒置显微镜观察可见PSI-Phe-EA处理24 h后NIH3T3细胞和HepG2细胞形态和融合度与对照组无明显差别,细胞边界清晰,胞浆丰富,与MTT实验结果一致,见图5。
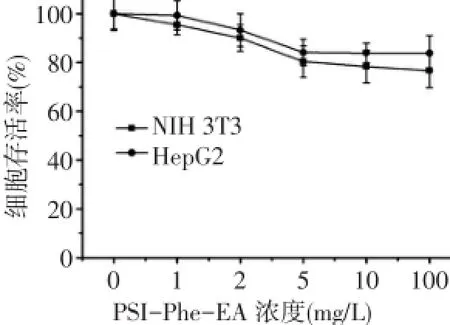
Fig.4 Toxicity of PSI-Phe-EA on NIH 3T3 cells and HepG2 cells after 24 hours incubation(n=6)图4 PSI-Phe-EA孵育24 h对NIH 3T3细胞和HepG2细胞的毒性(n=6)
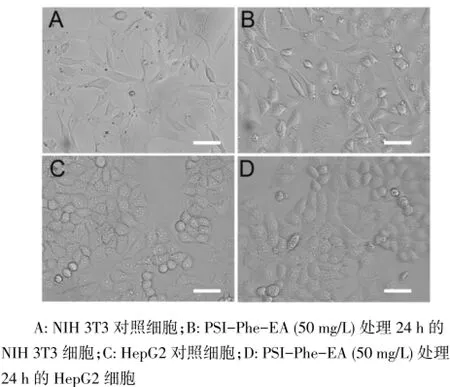
Fig.5 Morphology of NIH 3T3 cells and HepG2 cells treated with PSIPhe-EA for 24 hours图5 NIH 3T3细胞和HepG2细胞的形态观察(标尺为50 μm)
2.5 细胞周期分析 50 mg/L的PSI-Phe-EA处理对NIH3T3和HepG2细胞的周期分布均无显著影响,见表1。
Tab.1 The effect of PSI-Phe-EA on cell cycles of NIH 3T3 and HepG2 cells表1 PSI-Phe-EA对NIH 3T3细胞和HepG2细胞的细胞周期的影响 (n=3,%,±s)

Tab.1 The effect of PSI-Phe-EA on cell cycles of NIH 3T3 and HepG2 cells表1 PSI-Phe-EA对NIH 3T3细胞和HepG2细胞的细胞周期的影响 (n=3,%,±s)
均P>0.05
细胞组别G0/G1SG2/M NIH 3T3Control54.31±0.6543.23±0.972.47±0.97 PSI-Phe-EA52.63±1.1143.27±0.953.80±0.98 t 2.2560.5202.368细胞组别G0/G1SG2/M HepG2Control60.91±0.1937.46±0.372.63±0.32 PSI-Phe-EA59.79±0.8536.25±2.693.95±1.84 t 2.2190.7712.149
3 讨论
近几十年来,随着材料科学的发展,药物辅剂已经发展成为具有能够显著提高药效的药物递送系统,如纳米微粒、纤维和凝胶等。这些纳米粒和凝胶一般都是由聚合物、脂质等有序自组装而形成的。其中,聚氨基酸[poly(L-amino acids),PLAAs]因其具有易设计序列、生物相容性好以及良好的自组装性能为药物递送系统提供了丰富的纳米尺度的材料[5]。聚氨基酸药物载体主要包括氨基酸嵌段共聚物、接枝共聚物以及两亲性多肽分子等几种形式。Lavasanifar等[6]综述了一类聚环氧乙烷-聚L-氨基酸(PEO-b-PLAA)共聚物作为药物载体的应用。Wang等[7]以聚赖氨酸为主链枝接聚环氧乙烷作为疏水侧链用作异硫氰酸荧光素右旋糖酐的载体。Yeh等[8]以PSI为主链骨架枝接聚N-异丙基丙烯酰胺-N,N-二甲基丙烯酰胺合成了PSI-g-poly(NIPAAmco-DMAAm)用作抗炎药物橙皮甙的载体。
聚合物药物载体中的苯环结构可以增加其疏水性,从而有利于载体的自组装,同时通过π-π共轭作用可以增加含苯环等环状结构药物分子的载药量。Zhao等[9]将苯亚甲基缩醛接枝到聚合物药物载体上,增加了其对含苯环抗癌药物姜黄素的载药量。Chen等[10]将2,4,6-三甲氧基苯甲缩醛季戊碳酸酯接枝到聚乙二醇修饰的聚碳酸酯共聚物上,增加了对抗癌药物紫杉醇和阿霉素的载药量。本研究依次通过L-苯丙氨酸甲酯和乙醇胺对PSI进行开环合成了一种聚天冬酰胺衍生物高分子。L-苯丙氨酸甲酯的修饰增强了聚合物与疏水性药物特别是带有芳环的药物的共轭相互作用,使之与药物具有更强的亲和力。乙醇胺的修饰有效地改善了聚合物的亲水性,可以使聚合物在与药物紧密作用的同时,也能与水具有一定的亲和性,从而在机体的体液环境中更加稳定。这些优良的性质将在后续的研究中进一步探究和论证。
药物载体的安全性是确定其能否使用的前提。Wu等[11]在细胞水平上对氧化石墨烯作为抗肿瘤药物阿霉素载体的安全性进行了评价。笔者此前也对多肽自组装形成的纳米纤维的体内外安全性进行了研究,为其应用于药物载体等提供了基础[12]。本研究对聚天冬酰胺衍生物PSI-Phe-EA在细胞水平上的安全性进行了全面的评价,为其进一步用作药物载体提供前期研究基础。实验结果表明,PSI-Phe-EA具有良好的细胞相容性,对细胞周期分布无明显的影响,是一种安全的高分子材料,将在药物载体领域具有广泛的应用前景。
[1]Zhang CY,Yang YQ,Huang TX,et al.Self-assembled pH-responsive MPEG-b-(PLA-co-PAE)block copolymer micelles for anticancer drug delivery[J].Biomaterials,2012,33(26):6273-6283.doi: 10.1016/j.biomaterials.2012.05.025.
[2]Ren TB,Xia WJ,Dong HQ,et al.Sheddable micelles based on disulfide-linked hybrid PEG-polypeptide copolymer for intracellular drug delivery[J].Polymer,2011,52(16):3580-3586.
[3]Tang J,Wang X,Wang T,et al.In vivo pharmacokinetics,biodistribution and antitumor effect of amphiphilicpoly(l-amino acids)micelles loaded with a novel all-trans retinoic acid derivative[J].EurJ PharmSci,2014,51:157-164.doi:10.1016/j.ejps.2013.09.016.
[4]Janiak C.A critical account on π-π stacking in metal complexes with aromatic nitrogen-containing ligands[J].J Chem Soc Dalton Trans,2000:3885-3896.doi:10.1039/B003010O.
[5]Lalatsa A,Schätzlein AG,Mazza M,et al.Amphiphilicpoly(L-amino acids)-new materials for drug delivery[J].J Control Release,2012,161(2):523-536.doi:10.1016/j.jconrel.2012.04.046.
[6]Lavasanifar A,Samuel J,Kwon GS.Poly(ethylene oxide)-block-poly (L-amino acid)micelles for drug delivery[J].Adv Drug Deliv Rev,2002,54(2):169-190.
[7]Wang W,Tetley L,Uchegbu IF.The Level of hydrophobic substitution and the molecular weight of amphiphilic Poly-L-lysine-based polymers strongly affects their assembly into polymeric bilayer vesicles[J].J Colloid Interface Sci,2001,237(2):200-207.
[8]Yeh JC,Hsu YT,Su CM,et al.Preparation and characterization of biocompatible and thermoresponsive micelles based on poly(N-isopropylacrylamide-co-N,N-dimethylacrylamide)grafted on polysuccinimide for drug delivery[J].J Biomater Appl,2014,29(3):442-453.doi:10.1177/0885328214533736.
[9]Zhao J,Wang H,Liu J,et al.Comb-like amphiphilic copolymers bearing acetal-functionalized backbones with the ability of acidtriggered hydrophobic-to-hydrophilic transition as effective nanocarriers for intracellular release of curcumin[J].Biomacromolecules,2013,14(11):3973-3984.doi:10.1021/bm401087n.
[10]Chen W,Meng F,Li F,et al.pH-responsive biodegradable micelles based on acid-labile polycarbonate hydrophobe:synthesis and triggered drug release[J].Biomacromolecules,2009,10(7):1727-1735.doi:10.1021/bm900074d.
[11]Wu S,Zhao X,Cui Z,et al.Cytotoxicity of graphene oxide and graphene oxide loaded with doxorubicin on human multiple myeloma cells[J].Int J Nanomedicine,2014,9(1):1413-1421.doi:10.2147/IJN.S57946.
[12]Yang C,Chu L,Zhang Y,et al.Dynamic biostability,biodistribution,and toxicity of l/d-peptide-based supramolecular Nanofibers[J].ACS Appl Mater Interfaces,2015,7(4):2735-2744.doi:10.1021/ am507800e.
(2014-11-14收稿 2015-01-30修回)
(本文编辑 李国琪)
Synthesis of poly asparagine derivatives and its cytotoxicity study
YANG Cuihong1,HAN Jinghua2,LIU Jinjian1,ZHANG Yumin1,GAO Honglin1,DONG Wenhui2,WANG Yanming2△
1 Tianjin Key laboratory of Radiation Medicine and Molecular Nuclear Medicine,Institute of Radiation Medicine,Chinese Academy of Medical Science and Peking Union Medical College,Tianjin 300192,China;2 State Key Laboratory of Medicinal Chemical Biology,College of Pharmacy,Nankai University
△Corresponding Author E-mail:wangyanming@nankai.edu.cn
Objective To synthesize poly asparagine derivatives and to evaluate its safety at the cellular level,which provide research platform for its potential application as drug carrier.Methods Polysuccinimide was synthesized by thermal polymerization of L-polyaspartic acid,and the target product of PSI-Phe-EA was obtained by the ring-opening reaction of polysuccinimide using L-phenylalanine methyl ester hydrochloride and ethanol amine.The structure of PSI-Phe-EA were characterized by1H NMR.The rate of ring-opening of PSI was calculated by internal standard method of1H NMR.The change of hydrophilicity was studied by the comparison of solubility.The cytotoxicity and morphology modification by PSIPhe-EA at designate concentrations was investigated by MTT method and inverted microscopy respectively.The effects on cell cycles were analyzed by flow cytometry after propidium iodide(PI)staining.Results1H NMR results confirmed the structure of PSI-Phe-EA and the ring-openning rate of PSI was 40%.The hydrophilicity of PSI-Phe-EA was greatly increased upon ring opening using ethanol amine.MTT test showed that the cell survival rates of NIH 3T3 and HepG2 cells were higher than 80%under the examined concentration(<100 mg/L).Inverted microscopy showed that 50 mg/L of PSI-Phe-EA treatment had no adverse effects on cell morphology.Cell cycle analysis indicated that PSI-Phe-EA treatment had no influence on cell cycles of NIH 3T3 and HepG2 cell lines.Conclusion PSI-Phe-EA showed high hydrophilicity without significant effects on the cells survival,cells morphology and cell cycles.It is a kind of safe polymer material.
asparagine;phenylalanine;ethanolamine;drug carriers;cell cycle;polyasparagine derivative;cytotoxicity
R916
A DOI:10.11958/j.issn.0253-9896.2015.06.002
国家自然科学基金资助项目(51303213,51473080);天津市应用基础与前沿技术研究计划重点项目(14JCZDJC33300);“协和青年基金资助”和“中央高校基本科研业务费专项资金资助”(33320140034,3332014003);放射医学研究所学科发展基金资助项目(SF1417,SF1416)
1北京协和医学院&中国医学科学院放射医学研究所,天津市放射医学与分子核医学重点实验室(邮编300192);2药物化学生物学国家重点实验室,南开大学药学院
杨翠红(1983),女,助理研究员,研究生,主要从事自组装纳米材料、分子核医学研究
△E-mail:wangyanming@nankai.edu.cn
