siRNA干扰Gab1表达对胆管癌细胞株HUCCA-1功能的影响及其与PI3K/Akt信号通路的关系
2015-08-24姚旭田忠刘源
姚旭,田忠,刘源
siRNA干扰Gab1表达对胆管癌细胞株HUCCA-1功能的影响及其与PI3K/Akt信号通路的关系
姚旭,田忠△,刘源
目的 检测下调Gab1表达后人胆管癌细胞株HUCCA-1细胞功能、PI3KCA及Akt1的蛋白及mRNA表达水平改变,探讨Gab1、PI3KCA及Akt1表达在胆管癌恶性行为中的作用机制。方法 Gab1siRNA转染HUCCA-1细胞,采用qRT-PCR法及Western blot法检测转染效率及PI3KCA、Akt1表达水平,MTT检测转染后细胞增殖变化,流式细胞术检测转染后细胞凋亡变化,Transwell检测细胞迁移及侵袭能力。结果 Gab1siRNA在HUCCA-1细胞中的转染效率约为65%~70%,转染效率佳;Gab1siRNA转染HUCCA-1细胞后,PI3KCA、Akt1的蛋白及mRNA表达量下调;Gab1siRNA组HUCCA-1细胞增殖能力在48 h、72 h及96 h均低于siRNA control组和Mock组(P<0.05);Gab1siRNA组的HUCCA-1细胞凋亡率高于Mock及siRNA control组(P<0.05);Gab1siRNA组HUCCA-1细胞迁移减少百分比及侵袭能力低于siRNA control组及Mock组(P<0.05)。结论 Gab1可能通过激活PI3K/Akt信号通路表达促进肿瘤细胞恶性行为,Gab1可作为胆管癌治疗新的靶向标志物及候选基因。
胆管癌;增殖;凋亡;Gab1;HUCCA-1;PI3K/Akt信号通路
胆管癌发病率呈逐年上升趋势,恶性度高[1],且对化疗及放疗均不敏感,手术切除的5年生存率较低[2]。Gab1是接头蛋白的一种,与胃癌、结肠癌、乳腺癌、卵巢癌等恶性肿瘤具有相关性,其高表达提示肿瘤预后不良[3]。PI3K/Akt信号通路在肝癌、卵巢癌、乳腺癌、肺癌、肾癌等恶性肿瘤的发生发展中起重要作用,PI3KCA及Akt1是PI3K/Akt信号通路中的重要蛋白,且Gab1参与PI3K/Akt通路的激活及恶性行为[4]。Gab1及PI3K/Akt在胆管癌中的表达情况及该通路在胆管癌中所起到的作用及机制,目前国内外尚少见相关研究。本研究采用小干扰RNA(siRNA)对人胆管癌细胞株HUCCA-1中Gab1表达进行干扰下调,旨在观察Gab1基因表达对胆管癌细胞功能的影响及其在PI3K/Akt信号通路中的作用,探讨其在胆管癌恶性行为中的作用机制,为胆管癌的靶向治疗提供新的靶基因。
1 材料与方法
1.1 材料 人胆管癌细胞株HUCCA-1购自中科院上海细胞库,于中国医科大学盛京医院中心实验室保存并传代。兔抗人Gab1多克隆抗体、兔抗人PI3KCA单克隆抗体、Akt1多克隆抗体(美国Sigma公司);MTT试剂盒、DMSO(上海生工);miRNA提取分离试剂盒、LipofectamineTM2000及TRIzol(美国Invitrogen公司);All-in-One™qPCR Mix试剂盒(美国GeneCopoeia公司);Annexin V-FITC/PI凋亡试剂盒(嘉美生物技术有限公司)。
1.2 研究方法
1.2.1 细胞培养 采用贴壁细胞培养法培养HUCCA-1,37℃水浴迅速解冻,DMEM培养基洗涤细胞制成单细胞悬液,于37℃、5%CO2培养箱中培养,取融合达95%以上的细胞进行传代,取对数生长期细胞进行实验。
1.2.2 引物的设计及合成 引物Gab1 siRNA序列:正义5′-GAGTCCACUGCGTACUGCCTA-3′,反义 5′-CGCTCUTGGCAGUACGGCGAT-3′;siRNA control序列:正义5′-UCGATCGUAGCUCACTCCCGA-3′,反义5′-ACTGGGACGUCTCGUGCACTG-3′;PI3KCA序列:正义5′-CAUTCGUATCTCU-GTCTGA-3′,反义5′-CGGUCAGTCACGAUCTCA-3′;Akt1引物序列:正义5′-CATUCGGCTCUCTGCGTGA-3′,反义5′-CGCGUCATGCTGCGCUGA-3′。各序列均由上海吉玛制药技术有限公司设计并合成。
1.2.3 siRNA转染HUCCA-1细胞 将细胞以2×105个/孔的密度接种于6孔板培养,取24 h内细胞融合达70%~90%的细胞株进行转染,参照LipofectamineTM2000试剂说明书进行操作。细胞分为Mock组、Gab1 siRNA组及siRNA control组。对Gab1 siRNA组及siRNA control组进行转染,转染48 h后按照miRNA提取及分离试剂盒说明书检测总RNA完整性,采用紫外线分光光度仪检测RNA溶解吸光度(A)值,计算RNA的浓度及纯度,A260/A280为1.8~2.1可进行进一步实验,采用Western blot法及qRT-PCR对转染效率进行检测。
1.2.4 qRT-PCR测定转染效率及转染后 PI3KCA、Akt1 mRNA表达水平 按TRIzol法分离纯化细胞株总RNA,RNA样本的浓度均稀释为0.8 g/L,按照逆转录-扩增试剂盒的说明书进行逆转录及扩增。反应体系(2×All-in-One qPCR Mix 12.5 μL+50×Syber Green 2 μL+cDNA 2 μL+上下游引物各1 μL+ddH2O 5 μL);反应条件为94℃预变性10 min,94℃变性10 s、60℃退火20 s、72℃延伸10 s,40个循环。所有反应均设复孔,以DEPC水代替模板,cDNA为阴性对照,GAPDH为内参照,反应结束后行熔解曲线分析。
1.2.5 Western blot法检测转染效率及转染后PI3KCA、Akt1蛋白表达水平 细胞裂解液提取HUCCA-1细胞总蛋白,BCA法测定蛋白浓度,每条泳道上样20 μg蛋白,采用SDS-PAGE电泳,转PVDF膜。TBST洗膜后加入抗体,室温孵育1 h,TBST清洗后进行ECL发光,凝胶显像仪显像,Quantity One软件进行灰度值分析。
1.2.6 MTT法检测转染后HUCCA-1细胞增殖情况 取各组细胞,按MTT试剂盒操作,以5×103个细胞/孔接种于96孔细胞培养板,设3个复孔,培养24、48、72、96 h后,每孔加MTT(5 g/L)20 μL,继续孵育4 h,弃上清液,加DMSO 150 μL,振荡10 min溶解结晶,于酶联免疫检测仪上以570 nm波长测定各孔的光密度值,实验重复3次。
1.2.7 流式细胞仪检测转染后 HUCCA-1细胞凋亡情况 按照Annexin V-FITC/PI凋亡试剂盒说明书进行操作,将转染细胞上流式细胞仪进行检测,采用CellQuest进行分析。记录早期凋亡及晚期凋亡阳性细胞百分比,实验重复3次。
1.2.8 转染后HUCCA-1细胞迁移及侵袭能力检测 按Transwell试剂盒说明书进行操作,检测转染后HUCCA-1细胞的迁移能力转染前后变化。每孔任意选取3个200倍视野拍照,计数侵袭细胞数量百分比并取其均值。细胞迁移即在小室中不加入基质胶,余步骤同侵袭操作,每个实验重复3次。
1.3 统计学方法 采用GraphPad Prism 6.0进行统计分析及作图,计量资料采用±s表示,多组间比较采用单因素方差分析,组间多重比较采用Tukey′s检验,率的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 转染效率检测
2.1.1 总RNA纯度及完整性测定 总RNA样品A260/A280为1.8~2.0,纯度较高。5 sRNA、18 sRNA及28 sRNA条带均完整,总RNA抽取完整。
2.1.2 转染效率 Western blot显示,在50 ku处有灰色条带,为Gab1蛋白。Gab1siRNA组的Gab1蛋白表达量低于 siRNA control组和Mock组(P<0.05),见图1;qRT-PCR结果显示,Gab1siRNA组的Gab1mRNA表达量低于siRNA control组和Mock组(P<0.05),见表 1。干扰效果明显,效率约为65%~70%。
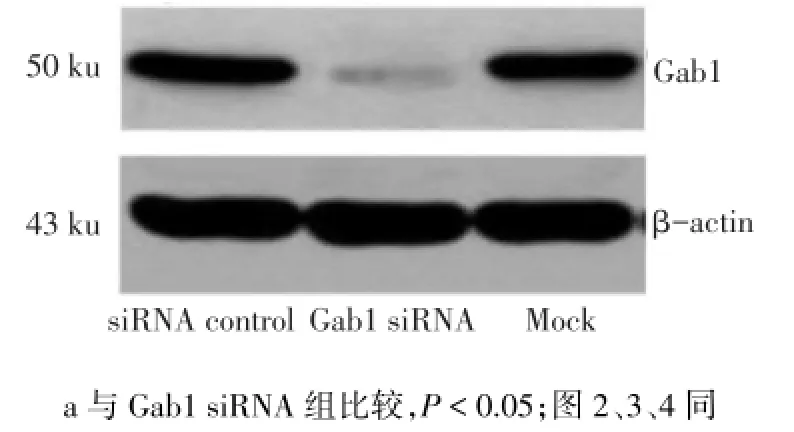
Fig.1 Comparison of Gab1 protein(A)and mRNA(B)expressions in three groups图1 3组Gab1的蛋白(A)及mRNA(B)表达水平比较
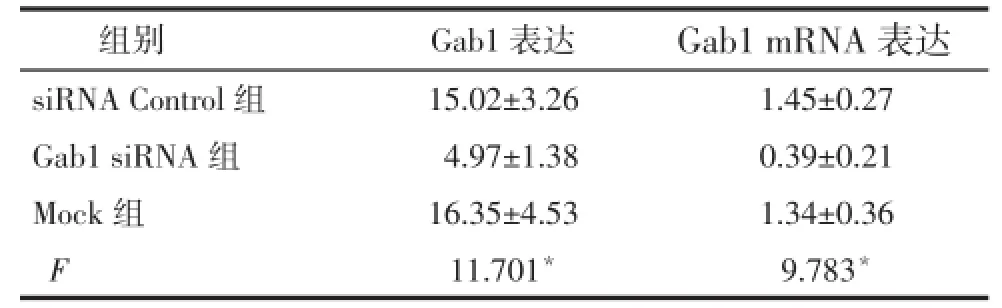
Tab.1 Comparison of Gab1 protein(A)and mRNA(B)expressions in three groups表1 3组Gab1的蛋白(A)及mRNA(B)表达水平比较
2.2 Gab1siRNA转染后PI3KCA及Akt1在蛋白水平及mRNA水平表达
2.2.1 Western blot结果 在110 ku及56 ku处有灰色条带显示为PI3KCA及Akt1表达。Gab1siRNA组的PI3KCA蛋白及Akt1蛋白表达量低于siRNA control组及Mock组(P<0.05),见图2A。
2.2.2 qRT-PCR结果 Gab1siRNA组的PI3KCA mRNA及Akt1mRNA表达量低于siRNA control组及Mock组(P<0.05),见图2B。
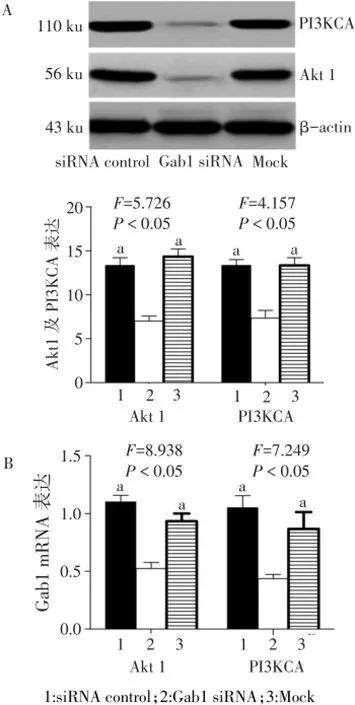
Fig.2 PI3KCA and Akt1 expressions at protein(A)and mRNA(B)levels after Gab1 siRNA transfection图2 Gab1siRNA转染后PI3KCA及Akt1在蛋白水平(A)及mRNA水平(B)
2.3 MTT检测Gab1siRNA干扰后HUCCA-1细胞增殖结果 Gab1siRNA组HUCCA-1细胞增殖能力在 48 h、72 h及 96 h均低于 siRNA control组和Mock组(P<0.05),见表2。
2.4 Gab1siRNA干扰后HUCCA-1细胞株凋亡的改变 siRNA control组、Gab1siRNA组及Mock组的凋亡率分别为(0.85±0.71)%、(8.65±2.34)%及(2.17±0.94)% (F=7.897,P<0.05)。Gab1siRNA组的HUCCA-1细胞凋亡率高于其余2组(P<0.05),见图3。
2.5 Gab1 siRNA转染后HUCCA-1细胞侵袭及迁移能力 Gab1siRNA组HUCCA-1细胞侵袭细胞百分比低于 siRNA control组及 Mock组(P<0.05);Gab1siRNA组HUCCA-1细胞的迁移细胞百分比低于siRNA control组及Mock组(P<0.05),见图4,表3。
Tab.2 Proliferation of HUCCA-1 cells detected by MTT after Gab1 siRNA transfection表2 MTT检测转染后HUCCA-1细胞的增殖(n=3,±s)

Tab.2 Proliferation of HUCCA-1 cells detected by MTT after Gab1 siRNA transfection表2 MTT检测转染后HUCCA-1细胞的增殖(n=3,±s)
*P<0.05;a与Gab1 siRNA组比较,P<0.05
?

Fig.3 Apoptosis of HUCCA-1 cells detected by flow cytometry图3 流式细胞仪检测转染后HUCCA-1细胞凋亡
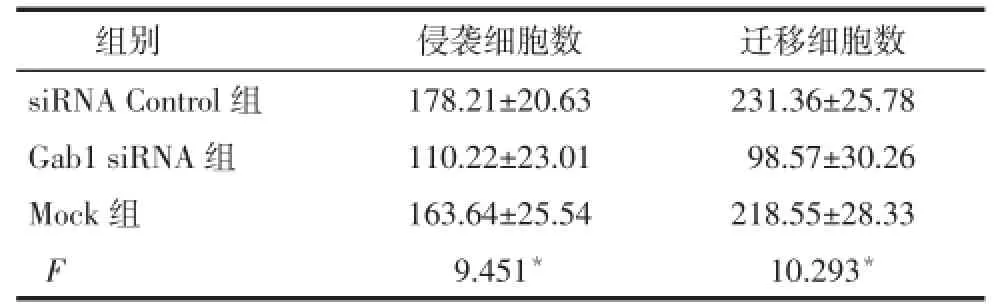
Tab.3 Invasion and immigration of HUCCA-1 cells after Gab1siRNA transfection表3 Gab1siRNA干扰后HUCCA-1细胞侵袭及迁移能力变化
3 讨论
胆管癌恶性度高,发现时大部分均以黄疸为首发症状,预后较差,5年手术后生存率低于25%,早发现早诊断较为困难,因此,对于肿瘤标志物及预后因素的探索一直是研究的焦点。Gab1作为接头蛋白的一种,可以被多种细胞因子激活[5],尤其在PI3K/Akt信号通路中,Gab1可能作为启动因子或促进因子发挥作用[6]。Gab1的3个酪氨酸磷酸化位点可结合p85亚基,顺序激活PI3KCA及Akt1,从而活化PI3K/Akt信号通路,启动及促进恶性肿瘤细胞的增殖、浸润及转移,并抑制抑癌基因活性[7-8]。Gab1与磷脂分子PIP3亲和力较强,二者结合后可能进一步增强PI3K活性,使该信号通路进一步放大,增强肿瘤细胞恶性行为[9-10]。
本研究采用siRNA技术对HUCCA-1细胞中Gab1表达进行下调,经Western blot及qRT-PCR检测,转染效率满意。转染后PI3KCA及Akt1表达在蛋白及mRNA水平均明显下调,提示Gab1可能是PI3K/Akt通路中重要的启动及激活因子,可能通过激活PI3K/Akt通路,促进胆管癌的恶性行为[11-12]。有研究认为,Akt磷酸化是子宫内膜癌及乳腺癌从不典型增生到恶性转化,并进一步发展具有浸润能力的主导因素,胆管腺癌细胞的恶变过程在mRNA水平即已发生,Gab1可以同含有YXXP序列下级信号分子SH2同源区相结合,包括SHIP、Crk等,这种结合与PI3K/Akt信号通路存在交联反应,同时存在多种信号通路及致癌因素调控肿瘤细胞的恶变、分化、生长、转移、浸润及凋亡功能[13-14]。Gab被siRNA干扰后,HUCCA-1细胞的增殖能力明显减弱,凋亡率也增加,PI3K/Akt信号通路可对小分子质量的G蛋白及RAS蛋白功能进行调控,G蛋白及RAS蛋白对肿瘤生长、增殖转移、浸润、物质转运都发挥着重要的调控作用[15]。siRNA干扰后,HUCCA-1细胞转移及浸润能力均减弱,在PI3K/Akt高表达的多种肿瘤中,相关抑癌基因表达均为下调,甚至缺失或缺如,Gab经siRNA下调后,PI3K/Akt信号通路功能减弱或失活,导致胆管癌细胞的转移及浸润能力减弱。因此,胆管癌发生发展的过程是多基因共同作用的结果。PI3K/Akt信号通路可通过调节其下游效应基因促进细胞骨架蛋白生成,细胞伪足样运动增强,肿瘤细胞转移能力活跃。PI3K/Akt还可调节肿瘤细胞对细胞外基质的降解能力,增强细胞对钙黏连素的降解,从而强化恶性肿瘤细胞的浸润及转移[16]。
综上,Gab1可能通过PI3K/Art信号通路对胆管腺癌细胞增殖、凋亡、浸润及转移等恶性行为进行调控,Gab1、PI3KCA及Akt1可能作为胆管腺癌恶性行为及预后的预测因素及未来治疗的靶向基因。
(图4见插页)
[1]Yin LL,Song B,Guan Y,et al.Clinical value of MRI united-sequences examination in diagnosis and differentiation of morphological subtype of hilar and extrahepatic big bile duct cholangiocarcinoma[J].Journal of SICHUAN University(Medical Science Edition),2014,45 (5):854-858.[印隆林,宋彬,管英,等.MRI联合序列检查在肝门及肝外大胆管癌诊断和亚型鉴别中的价值探讨[J].四川大学学报:医学版,2014,45(5);854-858].
[2]Sun Q,Zhao C,Xia L,et al.High expression of matrix metalloproteinase-9 indicates poor prognosis in human hilar cholangiocarcinoma[J].Int J Clin Exp Pathol,2014,7(9):6157-6164.
[3]Jung da H,Kim MS,Cho ck,et al.Outcomes of stereotactic body radiotherapy for unresectable primary or recurrent cholangiocarcinoma [J].Radiat OncolJ,2014,32(3):163- 169.doi:10.3857/ roj.2014.32.3.163.
[4]Song S,Moon HH,Lee S,et al.Comparison between resection and transplantation in combined hepatocellular and cholangiocarcinoma [J].Transplant Proc,2013,45(8):3041-3046.doi:10.1016/j.transproceed.2013.08.064.
[5]Park YH,Hwang S,Ahn CS,et al.Long-term outcome of liver transplantation for combined hepatocellular carcinoma and cholangiocarcinoma[J].Transplant Proc,2013,45(8):3038-3040.
[6]Li C,Shen W,Shen S.Gene expression patterns combined with bioinformatics analysis identify genes associated with cholangiocarcinoma[J].Comput Biol Chem,2013,47(6):192-197.
[7]Fang Y,Yi J,Lizhi L,et al.Rho GDP dissociation inhibitor beta promotes cell proliferation and invasion by modulating the AKT pathway in hepatocellular carcinoma[J].DNA Cell Biol,2014,33(11): 781-786.doi:10.1089/dna.2014.2545.
[8]Oliveira CS,de Bock CE,Molloy TJ,et al.Macrophage migration inhibitory factor engages PI3/KAkt signalling and is a prognostic factor in metastatic melanoma[J].BMC Cancer,2014,14(3):630-635.doi:10.1186/1471-2407-14-630.
[9]Kwon SJ,Lee JH,Moon KD,et al.Isoegomaketone induces apoptosis in SK-MEL-2 human melanoma cells through mitochondrial apoptotic pathway via activating the PI3K/Akt pathway[J].Int J Oncol,2014,45(5):1969-1976.doi:10.3892/ijo.2014.2598.
[10]Li H,Zhang B,Liu Y.EBP50 inhibits the migration and invasion of human breast cancer cells via LIMKcofilin and the PI3K/Akt mTORMMP signaling pathway[J].Med Oncol,2014,31(9):162-167.doi:10.1007/s12032-014-0162-x.
[11]Park BH,Jung KH,Yun SM,et al.KRC-327,a selective novel inhibitor of c-Met receptor tyrosine kinase with anticancer activity[J].Cancer Lett,2013,331(2):158-166.doi:10.1016/j.canlet.
[12]Miura K,Wakayama Y,Tanino M,et al.Involvement of EphA2-mediated tyrosine phosphorylation of Shp2 in Shp2-regulated activation of extracellular signal-regulated kinase[J].Oncogene,2013,32 (45):5292-5301.doi:10.1038/onc.2012.571.
[13]Hoeben A,Martin D,Clement PM,et al.Role of GRB2-associated binder 1 in epidermal growth factor receptor-induced signaling in head and neck squamous cell carcinoma[J].Int J Cancer,2013,132 (5):1042-1050.doi:10.1002/ijc.27763.
[14]Whale AD,Dart A,Holt M,et al.PAK4 kinase activity and somatic mutation promote carcinoma cell motility and influence inhibitor sensitivity[J].Oncogene,2013,32(16):2114-2120.doi:10.1038/ onc.2012.233.
[15]Won JK,Yang HW,Shin SY,et al.The crossregulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor[J].J Mol Cell Biol,2012,4(3):153-163.doi: 10.1093/jmcb/mjs021.
[16]McDonald CB,Seldeen KL,Deegan BJ,et al.Binding of the cSH3 domain of Grb2 adaptor to two distinct RXXK motifs within Gab1 docker employs differential mechanisms[J].J Mol Recognit,2011,24 (4):585-596.
(2014-12-01收稿 2015-01-25修回)
(本文编辑 闫娟)
Effect of silencing Gab1 expression on cholangiocarcinoma cell line HUCCA-1 and its correlation with PI3K/Akt pathway
YAO Xu,TIAN Zhong△,LIU Yuan
Department of the 10thGeneral Surgery,Shengjing Hospital of China medical university,Liaoning Shenyang 110042,China
△Corresponding Author E-mail:tianz@sj-hospital.org
Objective To explore the functionalternation of human cholangiocarcinoma cell line HUCCA-1 by silencing Gab1 expression;to detect its effect on PI3KCA and Akt1 expression at protein and mRNA levels and to explore the role of Gab1,PI3KCA and Akt1 expressions in the malignant behavior of cholangiocarcinoma.Methods Gab1 siRNA was trans-fected into cholangiocarcinoma cell line HUCCA-1.Proliferation,apoptosis,migration/invasion of cells were examined by MTT,flow cytometry and Transwell assay respectively after transfection.PI3KCA and Akt1 expressions were detected by Western blotting and qPCR.Results Transfection efficiency was satisfactory and reaches 65%~70%;PI3KCA and Akt1 expressions were down-regulated at both protein and mRNA levels upon silencing of Gab1.Meanwhile,proliferations of HUCCA-1 cells were inhibited(P<0.01);apoptosis rate increases(P<0.05);and migration and invasion were both inhibited upon Gab1 silencing(P<0.05).Conclusion The proliferation,migration and invasion are all inhibited while apoptosis is attenuated after Gab1 was down-regulated by Gab1 siRNA transfection.PI3KCA and Akt1 expressions are up-regulated with down-regulation of Gab1.Therefore,Gab1 may enhance the maglinant behavior of cholangiocarcinoma cells through upregulating PI3KCA and Akt1 expression and it can be used as a candidate for cholangiocarcinoma therapy.
cholangiocarcinoma;proliferation;apoptosis;Gab1;HUCCA-1;PI3K/Akt pathway
R735.8
A DOI:10.11958/j.issn.0253-9896.2015.06.004
辽宁省科技攻关计划项目(2013408001)
沈阳,中国医科大学附属盛京医院第十普外科(邮编110042)
姚旭(1977),男,主治医师,硕士,主要从事胆道恶性肿瘤的基础及临床研究
△E-mail:tianz@sj-hospital.org
