蜕皮甾酮对脂多糖诱导兔软骨细胞损伤的保护作用
2015-08-24王刚涛张旭辉张卫东夏磊
王刚涛,张旭辉,张卫东,夏磊
蜕皮甾酮对脂多糖诱导兔软骨细胞损伤的保护作用
王刚涛,张旭辉△,张卫东,夏磊
目的 探讨蜕皮甾酮(EDS)对脂多糖(LPS)诱导的兔软骨细胞损伤的保护作用及其机制。方法 体外分离、培养兔关节软骨细胞,随机分为对照组、LPS诱导损伤组(LPS组),蜕皮甾酮干预组(LPS+EDS组)。MTT法和流式细胞术分别检测各组细胞增殖率及细胞凋亡率;RT-PCR和Western blot检测软骨细胞中诱导型一氧化氮合酶(iNOS)表达;硝酸还原酶法和ELISA法分别检测各组NO及白细胞介素(IL)-1β含量。结果 与对照组相比,LPS组细胞增殖率降低,凋亡率升高,iNOS mRNA和蛋白表达量以及NO和IL-1β含量增高(均P<0.05)。LPS+EDS组较LPS组细胞增殖率升高,凋亡率降低,iNOS mRNA和蛋白表达量及NO和IL-1β的含量降低(均P<0.05)。结论蜕皮甾酮对LPS诱导的兔软骨细胞损伤具有保护作用,其保护作用可能与抑制iNOS表达有关。
蜕皮甾酮;软骨细胞;脂多糖类;细胞增殖;细胞凋亡;白细胞介素1β;诱导型一氧化氮合酶
软骨损伤是导致骨关节炎发生的重要因素[1]。目前骨关节炎治疗多用西药,疗效不明显且不良反应较多,近年来中药治疗骨关节炎因其不良反应少而成为研究热点。蜕皮甾酮(ecdysterone,EDS)是一类植物甾酮,是牛膝等骨关节中药类药物的重要活性成分。研究表明蜕皮甾酮影响骨关节疾病的发生发展[2]。本研究以蜕皮甾酮为研究对象,通过构建软骨细胞损伤模型,研究蜕皮甾酮对脂多糖(LPS)诱导软骨细胞损伤的保护作用,并探讨其作用机制,为骨关节炎的合理用药提供实验依据。
1 材料与方法
1.1 材料 新西兰兔6只,4周龄,体质量2.5~3.0 kg,购自浙江大学医学实验动物中心。EDS和LPS购自Sigma公司;胎牛血清(FBS)、DMEM培养基、青霉素、链霉素、Ⅱ型胶原酶购于Gibco公司。AV/PI双染凋亡检测试剂盒购于BD公司;NO检测试剂盒购于南京建成生物工程研究所;兔白细胞介素(IL)-1β ELISA检测试剂盒购于R&D Systems公司;羊抗兔诱导型一氧化氮合酶(iNOS)和β-actin一抗、辣根过氧化物酶(HRP)标记的鼠抗羊二抗购自Pierce公司。
1.2 方法
1.2.1 兔关节软骨细胞的分离与培养 采用耳缘静脉空气注射法迅速处死新西兰兔,无菌条件下截取双侧膝关节面软骨。将软骨置于含100 g/L青霉素、100 g/L链霉素的PBS中洗涤3次,眼科剪剪碎至0.5~1.0 mm3的组织块。将剪碎的软骨组织置于培养瓶中,加入5 mL 0.25%的胰蛋白酶,5% CO2、37℃消化1 h。移液管吸出胰蛋白酶,加入5 mL 0.2%Ⅱ型胶原酶,振荡继续消化16 h,每6~8 h收集1次细胞。用200目滤网收集消化完全的软骨细胞,1 500 r/min离心5 min,弃上清,PBS清洗后800 r/min离心10 min再次去除上清。加入含20%FBS的DMEM培养基,0.25%台盼蓝染色,活细胞率大于90%,则进行传代培养。原代软骨细胞以1× 105个/mL接种于含10%FBS的DMEM培养基中,5%CO2、37℃常规培养。
1.2.2 实验分组 实验选取第3代兔软骨细胞,以低血清(0.5%)DMEM培养,待细胞生长至80%融合后,加药干预。细胞分为3组:对照组、LPS组(10 mg/L LPS)、LPS+EDS组(10 mg/L LPS+100 μmol/L EDS)。LPS和EDS均以不含FBS的DMEM稀释至所需浓度。分组处理48 h、72 h后进行后续指标检测。
1.2.3 MTT法检测细胞增殖率 各组细胞以6×104个/孔接种于96孔板,每组设3个复孔。加药处理后继续培养48、72 h,弃去培养液,每孔加入MTT(5 g/L)20 μL,于37℃培养4 h。弃上清,每孔加入150 μL二甲基亚砜(DMSO),振荡10 min使结晶充分溶解,以490 nm波长于酶标仪上检测各组细胞吸光度值(A490),计算细胞增殖率,细胞增殖率=处理组A490/对照组A490×100%。
1.2.4 细胞凋亡检测 细胞分组培养48 h后以预冷的PBS洗涤2次,加入胰酶消化重悬后,立即加入AnnexinⅤ-FITC (5 mg/L)10 μL和PI 5 μL,振荡混匀后37℃避光孵育30 min。加入300µL结合缓冲液混合后流式细胞仪检测各细胞凋亡率,每组实验重复3次。
1.2.5 RT-PCR检测iNOS mRNA表达 培养48 h后收集细胞,Trizol法提取总RNA,紫外分光光度计测定RNA的纯度及浓度,逆转录成cDNA后PCR扩增iNOS。扩增条件:95℃2 min;95℃1 min,64℃1 min,72℃1 min,35个循环;72℃10 min。引物序列:iNOS上游5′-CCT TGTTCAGCTACGCCT TC-3′,下游5′-CATGGTGAACACGTTCTTGG-3′;内参β-actin上游5′-CTCCATCCTGGCCTCGCTGT-3′,下游5′-GCTGTCACCTTCACCGTTCC-3′。取5 μL扩增产物行琼脂糖凝胶电泳,自动凝胶成像分析仪分析。实验结果以目的基因灰度值/内参灰度值表示。
1.2.6 Western blot检测iNOS蛋白表达 培养48 h后收集细胞,提取细胞总蛋白,BCA法测定蛋白浓度。以β-actin为内参,取120 μg的总蛋白行SDS-PAGE,电泳后转膜,先后结合羊抗兔iNOS一抗(1∶1 000)和HRP标记的鼠抗羊二抗(1∶100),最后X线片曝光分析,结果采用Image-Pro Plus分析,以iNOS与内参β-actin的灰度值比值作为iNOS的相对表达量,重复3次后进行统计分析。
1.2.7 NO和IL-1β检测 收集待测兔软骨细胞培养上清,NO含量采用硝酸还原酶法,操作步骤严格按照试剂盒说明书,用半自动生化仪测定。IL-1β含量采用ELISA法,按试剂盒操作说明,酶标仪测定A490值。
1.2.8 统计学方法 采用SPSS 13.0进行统计分析,计量资料以±s表示,多组间均数比较采用单因素方差分析,组间多重比较采用Tukey检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞增殖率比较 与对照组相比,LPS组细胞48 h与72 h后细胞增殖率明显下降(均P<0.05)。与LPS组相比,LPS+EDS组细胞增殖率明显升高(P<0.05),LPS+EDS组与对照组细胞增殖率差异无统计学意义,见表1。
Tab.1 Comparison of the cell proliferation among three groups表1 各组细胞增殖率比较 (n=3,±s)

Tab.1 Comparison of the cell proliferation among three groups表1 各组细胞增殖率比较 (n=3,±s)
**P<0.01;a与对照组相比,b与LPS组相比,P<0.05;图1、表2、3同
组别48 h72 h对照组0.64±0.030.72±0.03 LPS组0.21±0.05a0.22±0.03aLPS+EDS组0.61±0.02b0.65±0.04bF 250.021**314.257**
2.2 细胞凋亡率 LPS组细胞凋亡率较对照组明显升高(P<0.05)。与LPS组相比,LPS+EDS组细胞凋亡率降低(P<0.05),见图1。
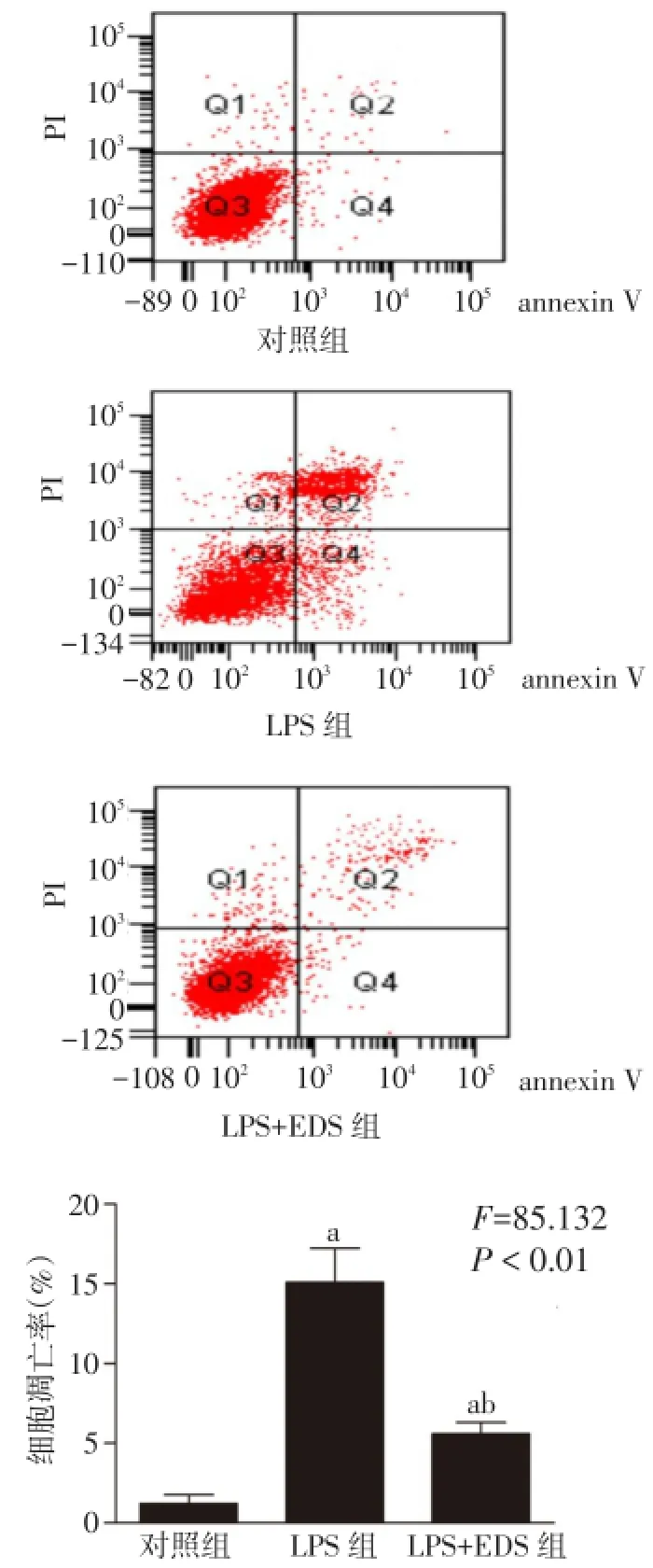
Fig.1 Comparison of chondrocyte apoptosis among three groups图1 各组细胞凋亡率比较
2.3 iNOS mRNA和蛋白表达 与对照组相比,LPS 组iNOS mRNA及蛋白表达增高(P<0.05)。经EDS干预后iNOS mRNA和蛋白表达水平较LPS组降低(P<0.05),见图2,表2。

Fig.2 Expression of iNOS in all three groups图2 各组细胞iNOS蛋白表达
Tab.2 Comparison of mRNA transcription and protein expression levels of iNOS among three groups表2 各组细胞iNOS mRNA及蛋白表达水平比较(n=3,±s)

Tab.2 Comparison of mRNA transcription and protein expression levels of iNOS among three groups表2 各组细胞iNOS mRNA及蛋白表达水平比较(n=3,±s)
?
2.4 NO及IL-1β含量比较 与对照组相比,LPS组NO和IL-1β表达升高(P<0.05)。LPS+EDS组与LPS组相比NO和IL-1β水平降低(P<0.05),见表3。
Tab.3 Comparison of NO and IL-1β content in chondrocyte among three groups表3 各组NO和IL-1β含量比较(n=3,±s)

Tab.3 Comparison of NO and IL-1β content in chondrocyte among three groups表3 各组NO和IL-1β含量比较(n=3,±s)
组别NO(μmol/L)IL-1β(μg/L)对照组12.76±1.2460.58±5.86 LPS组21.87±3.06a143.69±8.67aLPS+EDS组15.23±2.56ab80.65±6.69abF 14.027**135.426**
3 讨论
骨关节炎是由多种炎症因子和细胞因子参与的慢性疾病,其病理过程以关节软骨的退行性改变为主[3]。软骨细胞在关节软骨细胞外基质的合成和降解中具有重要作用[4]。蜕皮甾酮是一类植物雌激素,能够与哺乳动物或人的雌激素受体(ER)相结合,起到雌激素样活性效应。研究显示,女性骨关节炎发病率高于男性,雌激素水平增高对软骨细胞损伤有保护作用[5]。LPS作为一种常见的促炎因子多应用于各类炎症的体外研究,如骨关节炎、脑膜炎、气道损伤等[6-8]。本研究显示LPS+EDS组软骨细胞增殖率较LPS组增高,提示蜕皮甾酮对损伤的软骨细胞具有保护作用。
细胞因子和炎症因子在骨关节炎的发生发展的病理过程中起着重要作用[9],其中以炎性细胞因子IL-1β以及炎性介质NO尤为显著[10-11]。IL-1β是促进软骨基质降解以及软骨破坏的主要因子之一。既往研究表明骨关节炎患者关节液中IL-1β的含量明显升高[12]。NO能抑制蛋白多糖和胶原蛋白的合成,促进软骨细胞凋亡,并刺激细胞金属蛋白酶的启动和产生,以此介导IL-1β等细胞因子参与调节骨关节炎的发生发展[13]。骨关节中NO主要由iNOS产生,iNOS已被证实对骨关节炎的临床和病理进展有促进作用[14]。正常的软骨细胞受到某些细胞因子如肿瘤坏死因子(TNF)、IL-1β和LPS等刺激后,iNOS的表达升高,使NO水平升高,并协同各种细胞因子增加软骨损害[15]。本研究显示,EDS可抑制LPS诱导的兔软骨细胞iNOS表达,推测EDS通过影响软骨细胞中iNOS的表达水平,抑制NO的产生,减少细胞因子IL-1β生成,从而对软骨细胞损伤起到保护作用。本研究证实蜕皮甾酮对LPS诱发兔软骨细胞损伤有明显的抑制作用,且其作用与软骨细胞中iNOS调节的NO的产生和细胞因子IL-1β改变相关。因此,笔者认为蜕皮甾酮作为一种类植物雌激素对临床防治骨关节炎软骨细胞损伤具有进一步研究的价值。
[1]Qin J,Shang L,Ping AS,et al.TNF/TNFR signal transduction pathway-mediated anti-apoptosis and anti-inflammatory effects of sodium ferulate on IL-1beta-induced rat osteoarthritis chondrocytes in vitro[J].Arthritis Res Ther,2012,14(6):R242.doi:10.1186/ar4227.
[2]Kapur P,Wuttke W,Jarry H,et al.Beneficial effects of beta-EDSysone on the joint,epiphyseal cartilage tissue and trabecular bone in ovariectomized rats[J].Phytomedicine,2010,17(5):350-355.doi: 10.1016/j.phymed.2010.01.005.
[3]Nikniaz Z,Ostadrahimi A,Mahdavi R,et al.Effects of Elaeagnus angustifolia L.supplementation on serum levels of inflammatory cytokines and matrix metalloproteinases in females with knee osteoarthritis[J].Complement Ther Med,2014,22(5):864-869.doi: 10.1016/j.ctim.2014.07.004.
[4]Wang M,Shen J,Jin H,et al.Recent progress in understanding molecular mechanisms of cartilage degeneration during osteoarthritis [J].Ann N Y Acad Sci,2011,1240:61-69.doi:10.1111/j.1749-6632.2011.06258.x.
[5]Nilsson O,Weise M,Landman EB,et al.Evidence that estrogen hastens epiphyseal fusion and cessation of longitudinal bone growth by irreversibly depleting the number of resting zone progenitor cells in female rabbits[J].Endocrinology,2014,155(8):2892-2899.doi: 10.1210/en.2013-2175.
[6]Chang CH,Hsu YM,Chen YC,et al.Anti-inflammatory effects of hydrophilic and lipophilic statins with hyaluronic acid against LPS-induced inflammation in porcine articular chondrocytes[J].J Orthop Res,2014,32(4):557-565.doi:10.1002/jor.22536.
[7]Wang KT,Chen LG,Tseng SH,et al.Anti-inflammatory effects of resveratrol and oligostilbenes from Vitis thunbergii var.taiwanianaagainst lipopolysaccharide-induced arthritis[J].J Agric Food Chem,2011,59(8):3649-3656.doi:10.1021/jf104718g.
[8]Zhang JX,Zhao LJ,Shi H,et al.Effects of Poly(I∶C),LPS and PGN stimulation on the innate immune function of human bronchial epithelium[J].Med J Chin PLA,2013,38(7):552-556.[张景熙,赵立军,石荟,等.聚肌胞苷酸、脂多糖及肽聚糖对人气道黏膜天然免疫功能影响的实验研究[J].解放军医学杂志,2013,38(7):552-556].
[9]Kong D,Zheng T,Zhang M,et al.Static mechanical stress induces apoptosis in rat endplate chondrocytes through MAPK and mitochondria-dependent caspase activation signaling pathways[J].PLoS One,2013,8(7):e69403.doi:10.1371/journal.pone.0069403.
[10]Shakibaei M,Allaway D,Nebrich S,et al.Botanical extracts from rosehip(Rosa canina),willow bark(Salix alba),and nettle leaf(Urtica dioica)suppress IL-1beta-Induced NF-kappaB activation in canine articular chondrocytes[J].Evid Based Complement Alternat Med,2012,2012(509383.doi:10.1155/2012/509383.
[11]Wang F,Wu L,Li L,et al.Monotropein exerts protective effects against IL-1beta-induced apoptosis and catabolic responses on osteoarthritis chondrocytes[J].Int Immunopharmacol,2014,23(2): 575-580.doi:10.1016/j.intimp.2014.10.007.
[12]Kobayashi M,Squires GR,Mousa A,et al.Role of interleukin-1 and tumor necrosis factor alpha in matrix degradation of human osteoarthritic cartilage[J].Arthritis Rheum,2005,52(1):128-135.doi:10.1002/art.20776.
[13]Takada K,Hirose J,Yamabe S,et al.Endoplasmic reticulum stress mediates nitric oxide-induced chondrocyte apoptosis[J].Biomed Rep,2013,1(2):315-319.doi:10.3892/br.2013.52.
[14]Cuzzocrea S,Chatterjee PK,Mazzon E,et al.Beneficial effects of GW274150,a novel,potent and selective inhibitor of iNOS activity,in a rodent model of collagen-induced arthritis[J].Eur J Pharmacol,2002,453(1):119-129.doi:10.1016/S0014-2999(02)02338-5.
[15]Fioravanti A,Lamboglia A,Pascarelli NA,et al.Thermal water of Vetriolo,Trentino,inhibits the negative effect of interleukin-1β;on nitric oxide production and apoptosis in human osteoarthritic chondrocyte[J].J Biol Regul Homeost Agents,2013,27(3):891-902.
(2014-10-11收稿 2015-01-14修回)
(本文编辑 胡小宁)
Protective effect of ecdysterone on rabbits chondrocytes that is injured by lipopolysaccharide
WANG Gangtao,ZHANG Xuhui△,ZHANG Weidong,XIA Lei
Department of Joint surgery,the 371thCenter Hospital of The PLA,Xinxiang 453000,China
△Corresponding Author E-mail:xuhuiz@163.com
Objective To study the effect of ecdysterone(EDS)on rabbits chondrocytes that is injuried by lipopolysaccharide(LPS).Methods Aricular chondrocytes were isolated from rabbits and randomly divided into three groups:control group;chondrocytes with LPS induced injury(LPS group);injury chondrocytes treated with EDS(LPS+EDS group).The cell proliferation and cell apoptosis of chondrocytes were determined by MTT method and flow cytometry assay respectively.The mRNA and protein expression levels of inducible nitric oxide synthase(iNOS)were detected by RT-PCR and western blot.In addition,the content of NO and IL-1β were measured by nitric acid reductase assay and enzyme-linked immunosorbent assay(ELISA)respectively.Results Attenuated proliferation,increased cell apoptosis,iNOS,NO and IL-1β were seen in LPS group,but all these changes were significantly reversed by EDS treatment(P<0.05).Conclusion Ecdysterone exhibited a protective effect on LPS induced rabbits chondrocytes injury through inhibiting the expression of iNOS.
Ecdysterone;chondrocytes;lipopolysaccharides;cell proliferation;apoptosis;interleukin-1beta;iNOS
R684.3
A DOI:10.11958/j.issn.0253-9896.2015.06.003
解放军第371中心医院关节外科(邮编453000)
王刚涛(1978),男,主治医师,学士,主要从事退行性骨关节炎及关节镜和关节置换
△E-mail:xuhuiz@163.com
