胃癌伴神经内分泌分化HER-2基因扩增和蛋白表达及预后分析
2015-08-24宋魏于庆凯张晶晶张建波孙淼淼
宋魏,于庆凯△,张晶晶,张建波,孙淼淼
胃癌伴神经内分泌分化HER-2基因扩增和蛋白表达及预后分析
宋魏1,于庆凯1△,张晶晶2,张建波1,孙淼淼1
目的 观察胃癌伴神经内分泌分化(NED)和胃癌中HER-2基因扩增及蛋白表达情况。方法 回顾性分析胃癌伴神经内分泌分化患者70例和具有相同分期的胃癌患者150例,采用免疫组化法(IHC)联合双色银染色素原位杂交(DISH)检测胃癌伴NED和胃癌中HER-2基因扩增和蛋白表达情况,并对胃癌伴NED进行预后分析。结果 胃癌伴NED和胃癌中HER-2蛋白过表达率分别为20.00%和21.33%,HER-2基因扩增率分别为8.57%和14.67%。HER-2蛋白表达、HER-2基因扩增及基因扩增类型2组间差异均无统计学意义;胃癌伴NED17号染色体多体与HER-2基因扩增呈正相关。胃癌伴NED患者中HER-2基因扩增者术后生存期短于HER基因不扩增者。多因素分析显示胃癌伴或不伴NED、HER-2基因是否扩增、淋巴结转移和手术方式是预后的独立影响因素。结论 胃癌伴NED属于胃癌特殊类型,其HER-2基因扩增、蛋白表达情况和胃癌相同,HER-2基因扩增的胃癌伴NED患者预后差。
癌,神经内分泌;胃肿瘤;原癌基因蛋白质类;原位杂交;基因扩增;HER-2;蛋白表达
人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)是一种跨膜酪氨酸蛋白激酶受体,其基因扩增及其蛋白过表达是乳腺癌预后的判断因子之一,与预后不良及存活期较短相关。越来越多的证据表明,HER-2是重要的生物学标志物,在胃癌发生中起关键作用,其扩增率或过表达率为7%~34%,HER-2阳性的胃癌可能预示肿瘤恶性程度高和预后不良[1]。胃癌伴神经内分泌分化(neuro⁃endocrine cell differentiation,NED)是胃癌的一种特殊类型,指分化的神经内分泌细胞以单个或者细胞巢的形式散在分布于胃癌细胞之间,其神经内分泌细胞占肿瘤成分≤30%。本研究回顾性分析70例胃癌伴NED和150例具有相同分期的胃癌患者,比较两者HER-2基因扩增和蛋白表达情况有无差异。
1 资料与方法
1.1 一般资料 根据免疫组化(IHC)结果从2011年1月—2014年1月河南省肿瘤医院治疗的875例胃癌患者中筛选出70例胃癌伴NED蜡块(胃癌NED组)和150例具有相同分期的不伴NED的胃腺癌蜡块(胃癌组)。胃癌NED组中,男52例,女18例,年龄(56.49±8.92)岁;胃癌组中,男119例,女31例,年龄(57.96±7.31)岁,2组间性别(χ2=0.441)、年龄(t=1.293)比较差异无统计学意义。所有患者均进行胃癌手术治疗,其中155例进行根治切除,65例姑息切除。2组患者随访时间12~36个月,截止日期为2013年12月,无失访病例。
1.2 IHC 试剂购均自VENTANA公司,采用VENTANA全自动免疫组织化学仪(Bench Maker)进行免疫组织化学染色,TBS代替一抗作为阴性对照,HER-2蛋白表达(+++)的乳腺非特殊型浸润性癌为阳性对照。在胃癌组织切片中标记嗜铬素A(CgA)、突触素(Syn)、神经细胞黏附分子(CD56),染色定位于胞浆。3个特异的神经内分泌标志物中有任何一个标志物表达即判定为神经内分泌标志物阳性。在光镜下观察神经内分泌细胞在胃癌组织中以单个细胞或细胞巢形式分散存在,≤30%诊断为胃癌伴NED。HER-2蛋白表达结果:0(在<10%的肿瘤细胞中无反应或细胞膜染色),+(在≥10%的肿瘤细胞中有微弱或不完整细胞膜染色),++(在≥10%的肿瘤细胞中有弱-中度的完全、基底外侧或侧面细胞膜染色),+++(在≥10%的肿瘤细胞中有强烈的完全、基底外侧或侧面细胞膜染色)。0和+视为无或低表达,++和+++视为过表达。
1.3 双色银染色素原位杂交(DISH) HER/17号染色体DNA双探针及试剂均购自VENTANA公司,采用VENTANA全自动免疫组织化学仪(Bench Maker XT)对胃癌伴NED和胃癌HER-2蛋白过表达(IHC染色HER-2++和+++)的组织进行染色。肿瘤组织中计数20个细胞核17号染色体(红色)拷贝平均值和HER-2基因(黑色)拷贝平均值。17号染色体拷贝数可表现为单倍体(1个红色信号)、整倍体(2个红色信号)和多倍体(≥3个红色信号)。HER-2基因拷贝平均值与17号染色体拷贝平均值的比值≥2.0且<6.0为扩增,比值<2.0为无扩增,比值≥6.0为簇扩。
1.4 统计学方法 数据处理应用SPSS 19.0软件,2组间率的比较采用χ2检验,两变量间的相关性应用χ2检验并计算列联系数进行分析,生存时间为胃癌手术之日至最后1次随访或死亡时间,并对其进行Log-rank检验,作出Kaplan-Meier生存曲线。运用Cox比例风险模型评估伴或不伴NED及各种临床病理因素对胃癌患者预后的影响。P<0.05为差异有统计学意义。
2 结果
2.1 HER-2的蛋白表达水平和HER-2基因扩增情况 HER-2蛋白阳性信号定位于细胞膜,胞质着色罕见。胃癌NED组中HER-2蛋白表达情况为:0~+56例,++12例,+++2例,过表达率为20.00% (14/70),胃癌组中HER-2蛋白表达情况为:0~+ 118例,++17例,+++15例,过表达率为21.33%(32/ 150)。2组表达情况差异无统计学意义(χ2=4.384,P>0.05),见图1。HER-2基因DISH染色信号定位于细胞核。胃癌NED组的基因扩增6例(8.57%),胃癌组的基因扩增22例(14.67%),差异无统计学意义(χ2=1.095,P>0.05),见图2。HER-2基因扩增情况:6例胃癌NED组中整倍体扩增1例,多倍体扩增3例,整倍体簇扩2例。22例胃癌组中整倍体扩增6例,多倍体扩增14例,整倍体簇扩2例,差异无统计学意义(χ2=2.296,P>0.05)。
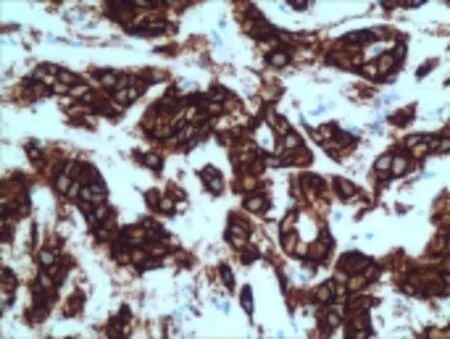
Fig.1 Positive HER-2 expression in gastric carcinoma with NED(SP,×400)图1 胃癌NED组HER-2蛋白+++(SP,×400)

Fig.2 HER-2 amplification and Chromosome 17 euploid in gastric carcinoma with NED(DISH,×400)图2 胃癌NED组HER-2基因扩增,17号染色体整倍体(DISH,×400)
2.2 胃癌NED组17号染色体多体与HER-2基因扩增的相关性 HER-2基因扩增的胃癌NED组中17号染色体整倍体3例,多倍体3例,HER-2基因不扩增的胃癌NED组中17号染色体整倍体60例,多倍体 4例,2组比较差异有统计学意义(χ2= 19.782),胃癌伴NED17号染色体多倍体与HER-2基因扩增存在关联性(r=0.471,P<0.05)。
2.3 生存分析
2.3.1 生存率分析结果 中位随访时间17个月(5~36个月),胃癌NED组HER-2基因扩增患者术后1年生存率为66.66%,3年生存率为0,中位生存期为13个月,胃癌NED组HER-2基因不扩增患者术后 1年生存率为 65.33%,3年生存率为26.56%,中位生存期为19个月,差异有统计学意义(χ2=5.116,P<0.05),见图3。

Fig.3 Kaplan-Meier survival curves of HER-2 gene amplification and HER-2 gene non-amplification in gastric cancer patients with NED图3 胃癌伴NED患者HER-2基因扩增组与不扩增组Kapla-Meier生存曲线

Tab.1 Variable assignment of factors influencing prognosis of gastric cancer表1 胃癌预后影响因素变量赋值情况
2.3.2 多因素分析 以生存状态为因变量(生存=0,死亡=1),以胃癌伴或不伴NED、HER-2基因是否扩增、淋巴结转移、远处转移、TNM分期、性别、年龄、手术方式为自变量,将各因素纳入COX风险比例模型,见表1、2。结果显示胃癌伴或不伴NED、HER-2基因是否扩增、淋巴结转移和手术方式是预后的独立影响因素。

Tab.2 Assessment of independent factors influencing prognosis of gastric cancer patients in COX proportional hazard model表2 运用COX比例风险模型评估胃癌预后的影响因素
3 讨论
2010 年第4版《世界卫生组织消化系统肿瘤》把通过IHC证实神经内分泌细胞在癌组织中≤30%诊断为胃癌伴NED,归属为腺癌范畴。把神经内分泌细胞达到30%定义为混合性腺神经内分泌癌[2]。胃腺癌伴NED现象在光镜下难以判定,而超微结构观察及免疫组织化学染色对诊断具有重要意义,电镜找到NE颗粒最可靠。由于电镜标本取材局限,制作周期长,费用高,免疫组织化学NE标记相对是研究NE分化的一种十分实用、敏感和可靠的手段。CgA、Syn是近年来发现的作为诊断NE存在和分布的特异性标志物。本研究选择SyN、CgA、CD56 这3种神经内分泌标志物共同应用,可以提高NE分化的诊断率,为临床诊断和治疗提供可靠依据。
染色体的多体是癌细胞普遍存在的遗传学特征之一。因为HER-2基因定位在17号染色体上,17号染色体多体可影响HER-2基因扩增的判读[3]。17号染色体出现多体时,HER-2基因也同步扩增,从而出现了HERZ基因扩增的假阳性结果,因此检测HERZ-2基因扩增必须同时有17号染色体作为参考,这样可以避免17号染色体多体产生的假阳性结果[3]。本研究在胃癌和胃癌伴NED患者的HER-2 DISH检测结果中均发现HER-2基因/17号染色体共扩增的情况,而且HER-2基因扩增的胃癌NED组出现17号染色体多体的概率比HER-2基因无扩增组更高。DISH检测HER-2基因状态时应用不同颜色的荧光信号同时标记了HER-2基因和17号染色体着丝粒,DISH比值法在17号染色体为异倍体时校正了17号染色体拷贝数差异的影响,是比IHC更准确的方法。
目前大量的研究发现,在多种恶性肿瘤中存在HER-2基因的异常扩增,并且与其预后不良有关。HER-2在胃癌发生中起关键作用,其扩增率或过表达率为7%~34%,HER-2阳性的胃癌可能预示肿瘤恶性程度高和预后不良[4]。胃癌伴NED患者的术后生存情况,各文献报道不同。Naritomi等[5]研究发现胃癌伴NED的患者术后生存时间较短,预后差。于红梅等[6]也得出了相似的结论。但有学者认为胃腺癌中神经内分泌分化细胞虽然可能不是独立的提示患者预后的因素,但可以在一定程度上影响肿瘤的分级和分期。胃癌伴NED HER-2基因扩增及蛋白表达情况国内外报道较少。本研究发现虽然胃癌伴NED是胃癌的特殊类型,但胃癌伴NED患者的HER-2基因扩增和蛋白表达情况和不伴NED的胃癌相同。HER-2基因扩增的胃癌伴NED患者术后生存期短于不扩增患者,且胃癌伴或不伴NED、HER-2基因是否扩增、淋巴结转移和手术方式是预后的独立影响因素。ToGA研究显示,在欧美国家和日本,曲妥珠单抗联合化疗成为目前治疗HER2阳性胃癌患者的最佳选择[7]。这个结果引起了广泛关注,使胃癌的靶向治疗成为一个新的研究热点。张小田等[8]也认为曲妥珠单抗联合化疗治疗HER2阳性胃癌安全有效,将其应用于二线化疗、维持治疗亦可能使患者获益。中国15家研究中心参与的ToGA试验证实曲妥珠单抗联合化疗可作为HER-2阳性的中国晚期胃或胃食管结合部腺癌新的标准治疗[9]。对于胃癌伴NED且HER-2阳性患者使用曲妥珠单抗联合化疗能否作为无法手术的局部进展期或转移性胃或胃食管结合部腺癌新的治疗选择还需要进一步研究。
[1]Gravalos C,Jimeno A.HER2 in gastric cancer:a new prognostic factor and a novel therapeutic target[J].Ann Oncol,2008,19:1523-1529.
[2]Pericleous M,Toumpanakis C,Lumgair H,et al.Gastric mixed ade⁃ noneuroendocrine carcinoma with a trilineage cell differentiation: case report and review of the literature[J].Case Rep Oncol,2012,5 (2):313-319.
[3]Zhao P,Jiang XG,Li XY,et al.Clinicopathological application of fluorescence in situ hybridization technique to diagnose and anal⁃yse HER-2 gene amplification and chromosome 17 polysomy in in⁃vasive ductalbreast cancer tissues[J].Chinese Journal of Cancer Pre⁃vention and Treatment,2011,18(9):680-683.[赵坡,姜学革,李晓瑛,等.FISH检测乳腺癌HER-2基因扩增及17号染色体多体状况及其临床病理学意义的分析[J].中华肿瘤防治杂志,2011,18(9):680-683].
[4]Pietrantonio F,De Braud F,Da Prat V,et al.A review on biomark⁃ers for prediction of treatment outcome in gastric cancer[J].Antican⁃cer Res,2013,33(4):1257-1266.
[5]Naritomi K,Futami K,Arima S,et al.Malignant potential regarding mucin phenotypes and endocrine cell differentiation in gastric ade⁃nocarcinoma[J].Anticancer Res,2003,23(6a):4411-4422.
[6]Yu HM,Liu XW,Long ZW,et al.Analysis of clinicopathological features and prognosis of gastric cancer with neuroendocrine cell differentiation[J].China Oncology,2013,23(1):42-46.[于红梅,刘晓文,龙子雯,等.胃癌伴神经内分泌分化的临床病理及预后分析[J].中国癌症杂志,2013,23(1):42-46].
[7]Sawaki A,Ohashi Y,Omuro Y,et al.Efficacy of trastuzumab in Jap⁃anese patients with HER2-positive advanced gastric or gastroesoph⁃ageal junction cancer:a subgroup analysis of the Trastuzumab for Gastric Cancer(ToGA)study[J].Gastric Cancer,2012,15:313-322.
[8]Zhang XT,Wu YH,Gong JF,et al.Clinical application of trastuzumab plus chemotherapy in the treatment of HER2-positive gastricor gastrooesophageal junction adenocarcinoma:a retrospective analysis of 75 cases[J].Med J Chin PLA,2014,39(3):206-211.[张小田,伍远航,龚继芳,等.曲妥珠单抗在HER2阳性胃或胃食管结合部腺癌中的临床应用实践:75例回顾性研究[J].解放军医学杂志,2014,39(3): 206-211].doi:10.11855/j.issn.0577-7402.2014.03.08.
[9]Shen L,Xu JM,Feng FY,et al.Trastuzumab in combination with chemotherapy versus chemotherapy alone for first line treatment of HER2-positive advanced gastric or gustroesophageal junction can⁃cer:a PhaseⅢ,multi-center,randomized controlled trial,Chinese subreport[J].Chinese Journal of Oncology,2013,4(35):295-300.[沈琳,徐建明,冯奉仪,等.曲妥珠单抗联合化疗一线治疗人表皮生长因子受体2阳性无法手术的局部进展期或转移性胃或胃食管结合部腺癌的多临床试验中国亚组报告中心随机对照Ⅲ期[J].中华肿瘤杂志,2013,4(35):295-300].
(2014-05-07收稿 2014-11-13修回)
(本文编辑 魏杰)
Roles of HER-2 gene amplification and protein expression in gastric carcinoma with neuroendocrine differentiation
SONG Wei1,YU Qingkai1△,ZHANG Jingjing2,ZHANG Jianbo1,SUN Miaomiao1
1 Department of Pathology,Affiliated Cancer Hospital of Zhengzhou University,Henan 450003,China;2 Department of Car⁃diology,Zhengzhou Central Hospital Affiliated to Zhengzhou University
△Corresponding Author E-mail:yuqingkai@hotmail.com
Objective To evaluate the gene amplification and protein expression of HER-2 in gastric carcinoma with or without neuroendocrine differentiation(NED),and to explore the difference in HER-2 gene profile between these two neo⁃plasms.Methods Cases of gastric carcinoma with NED(n=70)and cases of gastric carcinoma without NED(n=150)were retrospectively reviewed.Gene amplification and protein expression of HER-2 genes in gastric carcinoma with or without NED were detected by combination of immunohistochemical method(IHC)and double color silver dye for in situ hybridiza⁃tion(DISH).Prognosis of gastric cancer patients with NED were predicted using Kaplan-Meiers survival analysis.Results Expression rates of HER-2 in gastric cancer with and without NED are 20.00%and 21.33%respectively.Amplification of HER-2 in gastric cancer with and without NED are 8.57%and 14.67%respectively.Gene amplification and protein expres⁃sion of HER-2 between gastric cancer with NED and without NED showed no statistical difference.Chromosome 17 multibody positively correlated with gene HER-2 amplification in Gastric carcinoma with NED.Postoperative survival period in patients of gastric carcinoma with NED and HER-2 amplification was shorter than that in patients of gastric carcinoma with⁃out NED but with HER-2 amplification.Gastric carcinoma with or without NED,HER-2 gene amplification,lymph node me⁃tastasis and operation method obviously correlate with prognosis of gastric carcinoma patients(P<0.05).Conclusion The gastric cancer with NED is a special type of gastric cancer,there was no difference of gene amplification and protein expres⁃sion of HER-2 gene between gastric carcinoma with NED and without NED.Poor prognosis would be expected in gastric can⁃cer patients with NED and HER-2 amplification.
carcinoma,neuroendocrine;stomach neoplasms;proto-oncogene proteins;in situ hybridization;gene am⁃plification;HER-2;protein expression
R735.2
A
10.11958/j.issn.0253-9896.2015.04.014
河南省医学科技攻关项目(2011020159,200803121);河南省基础与前沿技术研究项目(102300410038);河南省公益科研所预研项目(082103810505)
1郑州大学附属肿瘤医院病理科(邮编450003);2郑州大学附属中心医院心内科
宋魏(1980),女,主治医师,主要从事肿瘤病理学方面研究
△E-mail:yuqingkai@hotmail.com
