甲基化调节miR-200b的表达及其对胃癌MGC-803细胞增殖侵袭能力的影响
2015-08-24郭蓉宁向红姜葵张庆瑜
郭蓉,宁向红,姜葵,张庆瑜
甲基化调节miR-200b的表达及其对胃癌MGC-803细胞增殖侵袭能力的影响
郭蓉,宁向红,姜葵,张庆瑜△
目的 体外研究基因miR-200b发生甲基化的不同程度及其表达量的差异对胃癌细胞MGC-803增殖、侵袭、凋亡及对上皮间质转化的影响。方法 以正常胃黏膜上皮细胞GES-1、胃癌细胞MGC-803为研究对象,提取细胞总RNA,逆转录后进行实时荧光定量PCR检测2种细胞系中miR-200b的表达量;亚硫酸氢钠修饰PCR(BSP)法检测miR-200b启动子区甲基化水平。用不同浓度5-氮杂胞苷(5′-Aza-CdR)药物处理MGC-803细胞72 h后,同法检测miR-200b的表达量及启动子区甲基化水平变化。根据上述实验结果选择合适的药物作用浓度和时间即(10 μmol/L,72 h)作为处理组。通过Transwell侵袭实验观测细胞侵袭能力;流式细胞技术检测细胞周期及凋亡的分布情况;Western-blot检测上皮间质转化(EMT)相关指标E-cadherin、N-cadherin、ZEB1、Slug、基质金属蛋白酶(MMP)9等的表达水平。结果 miR-200b在GES-1中表达量较MGC-803高(P=0.022)。启动子区甲基化水平则与之相反(P=0.034)。药物不同浓度作用后的MGC-803细胞系miR-200b表达量有随浓度升高而升高的趋势,作用浓度为10 μmol/L时miR-200b启动子区甲基化水平较对照组低(P=0.043)。与对照组相比,处理组细胞晚期凋亡数增多;G0/G1期细胞数显著增多,S期显著减少;穿过Transwell小室细胞数显著减少;Western-blot实验表明E-cad⁃herin表达量升高,N-cadherin、ZEB1、Slug、MMP9表达量降低。结论 miR-200b启动子区甲基化程度的不同可以影响其表达量,而miR-200b表达量的异常又与胃癌MGC-803细胞增殖、侵袭能力密切相关。
胃肿瘤;腺癌;细胞凋亡;细胞增殖;DNA甲基化;微RNA-200b
表观遗传学修饰包括DNA甲基化及组织蛋白乙酰化,它们在肿瘤形成和发展过程中有很重要的作用,尤其是DNA甲基化[1]。DNA甲基化是在甲基转移酶的催化下,DNA的CG 2个核苷酸的胞嘧啶被选择性地添加甲基形成5-甲基胞嘧啶后对肿瘤进行调节的。研究已证实,基因启动子区发生异常甲基化后可对肿瘤的发生、发展产生一定的影响,如P21基因启动子区高度甲基化后导致表达量降低,同时增加了乳腺癌的发病率[2];miR-200b和甲基化转移酶抑制剂共同作用可以在不同程度上阻止间质表型肝细胞癌发生肺转移[3]。Micro-RNAs是由19~22个核苷酸组成的非编码RNA,主要结合在目标mRNA的3′非翻译区(3′-UTR),通过转录后水平对基因表达进行调节[4]。Mi-RNAs的表达模式具有高度保守性、时序性和组织特异性,在不同组织、不同发育阶段中表达水平有显著差异,是调控其他功能基因表达的重要分子[5]。本实验旨在研究miR-200b基因启动子区异常甲基化的程度与基因表达量的关系,及基因甲基化作用对胃癌MGC-803细胞增殖、侵袭能力的影响。
1 材料与方法
1.1 实验材料 GES-1细胞购自北京肿瘤细胞库,MGC-803细胞购自中国科学院上海生科院细胞资源中心。甲基化作用抑制剂5-氮杂胞苷(5′-Aza-CdR)购自美国Sigma公司,TRIZOL试剂购自美国Ambion公司,dNTP mixture、反转录酶(MMLV)、RNase抑制剂购自大连TaKaRa公司,荧光定量miRNAPCR试剂盒、逆转录引物及RT-PCR引物购自上海吉玛公司。NI-细胞基因组DNA提取试剂盒,处理、纯化回收DNA的EpiTect Bisulfite kit,No.59104试剂盒购自QIA⁃GEN公司,pMD™18-T Vector Cloning Kit购自大连TaKaRa公司。细胞凋亡检测采用南京凯基公司Annexin V-FITC细胞凋亡检测试剂盒,Matrigel购自美国BD公司,E-cadherin、N-cadherin、ZEB1、Slug、基质金属蛋白酶(MMP)9单克隆抗体均购自美国Cellsignal公司,相应二抗均购自中杉金桥公司。
1.2 方法
1.2.1 细胞培养与分组处理 GES-1、MGC-803细胞接种于含10%胎牛血清(56℃水浴灭活40min)DMEM高糖培养基中,在37℃含有5%CO2的湿润空气恒温密闭式培养箱中培养,实验时细胞处于对数生长期。第一部分:验证miR-200b 在GES-1、MGC-803细胞中的表达量差异。第二部分:用不同浓度5′-Aza-CdR(2.5、5、7.5、10 μmol/L)作用胃癌MGC-803细胞72 h后,检测miR-200b表达量差异,并选择miR-200b升高较明显所对应药物浓度作为处理组进行下一步实验,对照组为相同条件下空白对照。第三部分:验证miR-200b表达量差异在调节增殖、侵袭、上皮间质转化中的作用。
1.2.2 RNA提取及实时荧光定量PCR法检测miR-200b表达量变化 TRIZOL法提取生长状态良好的GES-1和处理前后的MGC-803细胞总RNA,依照试剂盒说明书配置逆转录反应体系,所用引物为特异miR-200b逆转录引物以及内参U6逆转录引物,得到cDNA,逆转录条件:95℃5 min,37℃1 h。以逆转录产物cDNA为模板进行PCR反应,检测miR-200b表达量变化。PCR反应条件:预变性95℃ 5min,95℃ 30s,62℃ 30s,共40个循环,得出各组Ct值,所得结果按照2-ΔΔCt法进行计算。
1.2.3 亚硫酸氢钠修饰测序PCR(BSP)法检测miR-200b基因启动子区甲基化水平变化 用NI-细胞基因组DNA提取试剂盒提取GES-1、MGC-803细胞系基因组DNA,琼脂糖凝胶电泳检测DNA完整性。使用QIAGEN(EpiTect Bisulfite kit,No.59104)试剂盒处理、纯化回收DNA并作为模板,设计并验证合成引物4对进行PCR,从中优选1对引物,其特异性引物序列:上游5′-GTATTTAGAGGAAGATGAGATG-3′,下游5′-AACCTAACTTATTAATTAACCTAC-3′,产物372 bp。扩增条件为95℃ 5min,95℃ 40s、54℃ 40s、72℃ 50s,共40个循环,72℃ 10min,产物回收后使用TaKaRa(pMD™18-T Vector Cloning Kit)连结、转化大肠杆菌DH5α,摇菌后涂板(加Amp的LB固体培养基),做菌落PCR检测,挑取阳性菌放入加有Amp的LB液体培养基摇菌,过夜后测序。使用BiQAnalyzer软件对测序结果进行CpG岛甲基化水平分析。
1.2.4 细胞凋亡测定 选择生长在直径为60 mm培养皿中MGC-803细胞系处理组和对照组,弃去培养基,PBS清洗2次,用不含EDTA的胰酶消化收集于EP管中,1 000 r/min离心5 min后弃去上清,PBS洗涤2~3次后收集细胞(1~5)×105个/mL,按说明书加入凯基凋亡试剂盒中试剂,室温避光反应5~15 min,立即于real-tec流式细胞仪中于488 nm激发波长下检测细胞凋亡情况。
1.2.5 细胞周期测定 选择生长在6孔板中的MGC-803细胞系处理组和对照组,常规消化离心细胞,收集于EP管中,之后于EP管中加入约500 μL预冷的75%乙醇溶液,于4℃冰箱固定过夜,离心后弃去乙醇,PBS洗涤2次,加入300 μL PI溶液。避光染色20 min后,1 000 r/min离心5 min,弃去染料,PBS洗涤后于流式细胞仪488 nm波长下检测各组细胞周期分布情况。
1.2.6 Transwell侵袭实验检测细胞侵袭能力 在8 μm小孔聚碳酸酯滤膜的培养小室上铺用预冷无血清DMEM培养基稀释的Matrigel机制胶(Matrigel∶DMEM=1∶2)30 μL,37℃培养箱内孵育待其凝固,接种150 μL无血清培养基稀释MGC-803细胞约50 000个,下室加入500 μL含10%胎牛血清DMEM培养液,每组设3个复孔。37℃、5%CO2条件下培养48 h后,取出Transwell小室,弃去上室液体,用棉签轻轻擦掉上层未迁移细胞,苏木精染色5 min,PBS洗涤。DP-70荧光相差倒置显微镜(×100)采集图像,随机读取3个视野,计算穿过膜的细胞数并取平均值。
1.2.7 Western-blot检测细胞蛋白表达水平 分别收集对照组及处理组MGC-803细胞,用细胞裂解液RIPA裂解提取细胞总蛋白。SDS-PAGE凝胶电泳分离,恒压80 V电转移至PVDF印迹膜。膜封闭液封闭1 h后,加入一抗E-cad⁃herin、N-cadherin、ZEB1、Slug、MMP9、GAPDH(1∶1 000稀释)4℃孵育过夜。次日室温复温30 min后PBST洗膜,用辣根过氧化物酶标记的二抗(1∶1 000稀释)室温孵育1 h,凝胶成像系统采集成像。GAPDH蛋白作为内参。以目标蛋白条带灰度值/同一样本内参条带灰度值计算目标蛋白相对表达量。以上实验重复3次。
1.3 统计学方法 使用SPSS 11.0软件进行分析,计量资料采用均数±标准差(±s)表示,多组之间差异比较使用单因素方差分析,多重比较采用LSD-t检验;2组间比较采用成组t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 GES-1和MGC-803细胞miR-200b的表达水平 GES-1细胞中miR-200b表达高于MGC-803细胞(3.84±0.43 vs 1.98±0.29,t=6.709,P=0.022)。
2.2 不同浓度处理对MGC-803中miR-200b表达水平的影响 不同浓度(0、2.5、5.0、7.5、10 μmol/L)5′-Aza-CdR处理MGC-803细胞72 h后miR-200b表达量分别为1.00±0.00、2.35±0.39、2.28±0.26、3.36±0.01、5.98±0.63,差异有统计学意义(F=9.283,P<0.01),以10 μmol/L升高较为显著。
2.3 GES-1和MGC-803细胞miR-200b启动子区甲基化差异 MGC-803中miR-200b启动子区发生甲基化程度较GES-1显著升高([93.80±6.00)%vs (78.10±7.60)%,t=5.636,P=0.034]。
2.4 MGC-803处理组和对照组中miR-200b启动子区甲基化差异 10 μmol/L 5′-Aza-CdR处理组细胞甲基化程度较对照组降低([87.50±11.30)%vs (93.80±6.00)%,t=4.642,P=0.043]。GES-1和MGC-803对照组及处理组的miR-200b启动子区甲基化位点图,见图1。
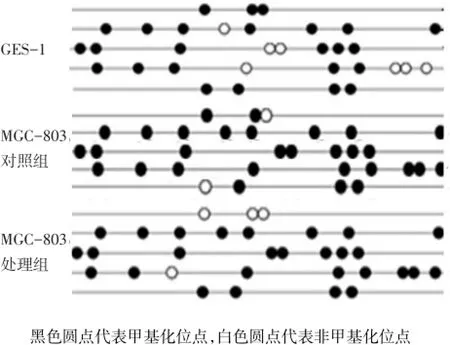
Fig.1 Methylation profiles around the transcriptional start site of miR-200b in GES-1 and MGC-803图1 GES-1和MGC-803对照组及处理组的miR-200b启动子区甲基化位点图
2.5 去甲基化处理后MGC-803细胞凋亡水平变化结果 MGC-803处理组较对照组晚期细胞凋亡率增加([5.25±0.32)%vs(3.52±0.18)%,t=9.636,P= 0.011],见图2。
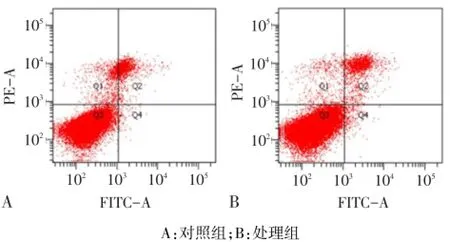
Fig.2 Ratio of apoptotic cells in 5′-Aza-CdR treated and control MGC-803 cells图2 处理组和对照组MGC-803细胞系凋亡率
2.6 去甲基化处理后 MGC-803细胞周期变化 MGC-803处理组较对照组q细胞大多被阻滞在G0/G1期,而G2/M期、S期的细胞数明显减少(均P<0.01),见图3、表1。
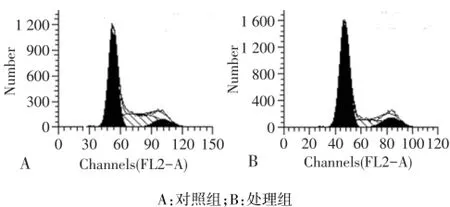
Fig.3 Cell cycle profiles of MGC-803 after 5′-Aza-CdR treatment图3 5′-Aza-CdR处理后的MGC-803细胞周期图
Tab.1 The percentages of various cell phages in 5′-Aza-CdR treated and control MGC-803 cells表1 处理组和对照组MGC-803细胞在不同细胞周期的比例 (n=3,%,±s)
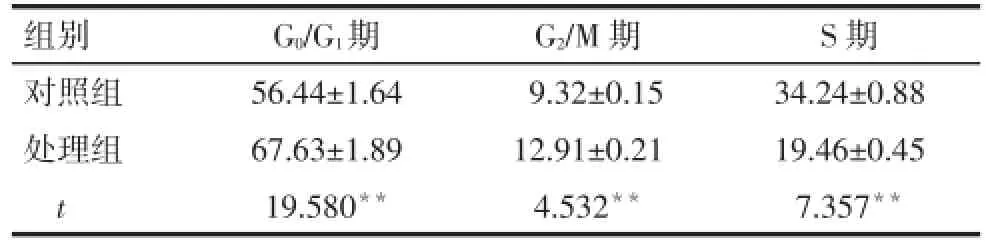
Tab.1 The percentages of various cell phages in 5′-Aza-CdR treated and control MGC-803 cells表1 处理组和对照组MGC-803细胞在不同细胞周期的比例 (n=3,%,±s)
**P<0.01
组别对照组处理组t G0/G1期56.44±1.64 67.63±1.89 19.580**G2/M期9.32±0.15 12.91±0.21 4.532**S期34.24±0.88 19.46±0.45 7.357**
2.7 去甲基化处理后MGC-803细胞系侵袭能力变化 与对照组相比,处理组穿过小室的细胞数显著减少,且每个视野的细胞数均少于对照组([11.03± 0.93)个 vs(18.82±1.36)个,t=6.722,P=0.021],见图4。
2.8 MGC-803细胞上皮间质转化(EMT)相关蛋白表达变化 处理组MGC-803细胞中E-cadherin蛋白相对表达水平较对照组明显升高(P<0.01),而N-cad⁃herin、ZEB1、Slug、MMP9较对照组明显降低(P<0.01),见图5、表2。
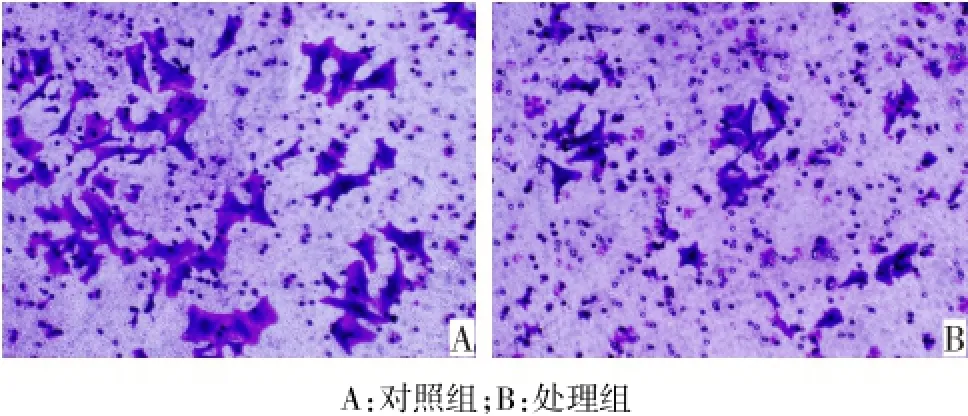
Fig.4 The invasiveness of MGC-803 after 5′-Aza-CdR treatment图4 5′-Aza-CdR处理MGC-803细胞后侵袭能力的变化(×100)
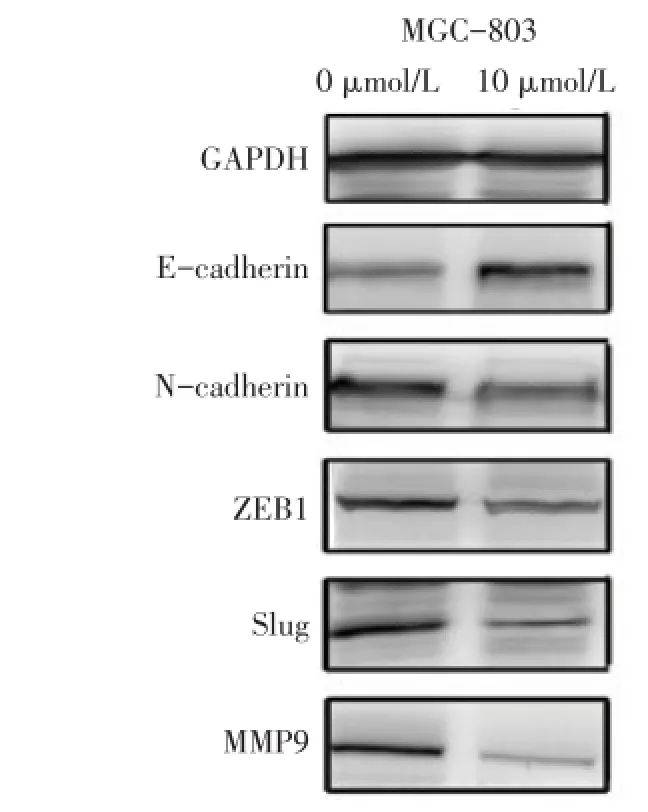
Fig.5 The protein expression levels of E-cadherin,N-cadherin,ZEB1,Slug,MMP9 in 5′-Aza-CdR treated and control MGC-803 cells图5 MGC-803处理组及对照组中E-cadherin、N-cadherin、ZEB1、Slug、MMP9蛋白表达水平
Tab.2 Comparison of protein expression levels of E-cadherin,N-cadherin,ZEB1,Slug,MMP9 5′-Aza-CdR treated and control MGC-803 cells表2 MGC-803处理组及对照组中E-cadherin、N-cadherin、ZEB1、Slug、MMP9蛋白表达水平比较(n=3,±s)
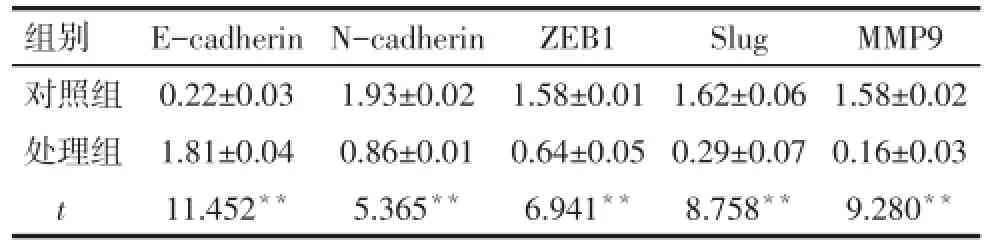
Tab.2 Comparison of protein expression levels of E-cadherin,N-cadherin,ZEB1,Slug,MMP9 5′-Aza-CdR treated and control MGC-803 cells表2 MGC-803处理组及对照组中E-cadherin、N-cadherin、ZEB1、Slug、MMP9蛋白表达水平比较(n=3,±s)
**P<0.01
组别对照组处理组t E-cadherin 0.22±0.03 1.81±0.04 11.452**N-cadherin 1.93±0.02 0.86±0.01 5.365**ZEB1 1.58±0.01 0.64±0.05 6.941**Slug 1.62±0.06 0.29±0.07 8.758**MMP9 1.58±0.02 0.16±0.03 9.280**
3 讨论
3.1 基因异常甲基化的作用 异常DNA甲基化和组织蛋白乙酰化是表观遗传学修饰中最主要的两部分,在基因致癌与抑癌研究中有重要作用[6]。其能在不改变DNA序列的前提下,改变生物的遗传表象[7]。当基因发生异常甲基化时,常导致转录沉默,使重要基因如抑癌基因、DNA修复基因等丧失功能,从而导致正常细胞的生长分化调控失常以及DNA损伤不能被及时修复,这与多种肿瘤形成密切相关[8]。MiR-200b是长度仅有19~22 nt的核苷酸片段。本次研究证实miR-200b上游启动子区有CpG岛聚集区并且这些区域有甲基化现象存在,启动子区发生甲基化后,影响基因正常转录和翻译过程,导致其表达量降低;同时也可以在不同程度上增强肿瘤细胞MGC-803的侵袭性和增殖性。
3.2 5′-Aza-CdR的去甲基化作用 5′-Aza-CdR 是DNA甲基转移酶(DNMT)的抑制剂,它可以和DNMT发生共价结合导致酶活性降低,进而影响甲基化发生率,并使由于甲基化原因导致沉默的基因重新表达。本研究证实5′-Aza-CdR可以部分逆转miR-200b启动子区的甲基化状态,从而使由于异常甲基化作用导致的低表达状态发生上调,进而降低胃癌MGC-803细胞的恶性侵袭与增殖性。
3.3 EMT的发生受miR-200b表达量的影响 EMT被认为是转移性肿瘤形成的最早的步骤[9],同时也是组织重新塑造的关键因素。EMT的特点是:代表上皮标志的指标(如E-cadherin)消失,而代表间充质标志的指标(如N-cadherin、ZEB1、Slug)上调[10]。研究表明,miR-200a的抑癌作用主要是通过抑制正常EMT,其具体机制是通过作用于其靶点ZEB1/ZEB2,降低对E-cadherin的抑制作用,促进E-cadherin高表达[11]。本研究证实,受不同程度甲基化影响的miR-200b表达量也可以影响EMT相关蛋白的表达。
本研究表明,miR-200b启动子区高度甲基化状态是导致其低表达的主要原因,而在DNA甲基转移酶抑制剂的作用下,可使低表达量的miR-200b发生上调。对于在胃癌细胞MGC-803中充当抑癌基因的miR-200b来说,其甲基化状态的不同会直接影响其表达量,进而间接影响其抑癌作用,导致MGC-803的恶性增殖和侵袭性发生改变,并影响EMT相关蛋白的表达。因此,基因异常甲基化的相关研究在肿瘤的发生、发展、预防及治疗方面具有重要意义。
[1]Li Y,Geng P,Jiang W,et al.Enhancement of radiosensitivity by 5-Aza-CdR through activation of G2/M checkpoint response and apoptosis in osteosarcoma cells[J].Tumour Biol,2014,35(5):4831-4839.doi:10.1007/s13277-014-1634-5.
[2]Askari M,Sobti RC,Nikbakht M,et al.Aberrant promoter hyper⁃methylation of p21(WAF1/CIP1)gene and its impact on expressionand role of polymorphism in the risk of breast cancer[J].Mol Cell Biochem,2013,382(1-2):19-26.doi:10.1007/s11010-013-1696-5.
[3]Dinq W,Dang H,You H,et al.miR-200b restoration and DNA methyltransferase inhibitor block lung metastasis of mesenchymal phenotype hepatocellular carcinoma[J].Oncogenesis,2012,1:e15.doi:10.1038/oncsis.2012.15.
[4]Diaz-Lopez A,Moreno-Bueno G,Cano A.Role of microRNA in epi⁃thelial to mesenchymal transition and metastasis and clinical per⁃spectives[J].Cancer Manag Res,2014,6:205-216.doi:10.2147/CMAR.S38156.eCollection 2014.
[5]Yu L,Yang Y S.Research advances of microRNAs in digestive tract diseases[J].Med J Chin PLA,2013,38(12):1026-1031.[于兰,杨云生.MicroRNAs在消化道疾病中的作用研究进展[J].解放军医学杂 志,2013,38(12):1026-1031].doi: 10.11855/j.issn.0577-7402.2013.12.17.
[6]Besaratinia A,Tommasi S.Epigenetics of human melanoma:prom⁃ises and challenges[J].J Mol Cell Biol,2014,6(5):356-367.doi: 10.1093/jmcb/mju027.
[7]Goldberg AD,Allis CD,Bernstein E.Epigenetics:a landscape takes shape[J].Cell,2007,128(4):635-638.
[8]Zhang LL,Wu JX.DNA methylation:an epigenetic mechanism for tumorigenesis[J].Hereditas(Beijing),2006,28(7):880-885.[张丽丽,吴建新.DNA甲基化—肿瘤产生的一种表观遗传学机制[J].遗传,2006,28(7):880-885].
[9]Lu Y,Lu J,Lu X,et al.MiR-200a inhibits epithelial-mesenchymal transition of pancreatic cancer stem cell[J].BMC Cancer,2014,14: 85.doi:10.1186/1471-2407-14-85.
[10]Guo F,Cogdell D,Hu L,et al.MiR-101 suppresses the epithelialto-mesenchymal transition by targeting ZEB1 and ZEB2 in ovarian carcinoma[J].Oncol Rep,2014,31(5):2021-2028.doi:10.3892/ or.2014.3106.
[11]Cong NN,Du P,Zhang AL,et al.Down regulated microRNA-200a promotes EMT and tumor growth through the wnt/beta-catenin path⁃way by targeting the E-cadherin repressors ZEB1/ZEB2 in gastric adenocarcinoma[J].Oncol Rep,2013,29(4):1579-1587.doi: 10.3892/or.2013.2267.
(2014-11-12收稿 2015-01-21修回)
(本文编辑 李鹏)
Methylation of miR-200b and its effects on proliferation,invasion of gastric cancer cell line MGC-803
GUO Rong,NING Xianghong,JIANG Kui,ZHANG Qingyu△
Department of Gastroenterology,Tianjin Medical University General Hospital,Tianjin 300052,China
△Corresponding Author E-mail:zhangqy@tijmu.edu.cn
Objective To investigate the effect of expression level and methylation level of miR-200b on proliferation,invasion and apoptosis of gastric cancer cell line MGC-803 in vitro.Methods Normal human gastric epithelium cell line GES-1,and gastric cancer cell line MGC-803 cells were cultured and harvested to extract total RNA.Then miR-200b ex⁃pression level was examined via q-PCR;Methylation in promoter of miR-200b was revealed by Bisulphite PCR.MGC-803 cells were treated with different concentrations of 5′-Aza-CdR to test its effect on miR-200b expression and methylation of its promotor.The effect of its treatment at 10 μmol/L for 72 h on invasion,proliferation and apoptosis of both cell lines were detected by Transwell assay,Flow cytometry and apoptosis assay respectively.The gene related to EMT(epithelial-mesen⁃chymal transition)such as E-cadherin,N-cadherin,ZEB1,Slug were checked by Western blot.Results The expression of miR-200b in GES-1 is higher than that in MGC-803(P=0.022).The methylation level in promoter region of miR-200b in GES-1 is lower than that in MGC-803(P=0.034).After treated with 5′-Aza-CdR,the expression of miR-200b in MGC-803 cell was up-regulated in a timely dependent manner.On the contrary,the methylation in promoter of mirR-200b were down-regulated when 5′-Aza-CdR were added at 10 μmol/L(P=0.043).What's more,5′-Aza-CdR administration increas⁃es cell apoptosis especially in aged cells and delays cell cycle at G0/G1which in turn decrease ratio of cells in S phages.5′-Aza-CdR treatment also decreased invasiveness and induced expression of E-cadherin,as well as down regulated the ex⁃pressions of N-cadhrin,ZEB1,Slug and MMP9 in MGC-803 cells.Conclusion Expression of miR-200b could be affected by methylation of promoter of miR-200b and in turn regulate proliferation and invasion of gastric cells in vitro.
stomach neoplasms;adenocarcinoma;cell apoptosis;cell proliferation;DNA methylation;microRNA-200b
R735.2,R349.6
A
10.11958/j.issn.0253-9896.2015.04.002
国家自然科学基金资助项目(81172356);天津市自然科学基金重点项目(10JCZDJC18500)
天津医科大学总医院消化内科(邮编300052)
郭蓉(1987),女,硕士在读,主要从事胃癌发病机制研究
△E-mail:zhangqy@tijmu.edu.cn
