青蒿琥酯对糖尿病肾病大鼠肾组织Toll样受体4及白细胞介素-8表达的影响
2015-08-24聂寒苏珂龙艳蒋姗姗孙清
聂寒,苏珂,龙艳,蒋姗姗,孙清
青蒿琥酯对糖尿病肾病大鼠肾组织Toll样受体4及白细胞介素-8表达的影响
聂寒,苏珂△,龙艳△,蒋姗姗,孙清
目的 观察青蒿琥酯对糖尿病肾病(DN)大鼠模型肾组织Toll样受体(TLR)4、白细胞介素(IL)-8表达的影响。方法 健康雄性SD大鼠(体质量>200 g)采用高糖高脂联合腹腔注射30 mg/kg链脲佐菌素(STZ)法建立糖尿病肾病模型。将32只造模成功大鼠随机分为B、C、D、E组,另择8只健康雄性SD大鼠(体质量≤200 g)为A组,A、B组给予10 mg/(kg·d)生理盐水;C、D组分别给予30 mg/(kg·d)、10 mg/(kg·d)青蒿琥酯;E组给予10 mg/(kg·d)依那普利。灌胃给药12周后,观察大鼠24 h尿蛋白定量、血肌酐(Cr)、尿素氮(BUN)、空腹血糖、体质量、肾脏肥大指数(KI)的变化;Western blot法检测肾组织TLR4蛋白的表达;ELISA法检测血清及肾组织IL-8的水平。结果 B、C、D、E组空腹血糖、KI均明显高于A组,体质量明显低于A组;B、C、D、E组24 h尿蛋白、Cr、BUN、肾组织TLR4蛋白表达、血清及肾组织IL-8水平均高于A组,C、D、E组均低于B组,D组高于C组和E组(均P<0.05)。TLR4蛋白与血清IL-8(r=0.969)、肾组织IL-8(r=0.972)、Cr(r=0.944)、BUN(r=0.903)、24 h尿蛋白(r=0.965)均呈正相关(均P<0.05),肾组织IL-8与Cr(r=0.929)、BUN(r=0.940)、24 h尿蛋白(r=0.962)均呈正相关(均P<0.05)。结论 青蒿琥酯可能通过下调肾组织TLR4蛋白的表达,减少炎性因子IL-8的释放,减轻DN的炎症反应,一定程度上缓解DN的发展。
青蒿素;糖尿病肾病;Toll样受体4;白细胞介素8;炎症反应;青蒿琥酯
糖尿病肾病(DN)作为糖尿病的全身微血管并发症之一,具有较高的致死、致残率,其发病机制复杂多样。近年有许多学者提出机体内持续性慢性低度炎症状态参与DN[1],其可能机制之一免疫炎症反应已得到广泛的认可。作为介导免疫炎症反应关键步骤的Toll样受体(TLR) 4及炎症因子白细胞介素(IL)-8被认为在DN的免疫炎症机制中起着关键性的作用,并随着DN病程进展,其浓度逐渐上升[2]。青蒿琥酯是青蒿素的一种半合成衍生物,具有抗疟、抑制细胞增生、免疫调节、抗血管增生等作用[3],本课题组前期研究发现其还具有免疫炎症抑制作用,可能有助于DN的治疗[4]。有研究显示青蒿琥酯可减少哮喘气道平滑肌[5]、肾间质[6]中TLR4、IL-8的表达,减轻其介导的炎症反应,但有关青蒿琥酯对DN肾组织中TLR4、IL-8表达影响的研究尚少见。本研究旨在通过检测TLR4、IL-8在DN大鼠中的表达,探讨青蒿琥酯对DN炎症损伤的作用,为临床治疗DN提供新的思路及方法。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康6~8周龄雄性SPF级SD大鼠45只,体质量180~220 g,购自湖南斯莱克景达实验动物有限公司。
1.1.2 药品及主要试剂 链脲佐菌素(STZ,美国Sigma公司),青蒿琥酯(桂林南药股份有限公司),马来酸依那普利(扬子江药业集团),大鼠血肌酐(Cr)、尿素氮(BUN)检测试剂盒(南京建成生物工程研究所),大鼠IL-8酶联免疫吸附(ELISA)试剂盒(上海科敏生物有限公司),兔抗大鼠TLR4多克隆抗体(美国Abcam公司),辣根过氧化物酶(HRP)标记山羊抗兔IgG(北京中杉金桥生物技术有限公司),硝酸纤维素膜(美国Amersham公司),ECL发光试剂(Pierce公司)。
1.2 方法
1.2.1 制备模型 大鼠适应性饲养1周,喂养期间每周测量大鼠体质量,1周后按体质量分为正常对照组(A组,≤200 g,n=8)和高糖高脂组(>200 g,n=37)。正常对照组以普通饲料喂养,高糖高脂组大鼠以高糖高脂饲料喂养,饲料配方按照文献[7]的方法。6周后禁食12 h,腹腔注射STZ 30 mg/kg(使用前溶于0.1 mmol/L、pH 4.2~4.5无菌柠檬酸钠缓冲液)复制2型糖尿病模型,以连续3次测随机血糖大于16.7 mmol/L视为2型糖尿病模型成功。符合2型糖尿病模型的大鼠继续喂养4周后,测定尿量大于原尿量50%、尿蛋白排泄率大于30 mg/24 h视为2型糖尿病肾病模型制备成功。3只未成模大鼠于1周后再次注射STZ仍未成模,2只大鼠死亡,余32只大鼠均成模。
1.2.2 分组及给药 将32只成模大鼠采用随机数字表法分为模型对照组(B组)、青蒿琥酯大剂量组(C组)、青蒿琥酯小剂量组(D组)、依那普利组(E组),每组8只。其中C组和D组分别给予30 mg/(kg·d)、10 mg/(kg·d)青蒿琥酯;E组依据临床上常规用量,并通过人与大鼠的体表面积换算给予10 mg/(kg·d)依那普利;A、B组给予10 mg/(kg·d)生理盐水。均灌胃给药12周,实验过程中不用胰岛素。
1.2.3 标本收集 于12周末,用代谢笼收集24 h尿量,并迅速送至我院检验科测定24 h尿蛋白。所有大鼠禁食不禁水12 h后,测量空腹血糖及体质量。腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉后从心脏采血4~5 mL,室温下静置1 h后以3 000 r/min 4℃离心10 min,取上层血清,-80℃冰箱保存。放血处死大鼠后立即剖腹游离出肾脏,取左肾,滤纸吸干血迹后用电子天平称肾湿质量,计算肾脏肥大指数(KI)=肾湿质量/体质量,余肾组织置于冰上剪碎后放至冻存管中,-80℃冰箱保存。
1.2.4 Western blot法测定TLR4蛋白的表达 将取出的组织块称质量后,在液氮中研磨成粉末状加入裂解液使其溶解,4℃12 000 r/min离心15 min,取上清,用Bradford比色法测定总蛋白浓度。蛋白稀释后沸水浴中3 min后上样,经10%的SDS-PAGE电泳1 h后,转膜至硝酸纤维素膜上;5%脱脂奶粉室温下封闭1 h,洗去封存液后加入一抗(兔抗大鼠TLR4多克隆抗体1∶200),4℃孵育过夜;洗膜3次,每次10 min,后加入HRP标记的二抗(1∶2 000),室温下孵育1 h:洗膜3次,每次10 min;后用ECL发光试剂发光,胶片曝光,显影,定影。用图像分析软件进行灰度值测定,以TLR4灰度值与内参β-actin灰度值的比值作为TLR4蛋白表达的相对水平。
1.2.5 ELISA法测定IL-8的水平 严格按照购买的试剂盒说明书进行操作,相同标本设2个复孔,重复2次,在酶标仪上于450 nm波长处测定吸光度(OD)值,根据标准曲线及OD值计算各个标本的浓度。
1.2.6 其他指标 采用苦味酸比色法测定Cr水平,脲酶法测量BUN水平,全自动生化仪检测24 h尿蛋白。
1.3 统计学方法 采用SPSS 16.0软件进行数据分析,计量资料采用±s表示,各组间比较采用单因素方差分析,组间多重比较采用LSD-t法,相关分析行Pearson积差相关,P< 0.05为差异有统计学意义。
2 结果
2.1 各组大鼠空腹血糖、体质量及KI的比较 B、 C、D、E组空腹血糖明显高于A组(P< 0.05),B、C、 D、E组间空腹血糖差异无统计学意义;B、C、D、E组体质量明显低于A组,C、D、E组体质量高于B组(P< 0.05);B、C、D、E组KI高于A组,C、D、E组KI低于B组(P<0.05),见表1。
Tab.1 Comparison of fasting glucose,body weight and Kidney Index among different rat groups表1 各组大鼠空腹血糖、体质量及KI的比较(n=8,±s)
**P<0.01,a与A组比较,b与B组比较,P<0.05
组别A组B组C组D组E组F空腹血糖(mmol/L)4.618±0.859 24.875±0.872a24.754±0.822a25.675±0.964a24.808±0.844a130.719**体质量(g)491.713±12.791 329.725±5.640a362.532±1.743ab347.811±10.416ab331.654±6.781ab891.765**KI(g/kg)3.324±0.219 6.794±0.421a4.837±1.011ab5.971±0.832ab4.611±0.794ab108.473**
2.2 各组大鼠24 h尿蛋白、Cr及BUN的比较 B、C、D、E组24 h尿蛋白、Cr和BUN水平均高于A组,C、D、E组均低于B组,D组高于C组和E组(均P<0.05),E组与C组差异无统计学意义,见表2。
Tab.2 Comparison of twenty-four hours urine protein,serum creatinine and Urea nitrogen of rats in each group at 12 weeks after completion of the experiment表2 实验12周后各组大鼠24 h尿蛋白定量、Cr、BUN水平的比较 (n=8,±s)

Tab.2 Comparison of twenty-four hours urine protein,serum creatinine and Urea nitrogen of rats in each group at 12 weeks after completion of the experiment表2 实验12周后各组大鼠24 h尿蛋白定量、Cr、BUN水平的比较 (n=8,±s)
**P<0.01,a与A组比较,b与B组比较,c与C组比较,d与D组比较,P<0.05;表3同
BUN(mmol/L)9.145±0.521 29.242±0.705a11.602±0.624ab18.807±0.624abc10.591±1.075abd1 280.110**组别A组B组C组D组E组F 24 h尿蛋白(mg)18.141±0.702 68.713±1.433a31.332±4.220ab53.067±3.282abc32.781±3.632abd256.732**Cr(μmol/L)23.451±1.460 63.462±4.401a30.471±1.144ab50.491±0.887abc31.515±0.672abd102.117**
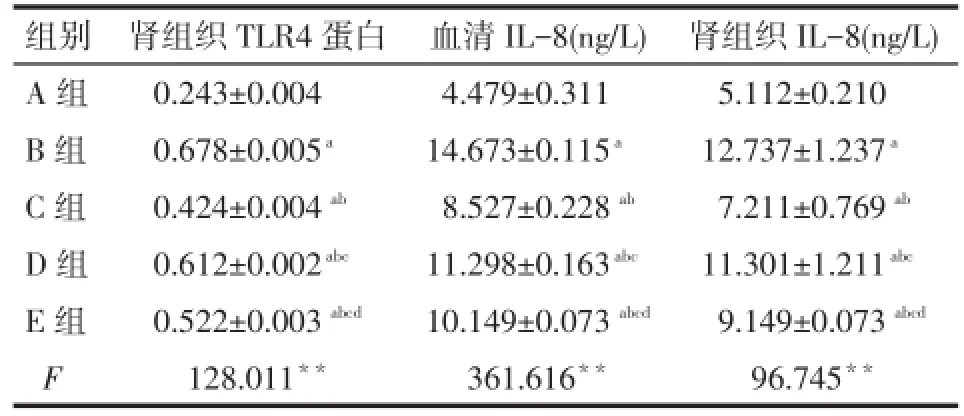
2.3 各组大鼠TLR4蛋白表达及IL-8水平的比较 B、C、D、E组肾组织TLR4蛋白的表达、血清及肾组织IL-8水平均高于A组,C、D、E组均低于B组,D组高于C组和E组,E组高于C组(均P<0.05),见表3、图1。
Tab.3 Comparison expression levels of TLR4 and IL-8 of rats in each group表3 各组大鼠TLR4蛋白、IL-8水平的比较(n=8,±s)
Tab.3 Comparison expression levels of TLR4 and IL-8 of rats in each group表3 各组大鼠TLR4蛋白、IL-8水平的比较(n=8,±s)
组别A组B组C组D组E组F肾组织TLR4蛋白0.243±0.004 0.678±0.005a0.424±0.004ab0.612±0.002abc0.522±0.003abcd128.011**血清IL-8(ng/L)4.479±0.311 14.673±0.115a8.527±0.228ab11.298±0.163abc10.149±0.073abcd361.616**肾组织IL-8(ng/L)5.112±0.210 12.737±1.237a7.211±0.769ab11.301±1.211abc9.149±0.073abcd96.745**
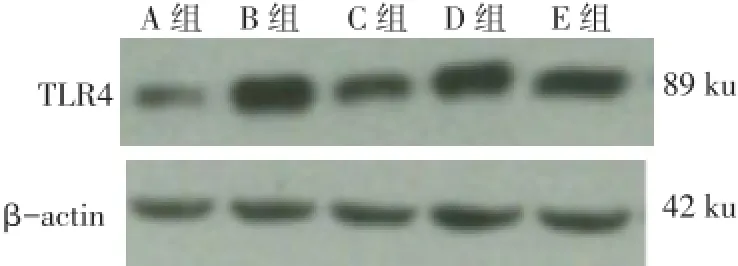
Fig.1 Comparison of TLR4 expression level in the renal tissue of rats图1 各组大鼠肾组织TLR4蛋白表达的比较
2.4 相关性分析 TLR4蛋白与血清 IL-8(r= 0.969)、肾组织IL-8(r=0.972)、Cr(r=0.944)、BUN(r= 0.903)、24 h尿蛋白(r=0.965)均呈正相关(均P<0.05),肾组织IL-8与Cr(r=0.929)、BUN(r=0.940)、24 h尿蛋白(r=0.962)均呈正相关(均P<0.05)。
3 讨论
近些年研究发现,DN除了已熟知的经典的发病机制(血流动力学障碍、糖代谢紊乱、氧化应激、胰岛素抵抗等)外,免疫炎症反应也参与了DN的发生发展[8]。有研究证实糖尿病机体的内环境紊乱状态可以引起肾脏固有细胞的损伤,并释放多种炎症介质引起肾小球硬化及肾间质纤维化[9]。因此笔者推测炎症机制可能单独或与上述经典机制相互作用导致DN的发展恶化。
TLR参与免疫炎症反应的中心环节。TLR 4受体是迄今为止发现最早的TLR亚型之一,是目前被研究最多的Toll样受体,在免疫炎症性疾病中的作用也日渐受到关注[10]。其主要通过MyD88依赖的和非MyD88依赖的信号途径通路引起生物活性作用[11],通路被激活后可以启动其下游各种炎症介质(如IL-8、IL-6、肿瘤坏死因子-α)的合成和释放,从而引起一系列的炎症反应[12]。DN状态下,体内多种细胞因子被损伤活化后触发TLR4介导的获得性免疫反应[13],导致大量的炎症细胞因子产生,引起肾脏炎症反应,加重肾损伤,参与DN的发生发展[14]。吕金雷等[15]发现高糖状态下可以激活TLR4-MyD88信号通路,导致下游炎性因子的增加,提示高糖可能是触发TLR4活化的因素之一,其介导的免疫炎症反应可能与MyD88依赖的信号途径激活有关。本研究也发现2型糖尿病肾病大鼠肾组织TLR4蛋白表达上调,与IL-8、肾脏损害程度的有关指标呈正相关,与上述研究结果相似,进一步说明糖尿病肾脏损害的免疫炎症反应机制与TLR4信号通路的活化有着密切联系,因此阻断TLR4介导的炎症反应对治疗及缓解DN肾脏病变至关重要,但是否通过MyD88依赖的信号途径介导的炎症反应尚待进一步研究。
青蒿琥酯是具有过氧桥的倍半萜类化合物[16]。最新研究表明青蒿琥酯除具有传统意义上的生物活性外还具有免疫炎症抑制作用。本研究结果显示,青蒿琥酯各剂量组较模型对照组的肾组织TLR4蛋白表达、血清和肾组织IL-8水平均明显降低,且青蒿琥酯大剂量组较小剂量组效果更明显,肾功能损伤程度减轻,24 h尿蛋白量减少,提示青蒿琥酯可能通过下调TLR4的表达,减少炎症介质IL-8水平,减轻肾脏的炎症反应,同时减少尿蛋白的产生,改善肾功能,从而在一定程度上保护肾脏。另外,本研究中肾组织TLR4蛋白的表达与IL-8、Cr、BUN及24 h尿蛋白量呈正相关,提示TLR4的表达异常与DN的持续性低度炎症状态有关,同时也发现肾组织IL-8水平与Cr、BUN及24 h尿蛋白量呈正相关,推测IL-8水平有可能成为判断肾功能损害程度的一个指标,进一步验证上述结论。同时发现青蒿琥酯各剂量组间空腹血糖无明显差异,提示青蒿琥酯对肾脏的保护机制可能独立于血糖的作用。青蒿琥酯大剂量组与依那普利组相比各种肾功能损害指标无明显差异,推测30 mg/(kg·d)青蒿琥酯可能与10 mg/(kg·d)依那普利在保护肾功能方面的疗效相似。
综上所述,青蒿琥酯可能通过下调肾组织TLR4的表达,减少炎症因子IL-8的释放,减少蛋白尿,改善肾功能,从而对肾脏病变程度的恶化起到一定程度的缓解作用,但具体机制尚需进一步研究。
[1]Huang L,Liao TT,Gong J,et al.The influence of bailing capsule on microinflammatory state in diabetic nephropathy with chronic renal failure[J].China Modern Med J,2014,21(15):72-74.[黄龙,廖婷婷,龚俊,等.百令胶囊对糖尿病肾病慢性肾衰竭微炎症状态的影响[J].中国当代医药,2014,21(15):72-74].
[2]Yang M,Gan H,Shen Q,et al.Proinflammatory CD14+CD16+mono⁃cytes are associated with microinflammation in patients with type 2 diabetes mellitus and diabetic nephropathy uremia[J].Inflamma⁃tion,2012,35(1):388-396.doi:10.1007/s10753-011-9374-9.
[3]Liu L,Zuo LF,Wang J.Effects of artesunate on membrane potential of mitochondria and cell apoptosis of Ec9706 cells[J].Med J Chin PLA,2014,39(1):25-29.[刘亮,左连富,王静.青蒿琥酯对食管癌Ec9706细胞线粒体膜电位及凋亡的影响[J].解放军医学杂志,2014,39(1):25-29].
[4]Jiang SS,Long Y,Su K,et al.Effects of artesunate on high glucoseinduced cell apoptosis,TNF-α and IL-8 expression in renal tubu⁃lar epithelial cells[J].Tianjin Med J,2015,43(1):20-24.[蒋姗姗,龙艳,苏珂,等.青蒿琥酯对高糖诱导的肾小管上皮细胞凋亡及TNF-α、IL-8表达的影响[J].天津医药,2015,43(1):20-24].
[5]Huang FJ,Zhang GJ,Zhang H.Effects of artesunate on the expression level of TLR4 and TGF-βwith asthma rats[J].Chin Med Biotechnol,2011,6(4):266-269.[黄发军,詹光杰,张宏.青蒿琥酯对哮喘大鼠肺组织TLR4及TGF-β表达的影响[J].中国医药生物技术,2011,6(4):266-269].doi:10.3969/cmba,j.issn.1673-713x.2011.04.006.
[6]Ma XY,Wu WH,Zeng Y,et al.The anti-inflammatory effect and its mechanism of artemisia on the renal of UUO rats[J].Chongqing Med,2010,39(12):1514-1516.[马行一,昊蔚桦,曾燕,等.青蒿琥酯对UUO模型大鼠肾脏的抗炎作用及其机制研究[J].重庆医学,2010,39(12):1514-1516].doi:10.3969/j.issn.1671-8348.2010.12.013.
[7]Fan YF,Xu RX,Xiang JJ,et al.Study of the method used to induce the model of type 2 diabetic mellitus rat and the characteristic of the nephropathy[J].Journal of Chinese Physician,2012,14(1):16-19.[范岩峰,许榕仙,向建军,等.2型糖尿病肾病大鼠模型的建立及肾病特点[J].中国医师杂志,2012,14(1):16-19].doi:10.3760/cma.j.issn.1008-1372.2012.01.006.
[8]Nelson KF,Tsung WC,Hwai LL,et al.Negative regulatory resposes to metabolliccaly triggered inflammtion impair renal epithelial immu⁃nity in diabetes mellitus[J].J Mol Med,2013,91(12):587-598.doi: 10.1007/s00109-012-0969-x.
[9]Ma J,Wu H,Zhao CY,et al.Requirement for TLR2 in the develop⁃ment of albuminuria,inflammation and fibrosis in experimental dia⁃betic nephropathy[J].Int J Clin Exp Pathol,2014,7(2):481-495.
[10]Zhang XD,Fang JA,Li XX,et al.Effect of Yishen capsule on thbuloin⁃terstitial expression of TLR and NF-κB in experimental diabetic ne⁃phropathy[J].Chin J Kidney Dis Invest(Electronic Editor),2013,2 (4):28-31.[张晓东,方敬爱,李秀秀,等.益盛胶囊对糖尿病肾病模型肾小管间质TLR4及NF-κB表达的研究[J].中华肾病研究,2013,2(4):28-31].doi:10.3877/cma.j.issn.2095-3216.04.007.
[11]Liu P,Li F,Qiu M,et al.Expression and cellular distribution of TLR4,MyD88,and NF-κB in diabetic renal tubulointerstitial fibro⁃sis,in vitro and in vivo[J].Diabetes Res Clini Pract,2014,10(10):1016-1024.doi:10.1016/j.diabres.2014.04.020.
[12]Wang ZG,Wei M,Wang M,et al.Inhibition of macrophage inhibito⁃ry factor reduces diabetic nephrpathyin typeⅡdiabetes in mice[J].Inflammation,2014,37(6):2020-2029.doi:10.1007/s10753-014-9934-x.
[13]Yang MX,Gang H,Shen Q.Effect of LPS on the level of TLR4 and on theexpression of NF-κB,Notch1 in monocytes from patients with type 2 diabetic nephropathy[J].J Cent South Univ(Med sci),2012,37(6):578-585.[杨孟雪,甘华,沈清.脂多糖对2型糖尿病肾病患者单核细胞TLR4水平及NF-κB,Notch1表达的影响[J].中南大学学报(医学版),2012,37(6):578-585].doi:10.3969/j.jssn.1672-7347.2012.06.007.
[14]Lorenz G,Darisipudi MN,Anders HJ.Canonical and non-canonical effects of the NLRP3 inflammasome in kidney inflammation and fi⁃brosis[J].Nephrology Dialysis Transplantation,2014,29(1):41-48.doi:10.1093/ndt/gft332.
[15]Lyu JL,Xu JH,Fu ZH,et al.Angiotensin II up⁃regulates the release of inflammation factors via Toll⁃like receptor 4 signal in rat mesan⁃gial cells under high glucose[J].Chin J Nephrol,2013,29(12):908-913.[吕金雷,徐金华,付志晖,等.血管紧张素Ⅱ正向调节高糖环境下大鼠肾小球系膜细胞TLR4信号及炎性因子的表达[J].中华肾脏病杂志,2013,29(12):908-913].doi:10.3760/cma.j.issn.1001⁃7097.2013.12.007.
[16]Nzila A,Al-Zahrani I.Drugs for the treatment of malaria in the Kingdom of Saudi Arabia[J].Saudi Med J,2013,34(6):569-578.
(2014-06-11收稿 2014-12-19修回)
(本文编辑 陈丽洁)
Effect of artesunate on expressions of Toll-like receptor 4 and interleukin-8 in renal tissues of diabetic nephropathy rats
NIE Han,SU Ke△,LONG Yan△,JIANG Shanshan,SUN Qing
Department of endcrinology,Affiliated Hospital of Guilin Medical College,Guilin 541001,China
△Corresponding Author E-mail:su13978316336@163.com,ly136988@163.com
Objective To investigate effect of artesunate on expressions of Toll-like receotor-4(TLR4)and interleu⁃kin-8(IL-8)in renal tissue of diabetic nephropathy rats.Methods Male SD rats of over 200 g in body weight(n=45)were injected with low dosage streptozotocin and fed with high fat and sucrose diets to establish diabetes nephropathy(DN)model.Among all rats of successful model,thirty-two were randomly selected and divided into four groups(n=8 in each group),Mod⁃el group(Group B),Artesunate at high dose treatment group[30 mg/(kg·d)](Group C),Artesunate at low dose treatment group[10 mg/(kg·d)](Group D),Enalapril treatment group[10 mg/(kg·d)](Group E).Another eight rats without STZ injec⁃tion whose body weight is under 200 g were assigned as Normal group(Group A).Then,rats in Group A and B were given the same volume of normal saline[10 mg/(kg·d)]while rats in Group C,D and E were given 30 mg/(kg·d)Artesunate,10 mg/(kg·d)Artesunate and 10 mg/(kg·d)Enalapril respectively intragastrically for consecutive 12 weeks.Fasting blood glucose,body weight,kidney index,24-hours proteinuria,serum creatinine(Cr)and blood urea nitrogen(BUN)were measured.Expression level of TLR4 in renal tissue of rats were examined by Western blot;ELISA was used to quantify the concentration of IL-8 in serum and renal tissue of rats.Results Compared with rats in Group A,the levels of Fasting blood glucose,kidney index,24-hours proteinuria,Cr and BUN as well as the level of TLR4 in kidney,levels of IL-8 in serum and kidney all significant⁃ly increased in rats in Group B,C,D and E(P<0.05).On the other hand,body weight were decreased in rats of Group B,C,D and E compared to rats in Group A(P<0.05).The level of TLR4 in kidney,levels of IL-8 in serum and kidney,24-hours proteinuria,Cr and BUN in rats of Group C,D and E were significantly lower than those in rats of Group B(P<0.05).Furthermore,compared with rats in Group D,the levels of TLR4 in kidney,IL-8 in serum and kidney,24-hours proteinuria,Cr and BUN were decreased in rats in Group C and E(P<0.05).Pearson correlation analysis showed that the expression lev⁃el of TLR4 positively correlated with IL-8 level in serum(r=0.969,P<0.05),IL-8 level in kidney(r=0.972,P<0.05),24-hours proteinuria(r=0.965,P<0.05),Cr(r=0.944,P<0.05)and BUN(r=0.903,P<0.05).IL-8 level in kidney positively correlated with 24-hours proteinuria(r=0.962,P<0.05),Cr(r=0.929,P<0.05)and BUN(r=0.940,P<0.05).Conclu⁃sion Artesunate decreases expression of TLR4 and IL-8,reduce 24-hours proteinuria,inhibits the inflammation of the DN,relives the pathological lesions of nephron rats with diabetic nephropathy.
ARTEMISININ;diabetic nephropathies;Toll-like receptor 4;interleukin-8;inflammatory reaction;ARTE⁃SUNATE
R587.1
A
10.11958/j.issn.0253-9896.2015.04.006
广西医疗卫生适宜技术研究与开发项目(S201316-07);广西自然科学基金项目(2012GXNSFAA053085)
桂林医学院附属医院内分泌科(邮编541001)
聂寒(1987),女,硕士在读,主要从事糖尿病及慢性并发症的诊治研究
△E-mail:su13978316336@163.com,ly136988@163.com
