肥胖SD幼鼠脂肪组织血红素加氧酶-1表达与炎症状态和抗炎机制的探讨
2015-08-24刘婷婷刘戈力赵菁何娟鲍鹏丽丁晓明
刘婷婷,刘戈力△,赵菁,何娟,鲍鹏丽,丁晓明
肥胖SD幼鼠脂肪组织血红素加氧酶-1表达与炎症状态和抗炎机制的探讨
刘婷婷1,刘戈力1△,赵菁1,何娟1,鲍鹏丽1,丁晓明2
目的 探讨肥胖SD幼鼠内脏脂肪组织中血红素加氧酶(HO)-1表达的变化及其与脂肪组织巨噬细胞浸润、极化间的关系。方法 3周龄雄性SD大鼠24只,随机均分为对照组和实验组,分别给予标准饮食和高脂饮食,喂养至7周龄,检测三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、空腹血糖及胰岛素水平,定量PCR检测肾周脂肪组织中HO-1、白介素(IL)-6、IL-10、单核细胞趋化蛋白(MCP)-1基因表达变化,F4/80、CD206免疫组化观察脂肪组织中巨噬细胞浸润和极化情况。结果 实验组幼鼠已经存在空腹血糖和胰岛素升高,胰岛素抵抗情况明显,HO-1表达明显高于对照组,炎症因子IL-6、MCP-1基因表达明显高于对照组,抗炎症因子IL-10低于对照组,差异有统计学意义(P<0.05)。实验组巨噬细胞浸润明显多于对照组(P<0.05),实验组F4/80免疫组化平均光密度(MOD)值与CD206免疫组化MOD值差异无统计学意义(P>0.05)。结论 肥胖幼年SD大鼠的内脏脂肪组织出现炎症反应,伴有HO-1反应性的增加,后者影响巨噬细胞极化起到抗炎作用。
血红素氧化酶(脱环);脂肪组织;巨噬细胞;肥胖症;大鼠,Sprague-Dawley
近年来,肥胖已成为危害儿童健康的一个重要问题,血红素加氧酶(heme oxygenase,HO)-1作为肥胖研究领域中病生理机制关注的热点,日益引起学者的重视。全身诱导的HO-1表达增加对成年小鼠营养性肥胖有明显抗炎性保护作用[1],但目前关于单纯性肥胖的幼年个体体内HO-1表达、炎症状态和抗炎机制研究的报道甚少。鉴于幼年和成年肥胖在起因、进程和结果上都存在差异[2],探讨幼年肥胖个体中HO-1表达与内脏脂肪组织中巨噬细胞浸润和极化之间的关系具有重要意义。
1 材料与方法
1.1 材料 3周龄雄性清洁级SD幼鼠24只,购自中国医学科学院放射医学研究所实验动物中心。CFX-96型PCR仪(美国BioRad公司),高脂肪普通饲料(美国Research Diets公司),多聚甲醛(纯度>94%,美国Sigma公司),Trizol、MMLV(美国Invitrogen公司),F4/80、CD206的一抗以及链霉亲和素-生物素复合物(SABC)免疫组化二抗试剂盒(武汉博士德公司)。
1.2 动物模型建立 将24只3周龄雄性幼鼠按照随机数字表法分成2组,每组12只,对照组给予普通饮食,实验组给予高脂饮食。实验期间,小鼠可自由饮水和摄食,饲养环境温度18~22℃,湿度40%~50%,喂养至7周龄,处死后取肾周脂肪组织备用。
1.3 血生化指标测定 实验4周末,禁食12 h后取尾静脉血采用免疫比浊法检测三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、空腹血糖(FPG)及空腹胰岛素水平(FINS),计算胰岛素抵抗指数(HOMA-IR)=FPG×FINS/22.5。
1.4 脂肪组织中各基因表达水平测定 利用定量PCR测定2组SD幼鼠HO-1、白介素(IL)-6、IL-10、单核细胞趋化蛋白(MCP-1)的基因表达水平的差异。称取100 mg新鲜肾周脂肪组织,经Trizol处理,提取总mRNA,根据所选择基因的相关信息,设计对应的引物序列。内参GAPDH:上游5′-GACTGATGTTGTTGACAGCCACTGC-3′,下游 5′-TAGC⁃CACTCCTTCTGTGACTCTAAC-3′,产物153 bp;HO-1:上游5′-CACCTTCCCGAGCATC-3′,下游5′-AGCCTCTTCTGT⁃CACCCT-3′,产物 109 bp;IL-6:上游 5′-TTGCCTTCTT⁃GGGACTGATG-3′,下游5′-ACTGGTCTGTTGTGGGTGGT-3′,产物100 bp;IL-10:上游5′-CAGTCAGCCAGACCCA⁃CAT-3′,下游5′-GGCAACCCAAGTAACCCT-3′,产物大小142 bp;MCP-1:上游5′-TTCCTCCACCACTATGC-3′,下游5′-GCATCAAAGGTGGAAGAATGG-3′,产物201 bp。运用Promega MMLV逆转录酶及相关试剂进行逆转录反应。PCR扩增条件:反应体系20 μL,其中cDNA 1 μL,引物上下游各0.5 μL,SYBRgreenSupermix 10 μL,水8 μL。取0.5 μL RT产物放入PCR仪,PCR扩增条件:94℃,4 min;94℃,30 s;56℃,60 s;72℃,40 s;40个循环。用LightCycler Software Ver 4.0软件分析目的基因的相对表达水平。
1.5 组织学分析 将取出的脂肪组织立即放入4%多聚甲醛,固定12 h,石蜡包埋切片,厚5 μm,常规HE染色,无水乙醇分化及脱水,二甲苯透明,封片,镜下观察2组脂肪组织中巨噬细胞浸润。
1.6 免疫组化分析 石蜡切片常规脱蜡复水后,按照SABC免疫组化试剂盒步骤进行,经DAB显色后,封片,观察巨噬细胞特异性标志物F4/80以及M2型巨噬细胞特异性标志物CD206在2组脂肪组织中的表达,分析脂肪组织中巨噬细胞的浸润以及极化情况。采用Imagepro plus图像分析软件测量每张照片的阳性部位的总面积及总光密度值,计算平均光密度值(MOD)=总光密度值/总面积,棕褐色颗粒为阳性结果。
1.7 统计学方法 应用SPSS 19.0软件进行分析,计量资料均以±s表示,2组间比较采用t检验,P< 0.05为差异有统计学意义。
2 结果
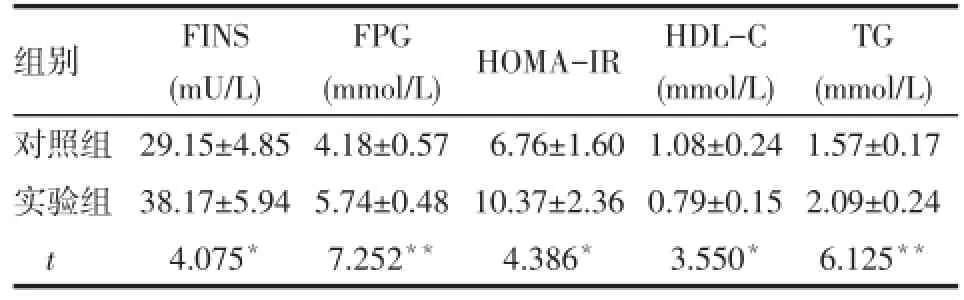
2.1 2组血生化指标比较 实验组FINS、FPG、 HOMA-IR、TG高于对照组,HDL-C低于对照组,差异有统计学意义(P< 0.05或P<0.01),见表1。
Tab.1 Comparisons of sera indicators between two groups表1 2组血清检测指标比较 (n=12,±s)
Tab.1 Comparisons of sera indicators between two groups表1 2组血清检测指标比较 (n=12,±s)
*P<0.05,**P<0.01,表2、3同
组别对照组实验组t FINS (mU/L)29.15±4.85 38.17±5.94 4.075*FPG (mmol/L)4.18±0.57 5.74±0.48 7.252**HOMA-IR 6.76±1.60 10.37±2.36 4.386*HDL-C (mmol/L)1.08±0.24 0.79±0.15 3.550*TG (mmol/L)1.57±0.17 2.09±0.24 6.125**
2.2 2组脂肪组织中HO-1、IL-6、MCP-1及IL-10表达 实验组中HO-1、IL-6和MCP-1表达高于对照组(P<0.05),IL-10表达水平低于对照组(P<0.05),见表2。
Tab.2 Gene expressions in adipose tissues of SD rats in two groups表2 2组SD幼鼠脂肪组织中各基因表达水平比较(n=12,±s)

Tab.2 Gene expressions in adipose tissues of SD rats in two groups表2 2组SD幼鼠脂肪组织中各基因表达水平比较(n=12,±s)
组别对照组实验组t HO-1 4.23±2.82 11.56±3.08 3.511*IL-6 0.56±0.32 2.13±0.81 4.763**MCP-1 2.24±1.07 4.79±0.69 4.006*IL-10 7.47±1.74 3.63±1.11 3.721*
2.3 脂肪组织中巨噬细胞的募集 对照组幼鼠肾周脂肪组织HE染色示脂肪细胞形态正常,大小均一,可见少量炎性细胞浸润,见图1A。实验组的脂肪细胞体积明显增大,大小不等,脂肪细胞膜不完整,胞间可见大量多核细胞浸润,见图1B箭头所示。
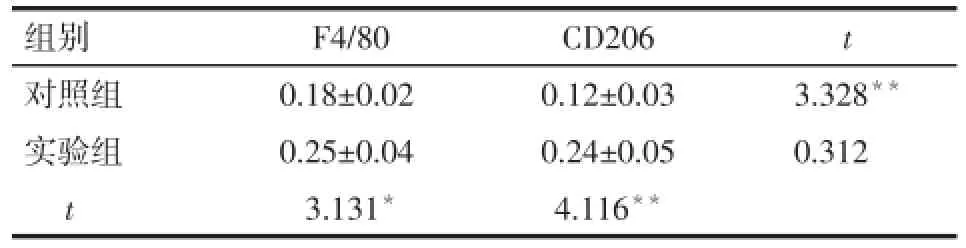
2.4 脂肪组织中巨噬细胞极化的免疫组化染色 实验组脂肪组织F4/80、CD206可见大量散在和片状融合的黄褐色颗粒沉积,明显多于对照组,见图2。实验组F4/80、CD206高于对照组,差异有统计学意义(P<0.05),实验组F4/80与CD206免疫组化MOD值差异无统计学意义(P>0.05),见表3。
Tab.3 Changes of average optical density values of F4/80 and CD206 in immunohistochemical analysis表3 F4/80、CD206的免疫组化图像分析MOD的变化(n=4,±s)
Tab.3 Changes of average optical density values of F4/80 and CD206 in immunohistochemical analysis表3 F4/80、CD206的免疫组化图像分析MOD的变化(n=4,±s)
组别对照组实验组t F4/80 0.18±0.02 0.25±0.04 3.131*CD206 0.12±0.03 0.24±0.05 4.116**t 3.328**0.312
3 讨论
3.1 血脂和糖代谢异常 研究表明单纯性肥胖儿童已有明显的血脂代谢紊乱[3]和糖代谢异常[4],两者均是儿童心血管疾病的独立危险因子。本研究显示,高脂饮食喂养至7周的幼鼠的FINS、FPG、TG以及HOMA-IR明显高于对照组,HDL-C低于对照组,表明幼年肥胖已经导致了血脂和糖代谢异常状态。研究表明,HO-1可以通过增加血浆脂联素水平,改善血脂和血糖情况,缓解肥胖时的代谢情况[5]。脂肪组织中巨噬细胞和其他免疫细胞的累积和肥胖的慢性炎症状态相关,是导致胰岛素抵抗的原因之一[6-7]。采用 HO-1诱导剂钴原卟啉(CoPP)诱导增加HO-1表达,可以改善成年Zucker肥胖大鼠脂肪组织体积,减少脂肪组织的炎症[1]。因此,针对幼年肥胖状态下HO-1的研究,对于探讨如何抑制体内炎症反应,改善胰岛素抵抗和血脂异常情况,从而减少儿童心血管疾病的发生有重要意义。
3.2 HO-1和肥胖炎症状态 肥胖会伴有低度炎症状态,其特征是脂肪细胞肥大,激活的巨噬细胞和其他免疫细胞过度表达促炎症因子[8],这些炎症因子促进巨噬细胞向脂肪组织中迁移,进一步加重局部的炎症状态。HO-1是血红素分解的起始酶和限速酶,它能分解氧化物质血红素最终生成胆红素、一氧化碳和铁,这3种产物具有抗炎、抗氧化、抗血管平滑肌细胞增殖、调节血管张力等功能,对心血管系统起到重要的保护作用。人体中的HO-1可以被多种物质或刺激因素诱导表达,如热休克、重金属、内毒素、血红素、氧化应激、辐射等。在本研究中,实验组HO-1的增加可能与肥胖的炎症和氧化应激状态有关。同时实验组幼鼠体内的炎症因子IL-6、MCP-1较对照组升高,表明幼年肥胖个体已经存在低度炎症反应。抗炎症因子IL-10较对照组降低,考虑是中和炎症因子的反应性降低。
3.3 HO-1和巨噬细胞及巨噬细胞极化 脂肪组织中的巨噬细胞来源于骨髓组织,其前体是单核细胞,是维护内环境稳态的重要细胞。在不同微环境下,巨噬细胞可以发生极化,可分为M1型即经典活化的巨噬细胞(classically activated macrophage)和M2型即替代性活化的巨噬细胞(alternatively activated macrophage)。M1型巨噬细胞产生肿瘤坏死因子(TNF)-α、IL-6等炎症因子,导致胰岛素抵抗,而通常情况下,正常的体内脂肪中的巨噬细胞主要以抗炎型M2为主,肥胖时的缺氧导致脂肪巨噬细胞向M1极化,并进一步导致内脏脂肪组织的炎症[9]。Tiwari等[10]研究发现使用高铁血红素诱导HO-1表达增加后,可以明显促使小鼠心肌巨噬细胞向M2型巨噬细胞转变,同时减少炎症因子的产生。Ndi⁃sang等[11]利用高铁血红素诱导小鼠体内HO-1的升高,发现其促炎症因子ED1的表达降低,而M2巨噬细胞标志物,如ED2、CD206、IL-10等明显升高,表明HO-1升高能够影响巨噬细胞极化,促使M1型向M2型转变。本研究发现高脂饮食诱导的实验组脂肪组织中HO-1表达较对照组增加,且巨噬细胞浸润明显增多,实验组F4/80免疫组化MOD值与实验组CD206免疫组化MOD值较对照组无明显差异,表明巨噬细胞多数为M2型。在本研究中,保护性酶HO-1含量增加,但机体仍处在炎症状态的原因可能是,肥胖时巨噬细胞数目增多,炎症状态刺激HO-1表达增加,刺激巨噬细胞向抗炎型转化,发挥抗炎作用。但由于抗炎型和促炎型巨噬细胞数目均增多,来自实验组的脂肪仍相对对照组存在炎性[12]。因此在幼年肥胖的早期,HO-1可能反应性增加,并可能通过促进M1型巨噬细胞向M2型巨噬细胞的极化发挥抗炎作用,是肥胖早期机体对抗炎症反应的一个保护机制。
本实验还发现,肥胖大鼠脂肪组织中浸润的巨噬细胞多集中在脂肪组织中的血管间质周围,是否也存在对血管内皮的影响及其导致血流动力学改变有待进一步研究。
综上所述,幼年单纯性肥胖已经存在血脂和糖代谢异常,胰岛素抵抗及炎症状态等代谢紊乱情况,成为心血管疾病的危险因素。在肥胖早期,肥胖状态刺激体内HO-1表达增加,并通过影响巨噬细胞极化起到抗炎作用。HO-1对巨噬细胞极化和浸润的作用,将作为改善儿童期肥胖的一个新的靶点而逐步受到重视。
(图1、2见插页)
[1]Nicolai A,Li M,Kim DH,et al.Heme oxygenase-1 induction re⁃models adipose tissue and improves insulin sensitivity in obesity-in⁃duced diabetic rats[J].Hypertension,2009,53(3):508-515.doi: 10.1161/HYPERTENSIONAHA.108.124701.
[2]Massiera F,Barbry P,Guesnet P,et al.A Western-like fat diet is sufficient to induce a gradual enhancement in fat mass over genera⁃tions[J].J Lipid Res,2010,51(8):2352-2361.doi:10.1194/jlr.M006866.
[3]Bao PL,Liu GL,Yang JY,et al.The relationgship between abdomi⁃nal fat and cardiometabolic risk factors among children[J].Journal of Tianjin Medical University,2010,16(3):509-511.[鲍鹏丽,刘戈力,杨箐岩,等.儿童腹型肥胖与心血管代谢危险因素关系的研究[J].天津医科大学学报,2010,16(3):509-511].doi:10.3969/j.issn.1006-8147.2010.03.041.
[4]Wang YL,Liu GL,Yang JY,et al.Study on the relationship be⁃tween levels of 2 h-PG and changes of islet β cell function and blood lipid in obese children[J].Tianjin Med J,2013,41(2):101-104.[王燕利,刘戈力,杨箐岩,等.肥胖儿童糖负荷后2小时血糖与胰岛β细胞功能和血脂关系的研究[J].天津医药,2013,41 (2):101-104].doi:10.3969/j.issn.0253-9896.2013.02.002.
[5]Cao J,Peterson SJ,Sodhi K,et al.Heme oxygenase gene targeting to adipocytes attenuates adiposity and vascular dysfunction in mice fed a high-fat diet[J].Hypertension,2012,60(2):467-475.doi: 10.1161/HYPERTENSIONAHA.112.193805.
[6]Ndisang JF.Role of heme oxygenase in inflammation,insulin-sig⁃nalling,diabetes and obesity[J].Mediators Inflamm,2010,2010: 359732.doi:10.1155/2010/359732.
[7]Ndisang JF,Lane N,Syed N,et al.Up-regulating the heme oxygen⁃ ase system with hemin improves insulin sensitivity and glucose me⁃tabolism in adult spontaneously hypertensive rats[J].Endocrinology,2010,151(2):549-560.doi:10.1210/en.2009-0471.
[8]Romeo GR,Lee J,Shoelson SE.Metabolic syndrome,insulin resis⁃tance,and roles of inflammation--mechanisms and therapeutic tar⁃gets[J].Arterioscler Thromb Vasc Biol,2012,32(8):1771-1776.doi:10.1161/ATVBAHA.111.241869.
[9]Fujisaka S,Usui I,Ikutani M,et al.Adipose tissue hypoxia induces inflammatory M1 polarity of macrophages in an HIF-1alpha-dependent and HIF-1alpha-independent manner in obese mice[J].Diabetologia,2013,56(6):1403-1412.doi:10.1007/s00125-013-2885-1.
[10]Tiwari S,Mishra M,Jadhav A,et al.The risk of heart failure and cardiometabolic complications in obesity may be masked by an ap⁃parent healthy status of normal blood glucose[J].Oxid Med Cell Lon⁃gev,2013,2013:253657.doi:10.1155/2013/253657.
[11]Ndisang JF,Jadhav A,Mishra M.The heme oxygenase system sup⁃presses perirenal visceral adiposity,abates renal inflammation and ameliorates diabetic nephropathy in Zucker diabetic fatty rats[J].PLoS One,2014,9(1):e87936.doi:10.1371/journal.pone.0087936.
[12]Fjeldborg K,Pedersen SB,Moller HJ,et al.Human adipose tissue macrophages are enhanced but changed to an anti-inflammatory profile in obesity[J].J Immunol Res,2014,2014:309548.doi: 10.1155/2014/309548.
(2014-07-14收稿 2014-11-11修回)
(本文编辑 魏杰)
HO-1 expression in adipose tissue of obese young SD rats and its role in inflammation and anti-inflammatory mechanism
LIU Tingting1,LIU Geli1△,ZHAO Jing1,HE Juan1,BAO Pengli1,DING Xiaoming2
1 Department of Pediatric,Tianjin Medical University General Hospital,Tianjin 300052,China;2 Tianjin Medical University
△Corresponding Author E-mail:liugeli2001@126.com
Objective To investigate the change of HO-1 expression in adipose tissue of obese young SD rats as well as its relationship with macrophage infiltration and polarization.Methods Three-week old SD rats(n=24)were randomly divided into 2 groups,routine diet group(NC)and high fat diet group(FC).After feeding 4 weeks,triglyceride(TG),high den⁃sity lipoprotein(HDL-C),fasting glucose and insulin were compared between these two groups and the insulin resistance in⁃dex was calculated.The gene expressions of HO-1,IL-6,IL-10 and MCP-1 were assessed by quantitative PCR.Infiltration and polarization of macrophages and M2 macrophages in the visceral adipose tissue were examined by immunohistochemis⁃try.Results The levels of FINS,FBG and HOMA-IR in rats of FC group were higher than those of rats in NC group after 4 weeks feeding(P<0.05).The level of HO-1,IL-6,MCP-1 in rats from FC group were significantly higher while level of IL-10 were lower compared with those in rats from NC group after 4 weeks of feeding(P<0.05).In samples from FC groups,more macrophages were detected in adipose tissue by DAB staining than those from NC group.There was no significant dif⁃ference(P>0.05)in MOD value of F4/80 and CD206 between these two groups(P>0.05).Conclusion The infiltration of macrophage in visceral adipose tissue of obese young SD rats significantly increased while HO-1 expression was reactively increased.This insinuated that HO-1 might play an important role in anti-inflammatory mechanism through regulating polar⁃ization of macrophages.
heme oxygenase(decyclizing);adipose tissue;macrophages;obesity;rats,Sprague-Dawley
R725,R892.5
A
10.11958/j.issn.0253-9896.2015.04.009
1天津医科大学总医院儿科(邮编300052);2天津医科大学研究生院
刘婷婷(1987年),女,硕士,主要从事儿科内分泌研究
△E-mail:liugeli2001@126.com
