配合物[C10H9N]2CuBr2的制备、结构分析及其对乙醇氧化羰化反应的催化活性
2015-08-21徐凯王新刘定华刘晓勤孙林兵
徐凯,王新,刘定华,刘晓勤,孙林兵
(南京工业大学化学化工学院,江苏 南京 210009)
引 言
碳酸二乙酯(diethyl carbonate,DEC)是碳酸酯中新型的绿色化工产品,符合现代“清洁生产”要求。由于其良好的反应活性和优良的溶解性能,广泛应用于农药、医药中间体以及高效能锂电池的溶剂等。近来发现DEC 作为汽油和柴油机燃料含氧添加剂,可望取代甲基叔丁基醚(MTBE)[1-2]。合成DEC 的方法主要有光气法、酯交换法、氧化羰基化法[3]。光气法由于其高污染工艺不符合绿色化学安全环保的要求;酯交换法成本高、工艺路线复杂;乙醇氧化羰基化法以廉价丰富的乙醇、一氧化碳为原料,反应具有毒性小、原子经济性高等优点,被誉为最有发展前景的合成方法之一[4]。氯化亚铜(CuCl)[5-6]是这类反应活性较高的催化剂,但在该催化体系中,CuCl 的溶解度较低、Cu(Ⅰ)容易发生歧化反应,使得催化剂寿命短,同时该体系也存在着设备腐蚀严重的问题[7-8]。针对上述不足,研究者们通过添加助剂或配体或通过Br-取代Cl-等方式进行改进。Li 等[9]开发了CuCl/phen/NMI 催化体系,具有良好的催化效果,转化率达到13.6%,选择性大于99%;杨雄等[10]研究了CuBr/DMAP/DMA反应体系的催化活性,转化率达到28.6%。这些催化剂都有一定的防腐蚀作用,稳定性也有一定的提高,但催化剂中Cu+溶解性较差,仍然易失活,且催化剂不是具有确定结构的配合物,不利于研究催化剂及其催化反应本质。
本文采用稳定性较好的CuBr2取代CuCl,以乙醇为溶剂,与4-甲基喹啉配位剂络合反应,制备了铜配合物催化剂,在用现代表征方法初步确定其配合物催化剂分子结构的基础上,将该催化剂应用到乙醇氧化羰基化合成DEC 催化反应中,并采用量子化学密度泛函理论计算[11-15],分析了配合物分子结构性质对催化活性的影响,并考察了反应条件的影响,初步探讨了主副反应催化机理。
1 实验材料和方法
1.1 仪器和试剂
元素分析(EA)采用德国Elementar 仪器公司产的Vario ELAnalyzer 元素分析仪测定。测量模式为CHNS。线性范围:N,0.03~2 mg;C,0.03~7 mg;H,0.03~7 mg。进样范围:2~20 mg。分析精度:标准偏差≤0.1%。
傅里叶红外光谱(FTIR)分析采用美国Thermal Nicolet 公司AVATAR 360 型傅里叶红外光谱仪,波数范围4000~400 cm-1,分辨率4 cm-1,扫描次 数32 s-1,KBr 压片。
X 射线衍射(XRD)采用德国BRUKER 公司的D8 Advance X 射线粉末衍射仪,测定条件:扫描范围为 5°~60°,步长 为 0.02°,扫描速率20(°)·min-1,工作电压40 kV,工作电流100 mA。
铜离子浓度采用美国 Perkin Elmer 公司的Optima 2000 DV 电感耦合等离子体原子发射光谱(ICP-AES)测定。
高压反应釜采用威海新元高压釜厂的GSHA-1型100 ml 高压反应釜;气相色谱-质谱联用仪:日本岛津公司生产的GCMS-2010 气相色谱-质谱联用仪。液相产物采用山东鲁南SP-6890 气相色谱仪进行分析。
试剂:乙醇、溴化铜、碳酸乙烯酯、溴化铜、喹啉、异喹啉、2-甲基喹啉、4-甲基喹啉均为分析纯,Aladdin;吡啶为分析纯,国药集团化学试剂有限公司;氧气(99.9%)、氮气(99.5%)、氢气(99.9%),南京三乐气体有限公司;一氧化碳(99.9%),南京瑞尔特种气体有限公司。
1.2 铜配合物的制备
分别称取0.2234 g(1 mmol)CuBr2和0.1432 g(1 mmol)、0.2864 g(2 mmol)、0.5728 g(4 mmol)4-甲基喹啉,通入氮气密闭保护,共同溶于乙醇溶液中,在60℃下搅拌回流2 h 左右,冷却至室温,抽滤,在60℃下真空干燥,制得浅绿色粉末状铜配合物催化剂0.1898、0.3982、0.4068 g,对应样品编号为1-1、1-2 和1-4。
合气道是一种利用攻击者动能、操控能量、偏向于技巧性控制的防御反击性武术。这种“以退为进”的武术很好的被哈佛导师、应用到沟通难题的处理上,它的精妙之处在于更多的关注认知,不询问、不责备,以非攻击性语言化解冲突、解决问题,这里笔者以小月的亲身经历为反面教材,带大家认识掌握这门技巧对于沟通难题处理上的重要性。
1.3 密度泛函理论计算
采用量子化学DFT/B3LYP 方法计算,并采用6-311++G**基组(C、H、O 和Br)和LanL2DZ(Cu)基组,对铜配合物[C10H9N]2CuBr2的初始构型进行完全开放的几何构型全优化,同时结合分子结构、自然原子电荷分析和前线轨道分析考察了分子性质,初步探讨了分子的结构与反应机理。全部计算工作采用量子化学软件Gaussian 09W(G09W)。
1.4 其他同类铜配合物的制备与氧化羰化活性评价
选用CuBr2作为活性组分,通过添加易与CuBr2络合反应的含氮配体(统称L)后,形成CuBr2-Lm型铜配合物催化剂,m为配体L 与CuBr2摩尔比。本文以含氮的喹啉类化合物作为配体,考察了喹啉(ql)、异喹啉(iql)、2-甲基喹啉(2-meql)、4-甲基喹啉(4-meql)4 种同类配体催化体系的活性。
催化剂的活性评价是在GSH4-0.1 型高压反应釜中进行。将一定量的乙醇和催化剂加入不锈钢反应釜中,搅拌使其充分混合,CO 一次性加入,O2以连续补充的方式加入反应釜以维持反应压力,用电加热维持反应温度,在搅拌下进行反应。反应完毕后停止通O2,将产物移出,冷却后,对液相产品进行分析。液相分析采用气相色谱仪分析,色谱柱内填充407 有机载体,热导检测器。操作条件:柱温160℃,汽化室温度160℃,检测器温度180℃,桥流90 mA,进样量2 μl。产物分析采用校正因子修正面积归一化法定量。
2 实验结果与讨论
2.1 铜配合物的结构表征
2.1.1 红外表征 图1纯配体中C N 伸缩振动吸收光谱1570~1370 cm-1在铜配合物谱图中波数发生蓝移,因为喹啉环与金属配位后,环的伸缩振动能量改变,并且在配合物谱图中892 cm-1处出现新的吸收峰,归属于Cu N 伸缩振动,这表明配体与铜已经配位成键。不同摩尔比的铜配合物催化剂的红外谱图特征峰基本相同,说明合成的铜配合物中原有机基团没有发生改变。
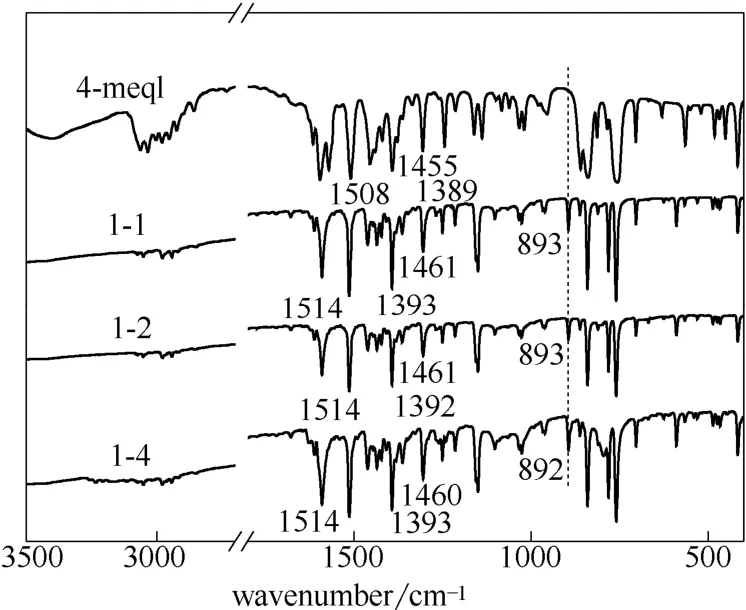
图1 配体、铜配合物催化剂的FTIR 光谱Fig.1 FTIR spectra of ligand and copper complex catalyst
2.1.2 元素分析和电感耦合等离子体原子发射光谱分析 通过改变原料的摩尔比制备了新型含溴铜配合物催化剂,铜配合物的EA 和ICP-AES 分析结果见表1。
从表1分析结果可见,配体与CuBr2的络合反应摩尔比为2:1,根据溴化铜是由[CuBr2]n链组成的结构,可以推测铜配合物的化学式应为[C10H9N]2CuBr2(理论值:C 47.01%,H 3.53%,N 5.50%,Cu 12.47%)。2.1.3 X 射线粉末衍射 图2为CuBr2、铜配合物催化剂的X 射线粉末衍射。CuBr2的两个主要衍射峰出现在14°和29°,合成的配合物的主要衍射峰在9°、17°、19°、22°、23°、33°和40°。配合物催化剂与CuBr2主要衍射峰的相对强度和衍射角具有明显的差异,出现了一些新的衍射峰,原有的峰也都消失,且不同原料摩尔比的催化剂的衍射角和峰强度均基本相同,说明合成的配合物催化剂是同一种物质,具有新的晶体结构。

表1 铜配合物催化剂的EA 和ICP-AES 分析结果Table 1 Analysis data of EA and ICP-AES with copper coordination catalyst
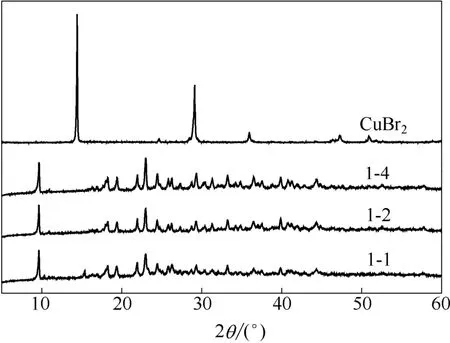
图2 CuBr2 及催化剂的X 射线粉末衍射图Fig.2 X-ray powder diffraction of copper bromide and catalyst
2.2 密度泛函理论计算结果分析
2.2.1 [C10H9N]2CuBr2分子的平衡几何构型和前线轨道分析 分子的平衡几何构型是研究其性质的基础,为了进一步验证通过各种测试推断产物的合理性,计算了[C10H9N]2CuBr2、C10H9N 和[CuBr4]2-的几何结构参数,并对分子结构进行优化,计算结果见表2。图3给出了3 种分子优化几何构型的球-棒模型。

图3 在B3LYP/6—311G**水平计算的[C10H9N]2CuBr2、[CuBr4]2-和C10H9N 的分子优化构型Fig.3 Optimized geometries of [C10H9N]2CuBr2,[CuBr4]2- and C10H9N (with 6-311g** basis set)
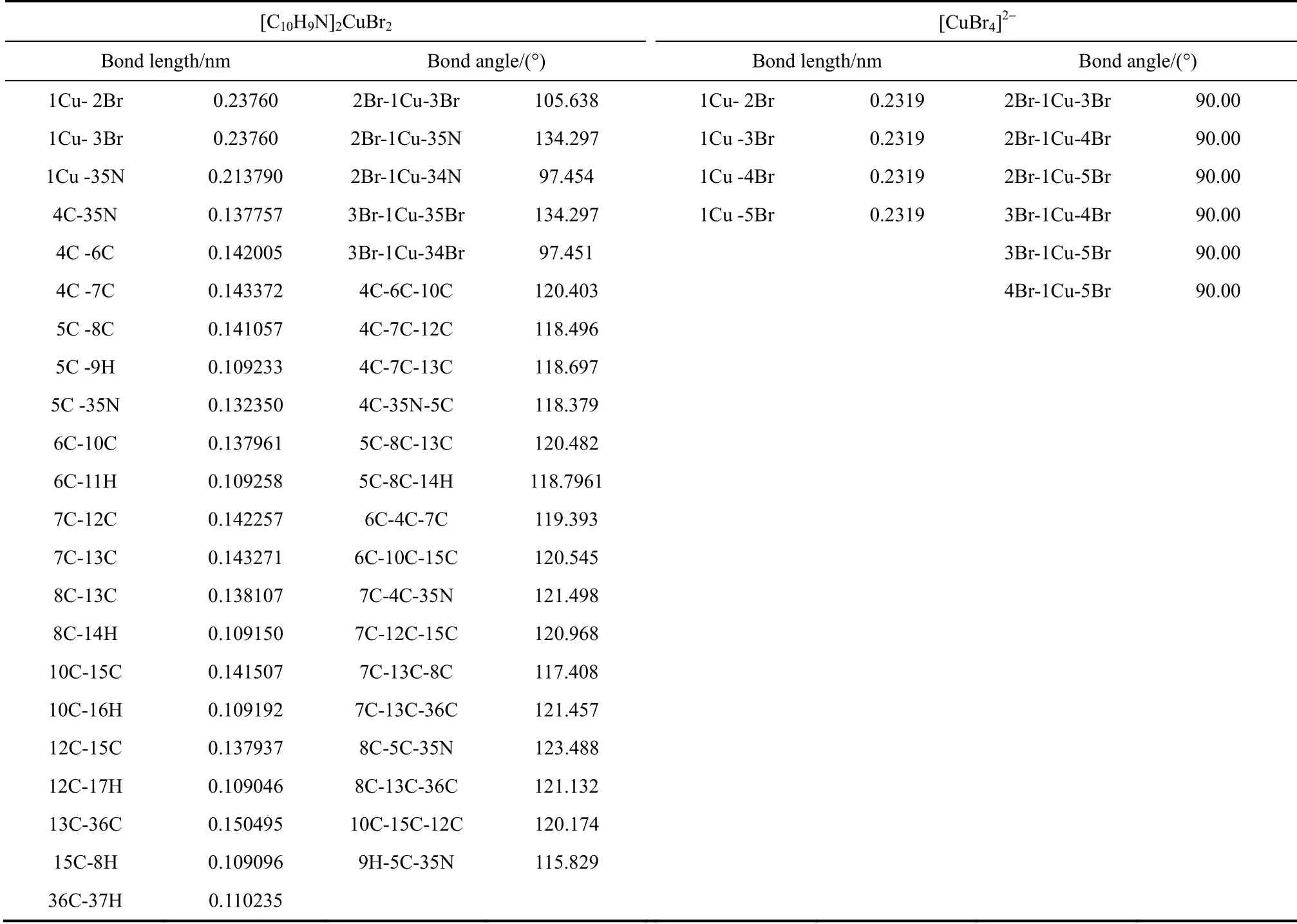
表2 [C10H9N]2CuBr2 和[CuBr4]2-分子构型的主要键长、键角Table 2 Bond lengths and bond angles for [C10H9N]2CuBr2 and [CuBr4]2- (with 6-31g** basis set)

表3 铜配合物分子的前线轨道能级Table 3 Frontier orbital energy levels of copper complex

表4 [C10H9N]2CuBr2、[CuBr4]2-和C10H9N 分子构型的自然原子电荷分布Table 4 Natural atomic charge distribution for [C10H9N]2CuBr2,[CuBr4]2- and C10H9N
2.2.2 自然原子电荷分布 采用自然键轨道(NBO)分析,计算得到了配合物[C10H9N]2CuBr2、[CuBr4]2-和C10H9N 部分原子的原子电荷分布,所得数据见表4。相比于[CuBr4]2-和C10H9N,[C10H9N]2CuBr2中Cu 原子和H 原子正电荷增大,Cu 电荷由0.421增加到0.533,H 电荷有略微的增加,而Br 原子和C 原子负电荷增大,说明电荷存在转移,这是因为配体的加入可以提供合适的空π 键,移走σ 键形成时在Cu 金属离子周围集聚的过量的负电荷。
2.3 铜配合物催化乙醇氧化羰化反应活性
考虑到Cu(Ⅱ)的稳定性及在乙醇的溶解度较好于Cu(Ⅰ),Br-对金属的腐蚀性比Cl-小[16],选用CuBr2作为铜盐,考察了4 种不同喹啉类的配体的催化活性,结果见表5。单纯的CuBr2催化活性很低,仅为0.8%,通过密度泛函理论计算可知,加入喹啉类配体后,[CuBr4]2-中Br 被取代,键长键角改变导致整个分子的对称性变差,稳定性下降,各原子电荷发生改变,使得Cu Br 键结合能改变,更易被活化,进而一定程度上有利于催化活性的提高。不同的配体反应效果也不同,喹啉系配体中心催化效果较好,结果如图5所示。
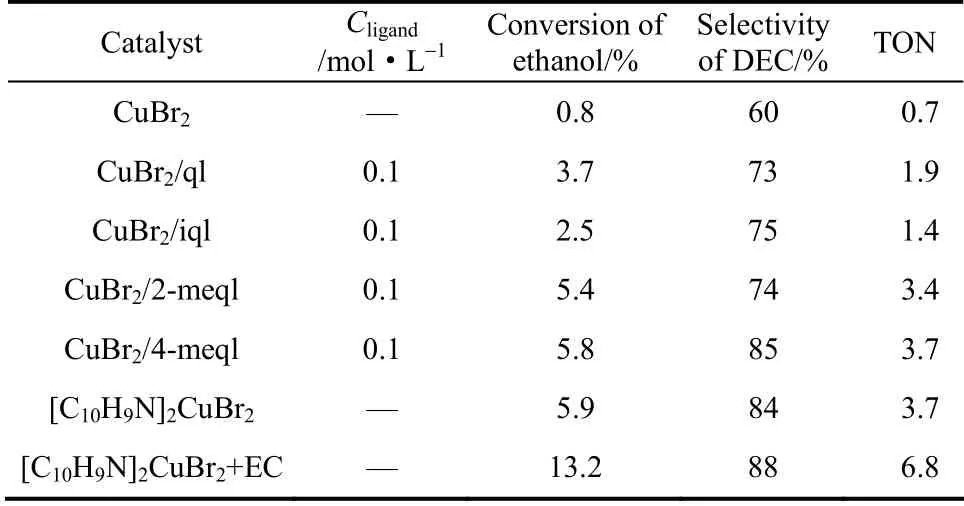
表5 催化剂的性能比较Table 5 Comparison of catalytic activity with different catalysts
Raab 等[17]研究表明,稳定性适中的金属配合物,有利于反应中间体的生成及形成产物的解离,表现出最佳的催化性能,从表3前线轨道能级分析可知,2-meql 和4-meql 形成配合物的能隙适中,稳定性适中,催化活性较高。另外,由于甲基取代基的推电子效应比氢原子强,增强了环上氮原子的电子密度,其催化活性强于喹啉和异喹啉。加入溶剂碳酸乙烯酯(EC),TON 达到6.8,一方面溶剂的加入增加了催化剂在乙醇中的溶解性,另一方面可能由于羰基氧原子的孤对电子与醇羟基反键轨道的相互作用,促进了催化活性的提高[18]。
2.3.1 催化剂浓度的影响 制备得到的配合物催化剂用于乙醇氧化羰化反应中,考察了催化剂浓度对反应的影响。实验结果如图4所示,DEC 的选择性变化不大,均保持在80%以上。乙醇的转化率随着催化剂浓度由0.025 g·ml-1至0.075 g·ml-1呈上升趋势,当催化剂浓度为0.075 g·ml-1时,乙醇的转化率达到15.8%,继续增大催化剂浓度到0.125 g·ml-1,由于均相反应体系黏度增大降低了催化剂与反应物的接触效率,不利于中间体的形成[19]。
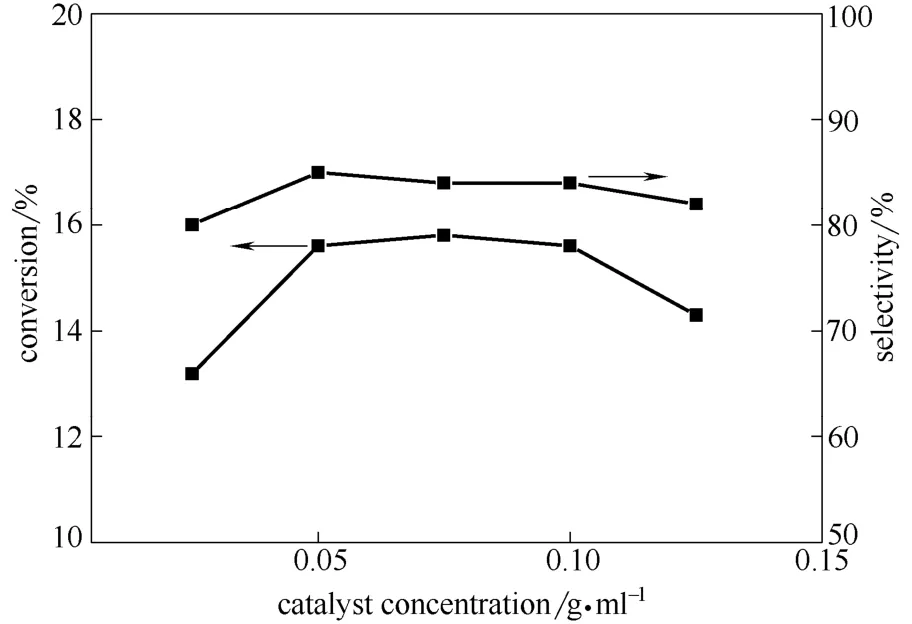
图4 催化剂浓度对反应的影响Fig.4 Effects of catalyst concentration on reaction
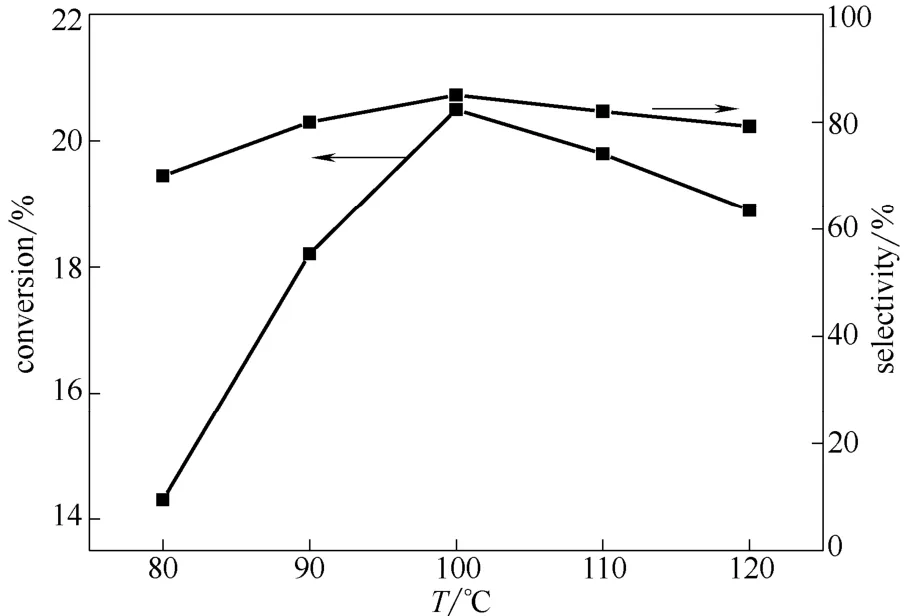
图5 温度对反应的影响Fig.5 Effects of temperature on reaction
2.3.2 反应温度的影响 图5为反应温度对乙醇氧化羰化反应的影响。可以看出,随着反应温度由80℃升至120℃,乙醇的转化率和DEC 选择性均呈 现先上升后降低的趋势,当温度为100 ℃时,乙醇的转化率和DEC 选择性达到20.5%和85%。虽然热力学计算表明该反应为强放热反应[20],但随着温度升高,反应速率增大,乙醇转化率增大,温度高于100℃后,热力学平衡上不利,转化率降低,且副产物增多导致目的产物的选择性下降。因此,最适宜反应温度为100℃。
2.3.3 反应时间的影响 考察了反应时间对铜配合物催化乙醇氧化羰化反应的影响,结果如图6所示,随着反应时间的增加,乙醇的转化率和DEC 的选择性都迅速增加,当反应时间为4 h 时,乙醇的转化率和DEC选择性均达到最大值,转化率为21.5%。继续增加反应时间,由于反应中DEC 的水解以及在液相主体中反应的复杂性,DEC 的选择性呈现一定的下降趋势,因此合适的反应时间为4 h。

图6 时间对反应的影响Fig.6 Effects of time on reaction
2.4 催化剂体系循环性能
为考核催化剂的循环使用性能,设定温度为100℃、压力为3.5 MPa、反应时间为4 h 和催化剂浓度为0.075 g·ml-1的条件,进行氧化羰基化反应后,将液体产品通过旋转蒸发仪进行简单分离,蒸出未反应的乙醇原料和反应产物,剩余的含有催化剂的溶剂返回到反应釜中,补充乙醇原料再进行反应,如此循环使用,实验结果如图7所示。
铜配合物催化剂5 次循环后,DEC 的选择性变化较小,稳定在80%左右,乙醇的转化率下降较大,降至原来的60%,经过3 次循环后催化活性基本稳定,乙醇的转化率稳定在12%左右。初步分析认为:添加溶剂的配合物催化剂保证了催化剂体系的循环使用,催化剂使用次数的增多使得催化活性有所降低,可能是因为催化剂有一定的流失,以及未完全 分离的水影响反应的催化活性,最后乙醇的转化率控制在12%左右,说明未完全分离生成水的影响可控制在一定的限度内,从而可以保证催化剂的使用稳定性及寿命。

图7 催化剂体系循环实验结果Fig.7 Results for recyling of catalysts
2.5 氧化羰化反应机理探讨
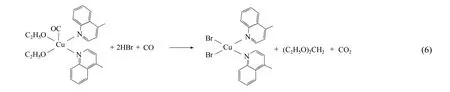
对反应压力 3.5 MPa、反应温度 100℃、[C10H9N]2CuBr2催化剂浓度0.075 g·ml-1、10 ml EC,反应结束液相产物进行GC-MS 分析,结果如表6所示,副产物分别为乙酸乙酯(EA),二乙氧基甲烷(DOM)。参考Liu 等[21-22]提出的反应机理,铜与配体可能的络合形式,推测该配合物会发生一系列反应,反应体系中存在的主副反应如式(1)~式(6)所示。

表6 液相产物GC-MS 分析Table 6 GC-MS analysis of liquid product

乙醇氧化羰基化生成DEC 的反应机理如式(1)~式(3)所示,通过之前的密度泛函理论计算分析,得出[C10H9N]2CuBr2结构中,Cu Br 键的键长为0.23760 nm,相比于CuBr2中0.2319 nm,键长变长,Br Cu Br 的角度变小,Cu Br 键电荷差改变,[C10H9N]2CuBr2稳定性变差,Br 易被乙醇取代,反应生成(C2H5O)2Cu[C10H9N]2;然后CO 吸附到Cu上,形成(C2H5O)2CuCO[C10H9N]2,进一步计算,发现这个铜五配位的分子结构中,Cu CO 键能为882.21 hartree,稳定性较差,CO 会发生插入反应,形成CH3CH2OCO-活性物种,Cu CO 键能为-0.06 hartree,键长变短,结构稳定。(C2H5O)(C2H5OCO)Cu[C10H9N]2分子中CH3CH2OCO-活性物种会与CH3CH2O-一起脱落形成DEC。其中CO 的插入反应为速率控制步骤[6],CO 的插入与中间体(C2H5O)2Cu[C10H9N]2的形成与铜电子云密度密切相关,在卤素元素中(如Cl、Br、I),Br 的电负性适当,有助于CO 插入到中间体 (C2H5O)2Cu[C10H9N]2的铜氧键中;同时通过配体(L)σ 键积累到金属铜周围的负电荷,也会通过反馈π 键反馈到CO 的反馈π 键轨道上去,提高了活性中心铜与CO 的成键[10]。这两方面原因都增强了C2H5O-对CO 的亲核能力,有利于中间体的形成,通过DFT 计算也表明C2H5O-与CO 间的C O键长变短,键能增强,加速了DEC 的生成速率。
在式(4)和式(5)中,在氧气存在的情况下,醇氧基(C2H5O-)会有一部分被氧化为醛基(CH3CO-),接着C2H5O-会和CH3CO-一起脱落形成EA,配体L 构成的配合物可能不利于C2H5O-基团β-H 的脱去,导致中间体乙醛难以形成;同时,(C2H5O)2CuCO[C10H9N]2中间体也会在CO 的插入下,如式(6)所示形成DOM。
3 结 论
合成了一种含溴有机铜(Ⅱ)配合物,通过红外光谱、X 射线粉末衍射、元素分析和等离子发射光谱对其进行了表征,初步探索了铜配合物的结构为[C10H9N]2CuBr2。采用DFT 方法,优化了配合物的结构,利用自然原子电荷分析、分子结构对比和前线轨道分析探索了分子结构对催化活性的影响。实验结果表明,该配合物稳定性适中,对乙醇氧化羰基化合成DEC 具有较高的催化活性,在催化剂浓度为0.075 g·ml-1、反应温度为373 K、反应压力为3.5 MPa 时,添加溶剂碳酸乙烯酯,乙醇的转化率达到21.5%,最后结合DFT 计算对反应机理进行了初步的探讨,认为稳定性适中的配合物催化剂的加入,有利于主反应控制步骤CO 的插入反应,有助于中间体的形成,加速DEC 的生成速率。
致谢:本工作为江苏高校优势学科建设工程咨询项目(PAPD)。
[1]Meng Xianyang (孟现阳),Zhen Pingjun (甄平军),Wu Jiangtao (吴江涛).Measurements of viscosity and density of diethyl carbonate [J].Journal of Chemical Ⅰndustry and Engineering(China) (化工学报),2008,59 (11):2695-2700.
[2]Su Yuehua (苏跃华),Jiang Xuanzhen (姜玄珍).Atmospheric vapor-phase carbonylation synthesis of diethyl carbonat [J].Modern Chem.Ⅰnd.(现代化工),2002,22 (2):33-34.
[3]Zhang P,Zhang Z,Wang S,Ma X.A new type of catalyst PdCl2/Cu-HMS for synthesis of diethyl carbonate by oxidative carbonylation of ethanol [J].Catalysis Communications,2007,8 (1):21-26.
[4]Liu Dinghua (刘定华),Xu Ming (徐明),Chen Zhensong (陈振松),Liu Xiaoqin (刘晓勤).Study on reaction performance of copper salt in oxidative carbonylation of ethanol [J].Journal of Chemical Engineering of Chinese Universities(高校化学工程学报),2013,27 (3):425-430.
[5]Romano U,Tesel R,Mauri M M,Rebora P.Synthesis of dimethyl carbonate from methanol,carbon monoxide,and oxygen catalyzed by copper compounds [J].Ⅰndustrial & Engineering Chemistry Product Research and Development,1980,19 (3):396-403.
[6]Cipriani G,Micucci L,Romano U,Tesei R.Method for the preparation of esters of carbonic acid [P]:US,4218391.1980-08-19.
[7]Zhao Qiang (赵强),Li Zhong (李忠),Xie Kechang (谢克昌).Advance in the catalysts for synthesis of dimethyl carbonate (DMC)vialiquid-phase oxidative carbonaylation of methanol [J].Ⅰndustrial Catalysis(工业催化),2006,14 (5):9-13.
[8]Liu Dinghua (刘定华),Jiang Zhiyang (姜志样),Liu Xiaoqin (刘晓勤),Zhong Qin ( 钟秦).Preparation of bromine-containing copper-organic coordination compound and its catalytic performance in oxidative carbonylation of methanol [J].CⅠESC Journal(化工学报),2010,60 (7):1714-1718.
[9]Xiong H,Mo W,Hu J,Bai R,Li G.CuCl/phen/NMI in homogeneous carbonylation for synthesis of diethyl carbonate:highly active catalyst and corrosion inhibitor [J].Ⅰndustrial & Engineering Chemistry Research,2009,48 (24):10845-10849.
[10]Yang Xiong (杨雄),Liu Dinghua (刘定华),Sun Linbing (孙林兵),Liu Xiaoqin (刘晓勤).CuBr /DMAP/DMA catalyzed oxidative carbonylation for diethyl carbonate synthesis [J].Journal of Chemical Engineering of Chinese Universities(高校化学工程学报),2014,28 (5):992-997.
[11]Kornecki K P,Briones J F,Boyarskikh V,Fullilove F,Autschbach J,Schrote K E,Lancaster K M,Davies H M L,Berry J F.Direct spectroscopic characterization of a transitory dirhodium donor-acceptor carbene complex [J].Science,2013,342 (6156):351-354.
[12]Struble M D,Scerba M T,Siegler M,Lectka T.Evidence for a symmetrical fluoronium ion in solution [J].Science,2013,340 (6128):57-60.
[13]Upadhyay K K,Kumar A,Upadhyay S,Mishra P C Mishra.Synthesis,characterization,structural optimization using density functional theory and superoxide ion scavenging activity of some Schiff bases [J].Journal of Molecular Structure,2008,873 (1):5-16.
[14]Kurt M,Yurdakul Ş.Molecular structure and vibrational spectra of lepidine and 2-chlorolepidine by density functional theory and ab initio Hartree-Fock calculations [J].Journal of Molecular Structure,2005,730 (1):59-67.
[15]Duttwyler S,Chen S,Takase M K,Wiberg K B,Bergman R G,Ellman J A.Proton donor acidity controls selectivity in nonaromatic nitrogen heterocycle synthesis [J].Science,2013,339 (6120):678-682.
[16]Du Zhiping,Xiong Lihua,Lin Zhikun,Li Xuli,Ding Yigang,Wu Yuanxin.Oxidative carbonylation of methanol to dimethyl carbonate over Cu (Ⅱ)-1,10-phenanthroline bromide complexes [J].Chinese Journal of Chemical Engineering,2014,22:1117-1121.
[17]Raab V,Merz M,Sundermeyer J.Ligand effects in the copper catalyzed aerobic oxidative carbonylation of methanol to dimethyl carbonate (DMC) [J].Journal of Molecular Catalysis A:Chemical,2001,175 (1):51-63.
[18]Chen Junrong (陈俊蓉),Cai Jing (蔡静),Li Quan (李权),Zhao Keqing (赵可清).Theoretical studies of molecular interaction between alcohols andN,N-dimethylacetamide [J].Acta Chimica Sinica-Chinese Edition(化学学报),2008,66 (5):536-540.
[19]Hu J C,Cao Y,Yang P.A novel homogeneous catalyst made of poly(N-vinyl-2-pyrrolidone)-CuCl2complex for the oxidative carbonylation of methanol to dimethyl carbonate [J].Journal of Molecular Catalysis A:Chemical,2002,185 (1/2):1-9.
[20]Zhang Liqing (张立庆),Shi Chen (史辰),Wang Jingfeng (王静峰).Thermodynamic analysis of the synthesis of diethyl carbonate by oxidative carbonylation of ethanol [J].Chemical Engineering of Oil & Gas(石油与天然气化工),2004,33 (3):152-154.
[21]Liu D H,He J,Sun L B,Liu X Q,Zhong Q.Cupric bromide-derived complex:an effective homogeneous catalyst for oxidative carbonylation of methanol to dimethyl carbonate [J].Journal of the Taiwan Ⅰnstitute of Chemical Engineers,2011,42 (4):616-621.
[22]Liu T C,Chang C S.Vapor-phase oxidative carbonylation of ethanol over CuCl-PdCl2/C catalyst [J].Applied Catalysis A:General,2006,304:72-77.
