胶原在两种离子液体[BMIM]Cl 和[BMIM]Ac中的溶解及再生结构比较
2015-08-21刘洁赵世玉徐洲常金明陈意范浩军
刘洁,赵世玉,徐洲,常金明,陈意,范浩军,2
(1 四川大学皮革化学与工程教育部重点实验室,四川 成都 610065; 2 四川大学制革清洁技术国家工程实验室,四川 成都 610065)
引 言
胶原作为天然的动物生物质资源,是细胞外基质的主要组成部分,同时也是动物体内含量最多、分布最广的结构性蛋白,占体内蛋白总量的1/3 左右,而动物皮是胶原的主要原料来源。胶原种类繁多,现已证明已发现的28 类胶原至少构成了脊椎动物中46 种不同的多肽链[1]。胶原为生物大分子,相对分子质量约30 万,具有由3 条呈聚脯氨酸Ⅱ型左手螺旋的平行多肽链相互缠绕而成的右手超螺旋结构(三股螺旋构象)[2],这种结构赋予其特殊的生物活性,如低的免疫原性、良好的生物相容性、优良的吸湿性,能促进血小板凝结,促进细胞的存活、生长、愈合,因而胶原基新型材料如吸附材料、生物医用材料、组织工程材料、整形和美容护肤材料、保健食品等在许多领域得到了广泛的应用,被认为是最有用的天然生物质材料之一。
当前生皮胶原的主要用途,一是制革制胶,二是高值转化为具有生物活性或功能特异性的胶原基新型材料。作为制备生物材料的关键一步,往往需要先将胶原溶解。然而胶原是天然“超分子”,其侧链含有丰富的极性基团,故可结合自重10 倍以上的水,而本身却不溶于水[3]。尽管有少量的溶剂,如稀醋酸溶液、三氟乙醇(TFE)、六氟异丙醇(HFIP)等,因具有捕捉氢键、电价键或破坏疏水键的能力,可以用来溶解胶原,但是它们仍然存在一些缺点与不足。如即使是在稀酸等良溶剂中,胶原的溶解度也较小且凝胶效应明显,难与其他相态材料复合,更难获得高浓度的胶原溶液(胶原溶液具有高黏度,一般可用的最高浓度为4 mg·ml-1,约0.4%)[4]。特别地,一旦溶解在TFE 或HFIP 中,胶原将会失去其独特的三股螺旋结构,而与明胶无异[5]。而且这类氟醇溶剂饱和蒸气压大、易挥发、腐蚀性及毒性强。显然,胶原在传统溶剂中的有限溶解性,尤其是在后两种溶剂中的变性行为,违背了其作为一种仿生材料的初衷,进而阻碍了它在纺丝、医用生物材料、食品保健、美容化妆品等方面的高值化利用。因此,找到合适的溶剂来高效地溶解制备胶原溶液,同时又尽可能地保留其三股螺旋结构的完整性,是胶原高值转化及利用的前提与基础。
被视为“超分子”溶剂的离子液体(ionic liquid,IL)主要由无机或有机阴离子与一个大的电荷呈弥散性分布且高度不对称的阳离子构成,是近年来兴起的一类极具应用前景的绿色溶剂。因其可回收、高热稳定性、可设计性、强极性以及良好的生物相容性等独特性能,可替代传统的挥发性有机溶剂广泛应用于电化学、有机合成、化工分离、材料制备等领域[6-8]。特别地,离子液体的物理化学性质强烈地依赖其阴阳离子的种类以及杂环的侧链烷基长度,因此改变这些结构参数将导致离子液体的黏度、挥发性、催化活性、疏水性和熔点等方面的显著变化。离子液体中的阳离子可作为电子接受体,阴离子可作为强氢键受体,故可与胶原分子中的氧原子和氢原子相互作用,进而裂解胶原大分子间的氢键,近年来人们试图利用离子液体的这种特性来高效溶解胶原。
周雅文等[9]利用1-烯丙基-3-甲基咪唑氯盐([AMIM]Cl)离子液体溶解脱铬皮屑,发现温度低于100℃时胶原纤维几乎不溶解。由于[AMIM]Cl 很稠,影响传质传热速率,发现150℃下溶解50min的溶解量最大。牛凤英等[10]考察了[AMIM]Cl 对猪皮粉的溶解效果,发现溶解温度高于140℃时胶原蛋白将发生严重的降解。本课题组[11]发现在[BMIM]Cl 中明胶、酪素、皮粉均能溶解,明胶、酪素溶解前后其结构和热稳定性能都未发生明显变化,而皮胶原的热稳定性能略有下降。Meng 等[12]探讨了以[BMIM]Cl 为介质在100℃的溶解条件下制备多种样式的胶原/纤维复合材料的可行性。Wang 等[13]在100℃的条件下用[BMIM]Cl 溶解制备了胶原/纤维素水凝胶珠,因其三维孔状结构中的氨基酸含有金属离子的活性结合位点,可用于2 价铜离子的吸附。
前人的研究工作多停留在考察高温下胶原的溶解性以及溶解前后其化学结构的变化,较少涉及离子液体的分子结构差异对胶原蛋白溶解性能的影响,特别是离子液体中阴离子的构造差异对胶原溶解前后空间结构(尤其是三股螺旋结构)和热稳定性等性能的影响。本工作以氯代1-丁基-3-甲基咪唑离子液体为原料合成了1-丁基-3-甲基醋酸咪唑离子液体,并以两者为溶剂考察了胶原在不同阴离子型咪唑离子液体中的溶解特性,采用FTIR、UV、XRD、CD 对胶原溶解前后的化学结构和空间结构进行了表征,同时对其溶解前后的热稳定性进行了相关研究。本工作的目的旨在研究咪唑离子液体阴离子构造差异对胶原溶解行为的影响以及溶解前后胶原结构性能的变化,为在高效提取胶原溶液的同时最大程度地保留胶原固有的三股螺旋构象,提高胶原的生物活性和与其他体系的相容性奠定基础。
1 实验部分
1.1 主要原料与仪器
(1)原料 氯代1-丁基-3-甲基咪唑:化学纯(≥99%),上海成捷化学有限公司;牛皮皮粉:四川大学制革清洁技术国家工程实验室;醋酸铵;4Å分子筛:分析纯,成都市科龙化工试剂厂;无水乙醇:化学纯,成都金山化学试剂有限公司。
(2)仪器 SHZ-D(Ⅲ)型循环水真空泵:成都康宇科技有限公司;DZF-6020 型真空干燥箱:上海一恒科学仪器有限公司;冷冻干燥机:北京博医康实验仪器有限公司;DF-1012 集热式恒温加热磁力搅拌器:河南予华仪器有限公司;RE52-1 旋转蒸发仪:上海沪西分析仪器厂;Nicolet Is10 傅里叶红外光谱仪:美国Thermo Scientific 公司;LAMBDA25型紫外可见分光光度计:美国PerkinElmer 公司;DX-1000 型X 射线衍射仪:中国丹东方圆仪器有限公司;Model 400 型圆二色谱仪:美国Aviv 公司;TG209F1 型热重分析仪:德国耐驰公司。
1.2 离子液体[BMIM]Ac 的制备与表征
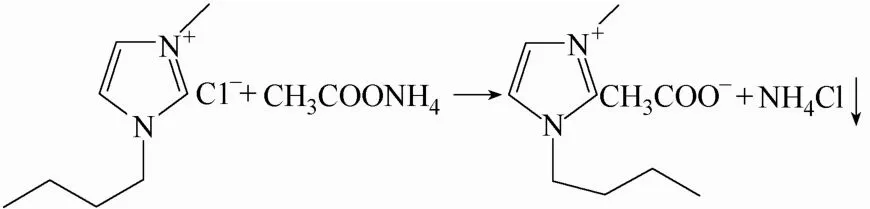
采用离子交换法制备醋酸盐型离子液体[14-15]:将氯代1-丁基-3-甲基咪唑和醋酸铵按摩尔比1:1 分别溶解在无水乙醇中,将溶解好的氯代咪唑醇溶液转移至三口烧瓶中。分批加入醋酸铵醇溶液,并在60℃油浴中加热回流6 h,同时施以磁力搅拌,生成的NH4Cl 以白色沉淀的形式从醇溶液中析出。真空抽滤,收集滤液,用4Å 分子筛处理48 h。减压蒸馏,除去乙醇,产物为淡黄色的[BMIM]Ac 液体,密封干燥保存。合成反应为
1.3 胶原在咪唑离子液体中的溶解
[BMIM]Ac 溶解皮粉的温度为 50 ℃,而 [BMIM]Cl 在75℃条件下对皮粉进行溶解。实验中采用油浴加热、磁力搅拌溶解。皮粉分多次加入,每次加入量为离子液体的1%。胶原在溶液中的溶解度(质量分数)根据公式C=m(胶原)/m(离子液体)×100%计算。
1.4 再生胶原的制备
在约4℃条件下,将胶原离子液体混合液倾倒在聚四氟乙烯板上,并用无菌玻璃推板铺展均匀。将聚四氟乙烯板浸没在乙醇沉淀浴中0.5 h,更换乙醇浴,前后多次,直至离子液体完全分散到沉淀浴中。然后取出聚四氟乙烯板,置于真空干燥箱中,常温减压干燥,得到恒重的再生胶原半透明膜。
1.5 胶原纤维及再生胶原的性能测试
(1)红外光谱分析 对皮粉及经两种离子液体溶解再生得到的胶原蛋白采用研片的方式制备试样:取少量溶解前后的皮粉,按溴化钾/检测样为100:1 的比例混合碾磨,压片后进行傅里叶变换红外光谱分析,观察溶解前后蛋白质化学结构的变化情况。仪器分辨率为4 cm-1,扫描频率32 s-1,波数范围500~4000 cm-1。
(2)紫外-可见分光光度分析 将由皮块酶法提取的胶原蛋白和离子液体溶解再生后的胶原以及明胶分别溶解在0.5 mol·L-1醋酸溶液中,配制成相同浓度的醋酸溶液。用UV-250IPC 型紫外可见分光光度计(日本)在200~500 nm 全波段扫描范围内做紫外分析。
(3)X 射线衍射(XRD)分析 采用DX-1000型X 射线衍射仪测定皮粉溶解前后的XRD 谱。以CuKα为射线源,管电压40 kV,管电流30 mA,扫描速率为1(°)·min-1,角度扫描范围5°~50°。
(4)圆二色谱(CD)测定 将由此皮粉提取的酶溶性胶原及离子液体溶解再生胶原溶于醋酸溶液中,配置成质量浓度为0.1 mg·ml-1的胶原溶液,并于4℃平衡12 h 后,以9000 r·min-1冷冻离心20 min。取上清液加入比色皿中,放入圆二色谱仪中,于190~250 nm 范围进行扫描。
1.6 溶解前后胶原的热重分析
分别取3~4 mg 溶解前后的皮胶原进行热重分析。实验采取静态TGA 的模式进行,测试样在氮气保护气氛下,从40~600℃,以10℃·min-1的速率升温。对得到的TGA 实验数据进行处理,得到胶原蛋白的TGA 和DTG 曲线。
1.7 离子液体的回收
将溶有离子液体的乙醇沉淀浴抽滤,收集滤液,置于旋转蒸发仪上,旋蒸浓缩至烧瓶中不再有气泡产生为止,随后将溶液置于真空干燥箱中,于90℃下干燥过夜。将回收得到的[BMIM]Cl 及[BMIM]Ac 进行红外光谱表征,考察回收前后离子液体在结构上是否发生变化。
2 结果与讨论
2.1 离子液体FTIR 红外光谱分析
由图1可知:3424 cm-1吸收峰对应着—OH 的伸缩振动,是水的杂质峰,因离子液体很容易吸潮。在含有咪唑阳离子的离子液体中,3100 cm-1左右的特征谱带是由咪唑环上C—H 的伸缩振动引起的;2960、2870、1400 cm-1左右的特征谱带分别归属于甲基上C—H 的反对称伸缩振动、对称伸缩振动和弯曲振动,2936、1460 cm-1左右的特征谱带则分别归属于亚甲基上C—H 的反对称伸缩振动和弯曲振动;1627、1570 cm-1左右的特征谱带分别归属为咪唑环中及的伸缩振动,1170 cm-1左右的峰归属为咪唑的H—C—C 和H—C—N 的弯曲振动[16-17];846、750、620 cm-1左右的谱带分别归属于咪唑的面内、面外及其C—N—C 的弯曲振动;1012、750 cm-1左右的特征谱带属于C—N 的伸缩振动。[BMIM]Ac 的羧基COO-系具有多电子π键体系,原羰基和C—O 平均化,两个C—O 强烈振动偶合出现了分离的对称伸缩振动(在1400 cm-1附近)和反对称伸缩振动(在1550~1650 cm-1区域),而在1700 cm-1附近的伸缩振动峰减弱[18]。
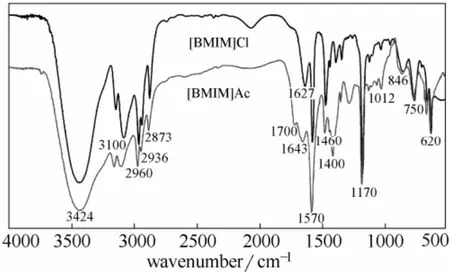
图1 [BMIM]Cl 和 [BMIM]Ac 的红外光谱图Fig.1 FTIR spectra of [BMIM]Cl and [BMIM]Ac
2.2 不同胶原溶液的凝胶性能
图2列出了两种离子液体、胶原醋酸溶液及胶原在咪唑离子液体中溶解后的凝胶性能比较。一般而言,低熔点离子液体的阳离子具有以下特征:低对称性、弱的分子间作用力和阳离子电荷的均匀分布。也就是说,阳离子中电荷越分散,分子的对称性越低,生成化合物的熔点越低[19]。本研究中的1-丁基-3-甲基咪唑为非对称N,N-二烷基咪唑阳离子,电荷弥散性分布,熔点较低。在阳离子相同的情况下,阴离子对离子液体的熔点也有较大影响。大的阴离子与阳离子作用力小,易生成熔点低的化合物。相对Cl-来说,CH3COO-有更大的离子尺寸,因而[BMIM]Ac 具有更低的熔点。概括来讲,离子液体的熔点代表液体间隙的最低极限,其与热稳定性一起确定了温度间隔,进而使离子液体作为溶剂成为 可能。显然,[BMIM]Ac 较低的熔点为其在低温溶解胶原纤维提供了可能。

图2 [BMIM]Cl、[BMIM]Ac、1%胶原醋酸溶液、4%胶原-[BMIM]Ac 混合液和3%胶原-[BMIM]Cl 混合液Fig.2 Appearance of [BMIM]Cl,[BMIM]Ac,1% collagen acetic acid solution,4% collagen-[BMIM]Ac solution and 3% collagen-[BMIM]Cl solution
如图2(a)所示,[BMIM]Cl 在室温下为白色固状,熔点为70℃,而且易吸潮。而图2(b)为合成的[BMIM]Ac,室温下为液态,颜色淡黄,溶液清澈透明,黏度小。图2(c)为室温下1%胶原醋酸溶液,展现出高的黏稠性及凝胶状态。考虑到醋酸为弱电解质,部分解离的Ac-与H+仅能破坏胶原分子间少量的氢键与电价键,大部分胶原分子仍然通过氢键聚集,因此低固含量下便呈现高黏性的凝胶状态。然而离子液体由完全离子化的[BMIM]+、Ac-(Cl-)构成,分别作为电子的受体与质子强烈的受体。这些大量离子化的[BMIM]+、Ac-(Cl-)不仅破坏了毗邻胶原分子间的电价键,而且同时破坏了分子间的氢键键合作用,导致胶原在其中具有更高的溶解度,在高固含量时仍具有良好的流动性[图2(d)、(e)]。
2.3 胶原纤维偏光显微分析(POM)
胶原的三股螺旋结构主要靠链内及链间氢键、离子键、范德华力、极性及非极性基团间的疏水作用来维持稳定。胶原特有的Gly-X-Y 三肽高度重复性序列导致螺旋内外存在大量的氢键,促成胶原纤维规整性排列,进而具备一定的类结晶结构。由于原胶原分子的定向排布,胶原纤维结构表现出明显的各向异性,具有在长轴的双折射性,而以Ⅰ型胶原分子为基本结构的真皮层纤维有序体有着介于各向异性晶体和各向同性液体之间的近似液晶态结构,其对齐的胶原束类似分子相排列[20-21]。
双折射是晶体的基本特征,偏光显微镜观察是利用光的偏振特性对具有双折射性物质进行研究鉴定的必备手段。如图3所示,皮纤维显现出亮度较高的纤维状,而刚浸没于离子液体中的胶原纤维存在大片结晶光亮区,表明胶原蛋白分子间错叠的有序结构。但当体系受热温度上升时,离子液体开始渗入到纤维内部,胶原分子间的氢键、离子键遭到离子液体阴阳离子的进攻而瓦解,导致胶原分子无规则地分布在离子液体中,得到各向同性的分散结构,胶原纤维的双折射减小乃至全消失。
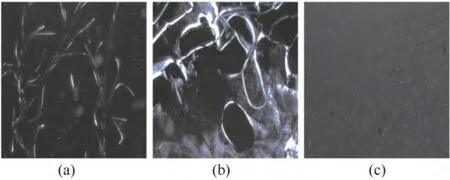
图3 胶原纤维(a)、浸没于[BMIM]Ac 中的胶原纤维(b)和胶原被[BMIM]Ac 溶解后的离子混合液(c)Fig.3 POM images (×100) of collagen fibers (a),collagen fibers immersed in [BMIM]Ac (b),and collagen/IL mixture after dissolution by [BMIM]Ac (c)
2.4 胶原溶解前后结构的变化
2.4.1 胶原再生前后的红外光谱分析 如图4所示,1658 cm-1处为胶原酰胺Ⅰ带的伸缩振动强峰,1553 cm-1处为酰胺Ⅱ带N—H 弯曲振动吸收峰,1240 cm-1处则出现酰胺Ⅲ带N—H 的变形峰。酰胺Ⅰ、Ⅱ、Ⅲ带是胶原纤维的特征吸收峰。与皮胶原相比,再生后的胶原在3 个酰胺带也均有吸收峰,而且峰位几乎没有变化,谱图中并没有新的特征峰出现,表明无论是用[BMIM]Ac 还是[BMIM]Cl 溶解胶原都没有造成胶原一级结构的破坏。

图4 皮胶原(a)、[BMIM]Ac 溶解皮纤维后的再生胶原(b)和[BMIM]Cl 溶解皮纤维后的再生胶原(c)的红外光谱图Fig.4 FTIR spectra of native collagen (a),and collagen regenerated from different ionic liquids (b:[BMIM]Ac; c:[BMIM]Cl)
完整的胶原应具有特殊的三股螺旋结构,酰胺Ⅲ带与1450 cm-1处吸光度的比值常用来衡量胶原的三股螺旋结构是否完整。据报道完整三股螺旋构象的胶原应该Ⅰ1240/1450≥1(图4中谱线a)[22]。当溶解温度为50℃时,[BMIM]Ac 溶解再生后的胶原Ⅰ1240/1450值降到0.93 左右,而75℃下[BMIM]Cl 溶解再生后的胶原Ⅰ1240/1450值则明显降低至0.83,表明溶解温度升高胶原三股螺旋结构受损程度也随之增大,但相比于胶原的水解产物明胶(约0.6)[23],此时的胶原依然维持较高的结构完整性,说明两种离子液体溶解再生后的胶原三股螺旋结构被破坏的程度不高。
2.4.2 胶原溶解前后的紫外光谱分析 胶原的肽链中含有众多生色基团,可以在近紫外区检测到吸收峰。图5是胶原溶解前后的UV 谱图。
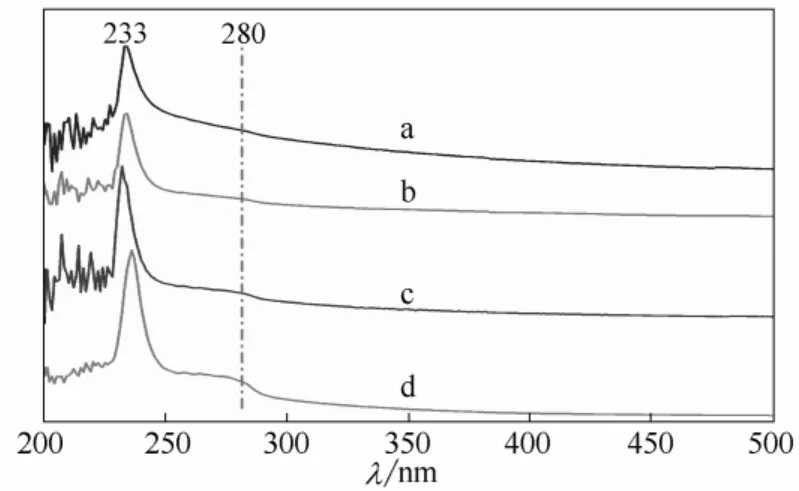
图5 皮胶原(a)、[BMIM]Ac 溶解再生胶原(b)、[BMIM]Cl溶解再生胶原(c)和明胶(d)的紫外吸收光谱图Fig.5 UV spectra of solutions of native collagen (a),collagen regenerated from different ionic liquids(b:[BMIM]Ac; c:[BMIM]Cl),and gelatin (d)
由图5中谱线a 可知,胶原蛋白的紫外最大吸 收波长为233 nm,这是胶原蛋白肽链中、COOH、CONH2产生的吸收峰,是胶原蛋白的特征峰[10]。无论是胶原蛋白还是再生后的胶原,其最大吸收波长都出现在233 nm 附近处,峰型相似,表明经咪唑离子液体溶解的胶原一级结构保留较好,没有遭到明显的破坏。280 nm 为酪氨酸、苯丙氨酸的吸收峰,峰的强弱与胶原蛋白溶液的浓度存在一定关系。如图5中谱线a、b、c 所示,胶原蛋白及溶解再生后的胶原蛋白280 nm 处的峰不明显。对于同样浓度的明胶溶液来说,280 nm 处的峰明显强于其他胶原溶液,原因可能在于明胶是胶原严重水解的产物,胶原的三股螺旋结构已基本丧失殆尽,而且胶原分子链在水解过程中被打断,使得大量包裹在分子链内部的酪氨酸、苯丙氨酸残基暴露出来,导致280 nm 处的吸收峰明显增强。胶原及再生胶原的紫外图谱说明,即使是在75℃的条件下用[BMIM]Cl 溶解胶原,胶原仍保留一定的有序结构,破坏程度小于明胶。
2.4.3 胶原溶解前后的XRD 分析 X 射线衍射是测定胶原空间结构、理解胶原分子三股螺旋构象和胶原原纤维轴向排列方式的物理方法。图6是胶原溶解前后的XRD 衍射谱图。
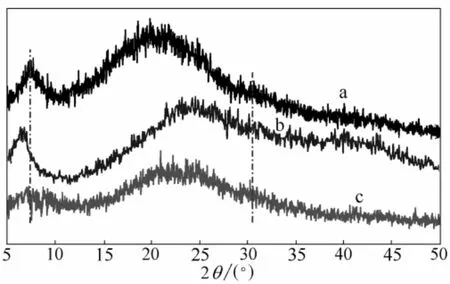
图6 皮胶原(a)、[BMIM]Ac 溶解再生胶原(b)和[BMIM]Cl溶解再生胶原(c)的XRD 衍射谱图Fig.6 XRD patterns of native collagen fibers (a) and collagen regenerated from IL (b:[BMIM]Ac; c:[BMIM]Cl)
由图6可以看出,天然皮胶原(皮粉)的X 射线衍射图上主要有3 个衍射峰:第一个是在2θ为7°~8°(约1.3 nm)处,为晶区产生的衍射峰,这种布拉格间距代表的是组成胶原纤维的分子链间横向距离;第二个是在2θ=22°附近,出现一个非常宽的峰,为胶原纤维内部众多结构层次引起的漫散射;第三个在2θ=31°(约0.29 nm)附近,有一个小而宽的峰,反映的是胶原螺旋的一个旋转高度内所对应的轴向周期,即典型的三股螺旋结构[24-26]。可以看出,再生胶原与天然皮胶原纤维的XRD 衍射谱图形状相似,但再生胶原在2θ=8°~9°处的衍射峰发生左移,表明胶原分子链间距变大,胶原在溶解过程中分子链彼此分散。[BMIM]Cl 溶解再生胶原在此峰处变宽变小,可能是过高的溶解温度使得部分胶原分子链发生了解螺旋,导致结晶度下降。
2.4.4 胶原溶解前后的圆二色谱 圆二色谱(CD)是研究稀溶液中蛋白质空间结构的一种方法,主要利用分子对左、右圆偏振光吸收的不同进行结构分析。胶原由具有光学活性的α-氨基酸通过肽键连接而成,是具有特定结构的生物大分子,其圆二色性主要是活性生色基团及折叠结构两方面圆二色性的总和。由于胶原是一类光学活性蛋白质,采取类聚脯氨酸Ⅱ型的螺旋构象,其圆二色谱特征就是在200 nm 附近有一个负吸收峰,而在223 nm 左右有一个弱的正吸收峰。

图7 皮胶原(a)、[BMIM]Ac 溶解再生胶原(b)和[BMIM]Cl溶解再生胶原(c)的圆二色谱图Fig.7 CD spectra of native collagen (a) and collagen regenerated from different ionic liquids (b:[BMIM]Ac; c:[BMIM]Cl)
由图7可知,胶原及再生胶原都具有典型的胶原圆二色谱特征。但是有研究显示[27],胶原完全变性后223 nm 处的正吸收峰完全消失,如胶原的水解物明胶。另有研究表明[28],胶原螺旋结构的改变将导致CD 图谱中峰强度的降低,并且在长波长处(约223 nm)出现的峰强度与在短波长处(约200 nm)出现的峰强度比值(Rpn)会降低。胶原在[BMIM]Ac 溶解再生后的Rpn值由原来的0.152 降到了0.127,说明再生胶原三股螺旋的完整性稍有所降低,但是[BMIM]Cl 溶解再生后的胶原Rpn 值减少到0.05,说明75℃下加热溶解后的胶原三股螺旋结构发生部分解构,显然更高的溶解温度不利于胶原三股螺旋构象的保留。
2.5 胶原再生前后的热稳定性研究
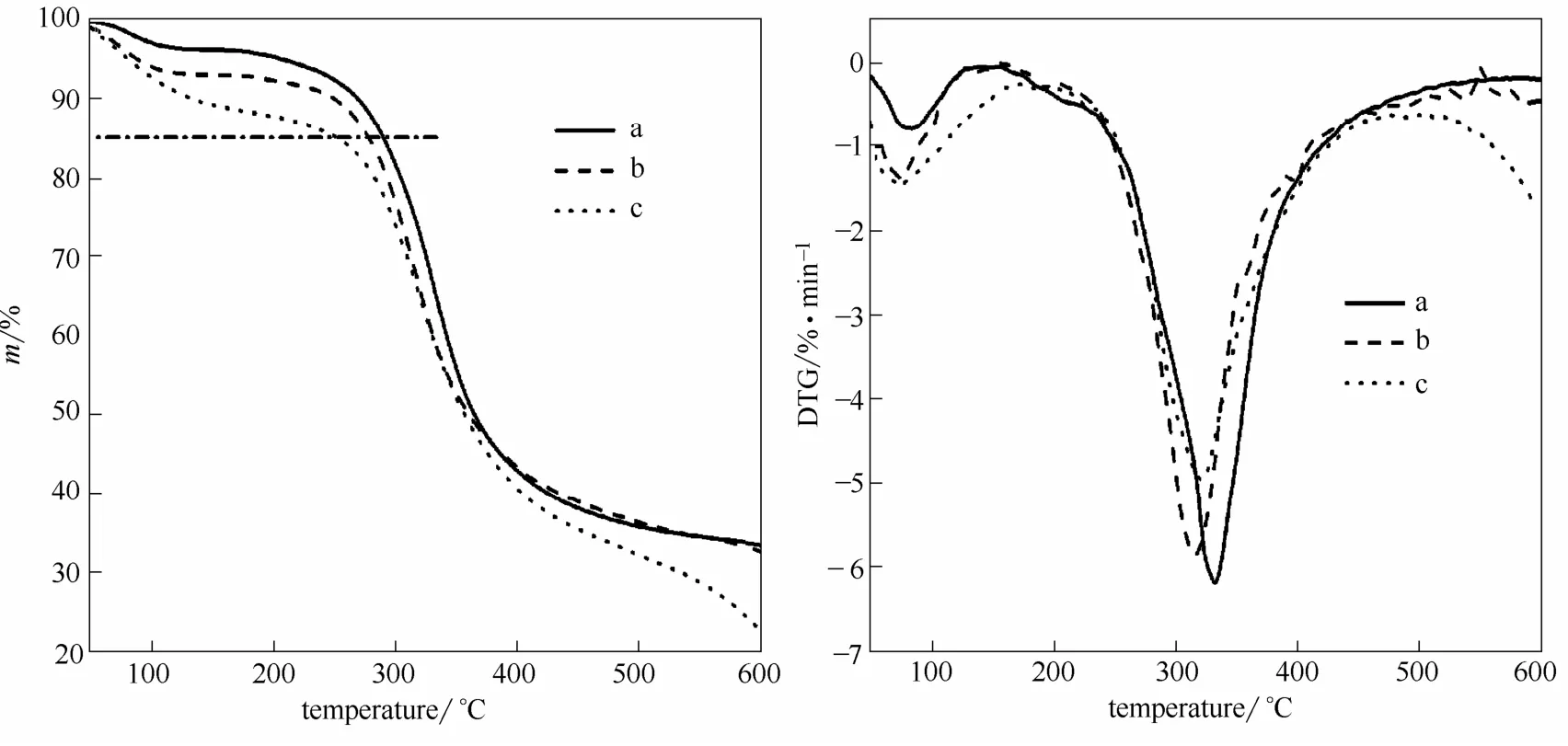
图8 皮胶原(a)、[BMIM]Ac 溶解再生胶原(b)和[BMIM]Cl 溶解再生胶原(c)的TG/DTG 曲线Fig.8 TG/DTG curves of native collagen (a) and collagen regenerated from different ionic liquids (b:[BMIM]Ac; c:[BMIM]Cl)
一般而言,大分子的热稳定性取决于其分子量、空间结构、分子间作用力等因素。从图8可知,胶原的热失重主要分为两个主要阶段:40~150℃为胶原分子间及分子内氢键的断裂,同时伴随着水分的蒸发;200~500℃则是胶原多肽链的热分解阶段[29]。事实上,胶原纤维、[BMIM]Ac 及[BMIM]Cl溶解再生胶原15%的质量损失温度分别发生在290、281 和253℃,表明再生胶原的热稳定性低于原胶原纤维。由于离子液体溶解胶原主要依靠打断胶原分子间氢键及离子键的作用力,但是在溶解过程中不可避免地导致了少量分子内氢键的破坏,造成再生胶原在低温区域热稳定的相应下降,特别是[BMIM]Cl 中较高的溶解温度在一定程度上导致了胶原纤维的部分热降解。
2.6 溶解机理
胶原分子的螺旋构象以及维持构象的各种分子间作用力赋予胶原纤维不溶的性质。离子液体能够溶解胶原的机理可能主要在于其能够破坏胶原大分子间的氢键及离子键,目前可以推断的是胶原分子上的氧和氢原子与离子液体中的阴阳离子基团间发生了相互作用。如图9所示,在溶解温度下,离子液体中的阴阳离子对首先解离为自由的[BMIM]+和阴离子,然后这些游离的CH3COO-或Cl-与胶原肽键中—NH—上的H 配合,而[BMIM]+与胶原的肽键结合。同时由于静电力的作用,带有相反电荷的[BMIM]+、Ac-(Cl-)分别与胶原侧链离子化的COO-与NH+3相互吸引键合,破坏了COO-与NH+3间原有的电价键。[BMIM]+、Ac-(Cl-)与胶原分子间新形成的氢键与离子键打断了胶原分子间 的氢键及离子键,最终导致胶原链能够自由地运动并溶解于离子液体中。

图9 胶原纤维在咪唑离子液体中的溶解原理Fig.9 Possible dissolution mechanism of collagen in imidazolium ionic liquids
相较于[BMIM]Cl,[BMIM]Ac 溶解胶原纤维的条件温和得多,这不仅由于醋酸盐的咪唑离子液体有着更低的熔点及黏度,还在于其有着更强的质子接受能力。有研究表明,Kamlet-Taftβ参数可作为反映溶剂质子接受能力的参数。一般而言,溶剂的β参数越大,其接受质子的能力就越强。很明显,阳离子相同的离子液体,其接受氢键的能力(β参数值)随阴离子不同而不同。根据先前的研究,由于醋酸根的存在,[BMIM]Ac 的β参数值为1.2,几乎是[BMIM]Cl(β=0.83)的1.5 倍左右[30]。因此,[BMIM]Ac 展现出更强的质子接受能力,能够破坏胶原聚集体分子间广泛且有序组织存在的大量氢键,进而导致胶原在更低的温度下溶解,避免了胶原的三股螺旋在受热溶解过程中的解构。此外,当[BMIM]Ac 渗透到胶原纤维间隙内时,其较大的阴阳离子空间体积降低了胶原分子的内聚作用(削弱、破坏化学键)并增加了其亲溶剂性,因而所制备的胶原溶液具有更高的固含量和流动性。
2.7 离子液体回收前后的红外光谱分析
离子液体能够回收与再利用是其主要优点之一,这样离子液体就可以循环使用,从而降低生产成本。离子液体的沸点较高、热稳定性好、饱和蒸气压接近零,因而沉淀浴中的离子液体和乙醇可以通过减压蒸馏操作进行分离。本研究对回收后的[BMIM]Cl 及[BMIM]Ac 进行了红外光谱表征,考察回收前后离子液体在结构上是否发生变化。由图10可知,除3424 cm-1附近处水的杂质峰变宽外(可能原因在于皮胶原溶解过程中带入的一部分结合水在蒸馏过程中没有除尽),离子液体回收前后的红外谱图基本一致。这说明回收后的离子液体仍然保持其原有的结构,可以重复利用。

图10 [BMIM]Cl(a)、回收后的[BMIM]Cl(b)、[BMIM]Ac(c)和回收后的[BMIM]Ac(d)的红外光谱图Fig.10 FTIR spectra of [BMIM]Cl (a),recovered [BMIM]Cl (b),[BMIM]Ac (c),and recovered [BMIM]Ac (d)
3 结 论
(1)合成的1-丁基-3-甲基咪唑醋酸盐离子液体([BMIM]Ac)与咪唑氯盐[BMIM]Cl 相比,具有常温流动性好、黏度低和氢键接受能力强等特点,离子液体所制备的胶原溶液具有更高的固含量和良好的流动性。
(2)POM 观察显示胶原的晶态结构在离子液体溶解过程中的变化。离子液体破坏了胶原分子间的氢键,导致以氢键作用为基础堆叠形成的结晶构象瓦解,溶解后的胶原晶态结构被破坏(亮区完全消失),分子无规则地散布于离子液体中。
(3)胶原在咪唑离子液体中的溶解与再生过程并没有导致其红外、紫外谱图的明显变化,表明胶原的化学结构没有改变,其溶解属于直接溶解,溶解机理为构成离子液体的阴、阳离子削弱了胶原分子间的氢键及离子键作用。
(4)FTIR、XRD、CD 分析表明,离子液体溶解再生后的胶原三股螺旋结构发生部分松散,但在相同咪唑阳离子的情形下,由于Ac-具有更强的质子接受能力以及更大的离子尺寸所带来的更低熔点与溶解温度,经[BMIM]Ac 溶解再生后的胶原三股螺旋结构保留相对完整,螺旋保留度远高于[BMIM]Cl 溶解再生的胶原。
(5)热重分析表明再生后的胶原热分解温度和热解峰均低于天然胶原纤维,原因在于皮胶原在溶解过程中部分空间结构和聚集态发生了改变,特别是[BMIM]Cl 过高的溶解温度可能导致胶原的部分解螺旋,相较于氯代咪唑盐,醋酸咪唑盐溶解再生的胶原具有更高的热稳定性。
(6)回收后的[BMIM]Cl 及[BMIM]Ac 结构没有发生明显变化,仍可继续使用,降低了反应成本。
[1]Brodsky B,Ramshaw J A M.The collagen triple-helix structure [J].Matrix Biology,1997,15(8):545-554.
[2]Shoulders M D,Raines R T.Collagen structure and stability [J].Annual Review of Biochemistry,2009,78:929-958.
[3]Jiang Tingda(蒋挺大).Collagen and Collagen Protein(胶原与胶原蛋白) [M].Beijing:Chemical Industry Press,2006:53-56.
[4]Nagai Y,Fujimoto D.Experimental Methods of Collagen(胶原蛋白实验方法) [M].Liu Ping(刘平),trans.Shanghai:Shanghai University of Traditional Chinese Medicine Press,1992:4-5.
[5]Zeugolis D I,Khew S T,Yew E S Y,Ekaputra A K,Tong Y W,Yung L Y,Hutmacher D W,Sheppard C,Raghunath M.Electro-spinning of pure collagen nano-fibres-just an expensive way to make gelatin? [J].Biomaterials,2008,29(15):2293-2305.
[6]Welton T.Room-temperature ionic liquids.Solvents for synthesis and catalysis [J].Chemical Reviews,1999,99(8):2071-2084.
[7]Li Xiaoqian(李晓倩),Guan Ping(管萍),Hu Xiaoling(胡小玲),Tang Yimei(唐一梅),Lin Xiangping(林香萍).Electrochemical properties of 1-vinyl-3-aklylimidazole bromide ionic liquids [J].CⅠESC Journal(化工学报),2013,64(11):4153-4160.
[8]Chen Jing(陈婧),Zhang Jinming(张金明),Chen Weiwei(陈韦韦),Feng Ye(丰晔),Zhang Jun(张军).Homogenous synthesis of cellulose naphthoate in an ionic liquid [J].Acta Polymerica Sinica(高分子学报),2013,(10):1235-1240.
[9]Zhou Yawen(周雅文),Cheng Baozhen(程宝箴),Deng Yu(邓宇),Shang Haiping(尚海萍).Dissolution characteristics of collagen fiber in ionic liquids [J].China Leather(中国皮革),2010,39(7):22-27.
[10]Niu Fengying(牛凤英),Wang Shaojun(王少君).Solubility and regeneration characteristics of collagen in ionic liquids [J].China Leather(中国皮革),2011,40(19):27-29.
[11]Xia C C,Sun J,Fan H J,Chen Y.Dissolution characteristics of protein in an ionic liquid [J].Journal of the Society of Leather Technologists and Chemists,2013,97(1):11-17.
[12]Meng Z J,Zheng X J,Tang K Y,Liu J,Ma Z,Zhao Q L.Dissolution and regeneration of collagen fibers using ionic liquid [J].Ⅰnternational Journal of Biological Macromolecules,2012,51:440-448.
[13]Wang J,Wei L,Ma Y,Li K,Li M,Yu Y,Wang L,Qiu H.Collagen/cellulose hydrogel beads reconstituted from ionic liquid solution for Cu(Ⅱ) adsorption [J].Carbohydrate Polymers,2013,98(1):736-743.
[14]Han Xiaojin(韩小进),Cheng Chunzu(程春祖),Zhu Qingsong(朱庆松),Wu Changcheng(武长城).Synthesis of homogeneous and heterogeneous graft copolymer of chitosan and lactide [J].Polymer Materials Science and Engineering(高分材料科学与工程),2011,27(1):20-23.
[15]Liu Y,Li M,Lu Y,Gao G H,Yang Q,He M Y.Simple,efficient and recyclable palladium catalytic system for Heck reaction in functionalized ionic liquid network [J].Catalysis Communications,2006,7(12):985-989.
[16]Wang Chuanxing( 王 川 行).Synthesis of ionic liquids and functionalization of cellulose in ionic liquid[D].Hefei:Hefei University of Technology,2010.
[17]Zhang Ling(张玲).Study of dissolution and rhelogy of gelatin/ionic liquids solutions[D].Jinan:Shandong Polytechnic University,2011.
[18]Li Hongfei(李洪飞),Wang Yuan(王媛),Fu Jinlun(付金伦),Zhao Jiruo(赵季若),Feng Ying(冯莺).Preparation,characterization and properties of CPE-cg-MAH ionomer [J].China Elastomerics(弹性体),2014,24(3):1-4.
[19]Le Changgao(乐长高).Application of Ionic Liquids in the Organic Synthesis Reactions(离子液体及其在有机合成反应中的应用)[M].Shanghai:East China University of Science and Technology Press,2007:2-5.
[20]Kiraly K,Hyttinen M M,Lapvetelainen T Elo,Kiviranta I,Dobai J,Modis L,Helminen H J,Arokoski J P A.Specimen preparation and quantification of collagen birefringence in unstained sections of articular cartilage using image analysis and polarizing light microscopy [J].Histochemical Journal,1997,29(4):317-327.
[21]Melis P,Noorlander M L,van der Horst C M A M,van Noorden C J F.Rapid alignment of collagen fibers in the dermis of undermined and not undermined skin stretched with a skin-stretching device [J].Plastic and Reconstructive Surgery,2002,109(2):674-680.
[22]Goissis G,Piccirili L,Goes J C,de Guzzi Plepis A M,Das-Gupta D K.Anionic collagen:polymer composites with improved dielectric and rheological properties [J].Artificial Organs,1998,22(3):203-209.
[23]Andrews M E,Murali J,Muralidharan C,Madhulata W,Jayakumar R.Interaction of collagen with corilagin [J].Colloid and Polymer Science,2003,281(8):766-770.
[24]Sionkowska A,Wisniewski M,Skopinska J,Kennedy C J,Wess T J.Molecular interactions in collagen and chitosan blends [J].Biomaterials,2004,25(5):795-801.
[25]Maxwell C A,Wess T J,Kennedy C J.X-ray diffraction study into the effects of liming on the structure of collagen [J].Biomacromolecules,2006,7(8):2321-2326.
[26]Meek K M,Quantock A J.The use of X-ray scattering techniques to determine corneal ultrastructure [J].Progress in Retinal and Eye Research,2001,20(1):95-137.
[27]Zhang Z,Li G,Shi B.Physicochemical properties of collagen,gelatin and collagen hydrolysate derived from bovine limed split wastes [J].Journal of the Society of Leather Technologists and Chemists,2006,90(1):23-28.
[28]Usha R,Ramasami T.The effects of urea andn-propanol on collagen denaturation:using DSC,circular dichroism and viscosity [J].Thermochimica Acta,2004,409(2):201-206.
[29]He L,Mu C,Shi J,Lin W.Modification of collagen with a natural cross-linker,procyanidin [J].Ⅰnternational Journal of Biological Macromolecules,2011,48(2):354-359.
[30]da Costa Lopes A M,João K G,Morais A R C,Morais A R,Bogel-Lukasik E,Bogel-lukasik R.Ionic liquids as a tool for lignocellulosic biomass fractionation [J].Sustain.Chem.Process,2013,1(3):3-33.
