自污染染料中筛选的菌对颜料紫1的脱色
2015-08-19胡翠英沈玉婷李良智钱玮郭伟强
胡翠英,沈玉婷,李良智,钱玮,郭伟强
(苏州科技学院化学生物与材料工程学院,江苏 苏州215009;江苏省环境功能材料重点实验室, 江苏 苏州 215009)
随着染料和印染工业的发展,大量的印染废水排放到环境中,成为当前主要的水体污染源之一。染料废水处理的重点和难点都体现在色度的消除(即脱色)。目前对染料脱色的方法较多,如吸 附[1-3]、絮凝[4-5]、化学氧化[6-7]、生物处理等。其中生物处理由于其具有低消耗、环境友好的优势受到广泛关注。常见生物处理涉及的菌主要有:真菌,如双孢菇对偶氮染料的降解[8]、白腐真菌对活性红等5种染料的脱色[9];细菌,如Bacillus cohniiMTCC 3616对偶氮染料的降解[10]、苍白杆菌对孔雀绿的降解[11]、Leucobactersp.对深蓝K-R、活性红等的脱色[12];混合菌[13]等。从机制上讲,上述菌种有的是对染料降解脱色,有的是吸附脱色。当然也有的只提到脱色,但脱色并不总意味着对染料的降解,具体机制还需要进一步分析[14]。总的说来,微生物菌种对于染料的降解或者脱色,在实际工业上的应用还很少。因此,筛选和发现新的微生物菌株来处理染料废水等对于环境化学工业具有重要的意义。
本工作首先对于实验室中偶然发现的广告浓缩玫瑰红染料(主要显色原料颜料紫1)中长出的菌进行了筛选,获得了一株纯种菌株。研究采用分子生物学手段,对分离获得的该菌株进行提取其DNA分析,并利用生物信息学的方法,进行序列相似性比较,构建序列进化树,确定其与相关物种的亲缘关系,进行菌种鉴定。然后,通过在培养基中加入颜料紫1,探讨该菌对颜料的脱色情况,深入研究培养条件对脱色率的影响;最后,综合FTIR分析的结果,对脱色原理进行了初步的分析。
1 材料方法
1.1 材料和培养基
菌种来源:一瓶长满菌苔的玫瑰红广告浓缩染料,其主要显色原料成分为颜料紫1。颜料紫1结构图见图1。颜料紫1由吴江山湖化工有限公司免费提供。
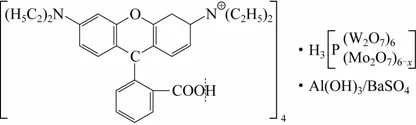
图1 颜料紫1结构图
活化培养基:察氏培养基。
利用平板和摇瓶培养分离菌种、斜面保藏菌种。单因素实验在察氏培养基中根据实验目的加入不同浓度的颜料紫1、NaNO3,加入相同含量的不同碳源,调节不同pH值条件,30℃培养10天。
在单因素实验基础上,利用Design expert软件设计响应面方案并分析结果,得出较佳培养条件。
1.2 颜料紫1含量测定方法
采用紫外可见分光光度计(北京普析的T6新世纪)对颜料紫1进行吸收峰扫描,得出在557nm波长下,颜料紫有最大吸收峰。制备标准曲线。
发酵液经4℃、14000r/min 离心10min,使得发酵液中的菌体沉淀,将上清液转移到试管中。将分离到的上清液再经循环水式多用真空泵抽滤,进一步去除上清液中可能残留的菌体及较大颗粒性物质。加入适量蒸馏水进行稀释,在557nm 波长下用紫外可见分光光度计测OD 值。以蒸馏水为空白组,分别测定实验组①、②、③和对照组的OD值A1、A2、A3、A0,代入颜料紫标准曲线方程,求出对应的脱色率X。脱色率计算公式如式(1)。

1.3 发酵前后颜料紫1的FTIR分析
发酵液14000r/min 离心10min;向上清液中加入等体积的乙酸乙酯,用无水NaSO4过夜干燥,过滤;取上清液,用旋转蒸发仪蒸干,取出干燥物,烘干;向烘干物中以5∶95的比例加入KBr,混匀,压成片;利用傅里叶变换红外光谱仪(Spectrum BXII)(FTIR)测定。
2 结 果
2.1 菌种培养与分子鉴定
自颜料中分离得到的菌经培养、平板分离得到单菌落,经镜检(图2)初步判断为曲霉。利用ITS4、ITS5作为上下游引物,对菌种18S rDNA扩增,得到扩增产物(图3),条带大小约为650 bp。经由上海生工测序,结果如下。

图2 未知菌的孢子图

图3 PCR产物电泳分析
TGGAAGTAAAAGTCGTAACAAGGTTTCCG TAGGTGAACCTGCGGAAGGATCATTACTGAGT GCGGGCTGCCTCCGGGCGCCCAACCTCCCACC CGTGAATACCTAACACTGTTGCTTCGGCGGGG AACCCCCTCGGGGGCGAGCCGCCGGGGACTA CTGAACTTCATGCCTGAGAGTGATGCAGTCTG AGTCTGAATATAAAATCAGTCAAAACTTTCAA CAATGGATCTCTTGGTTCCGGCATCGATGAAG AACGCAGCGAACTGCGATAAGTAATGTGAATT GCAGAATTCAGTGAATCATCGAGTCTTTGAAC GCACATTGCGCCCCCTGGCATTCCGGGGGGCA TGCCTGTCCGAGCGTCATTGCTGCCCATCAAG CCCGGCTTGTGTGTTGGGTCGTCGTCCCCCCC CGGGGGACGGGCCCGAAAGGCAGCGGCGGCA CCGTGTCCGGTCCTCGAGCGTATGGGGCTTTG TCACCCGCTCGACTAGGGCCGGCCGGGCGCCA GCCGACGTCTCCAACCATTTTTCTTCAGGTTGA CCTCGGATCAGGTAGGGATACCCGCTGAACTT AAGCATATCAATAAGCGGAGGAA。通过提交到NCBI数据库中,进行核酸比对,利用MEGA6.06软件建立进化树(图4),发现本研究所筛选出的菌株与杂色曲霉(Aspergillus versicolor)有高度的同源性。
2.2 单因素实验结果
初步的研究-明:培养基颜色明显变浅的最短时间为10天,故培养周期均为10天。染料超过一定范围对菌的生长有抑制作用[15-16],是影响脱色率的重要因素。本研究中用察氏培养基进行培养时,加入不同浓度的颜料紫1,实验结果见图5。浓度在200mg/L处,最大脱色率为52.9%。碳源是影响菌体生长的重要因素之一,本实验探讨了4种碳源(图6)。结果显示:碳源为葡萄糖时,染料的脱色效率最高,达到41.59%。乳糖与蔗糖做碳源时脱色率接近,但较葡萄糖为碳源时低。用微晶纤维素做碳源时,脱色率为0,说明此菌不能降解纤维素发酵。
NaNO3属于中性盐,可以改变培养基的渗透压,改变细胞膜渗透性,影响菌体生长。该真菌的生长不需要太高浓度的NaNO3,氮源浓度低至NaNO30.5g/L时,脱色效率反而较高(图7)。
染料的脱色率与pH值也是密切相关的,pH值较低时(低于5.0),染料的脱色率较差(图8),而在pH=5.5时,能够取得较好的实验结果。pH值不仅对染料被脱色降解的速率有很大的影响,宏观上还对菌丝球的形态、结构有很大的影响。在pH值低至4.50时,菌丝球结构脆弱、不易成形,往往为松散的糊状。pH值在5.50~6.00时,形态结构紧致、呈饱满的圆球状。而高于6.50时,菌丝球又会发生膨胀、甚至出现松散。

图4 进化树
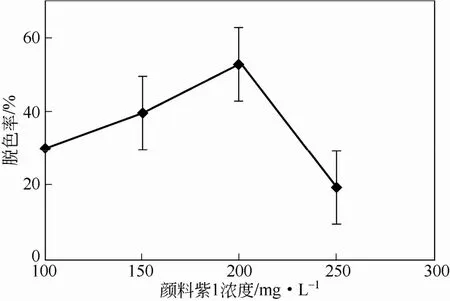
图5 颜料紫1浓度对脱色率的影响
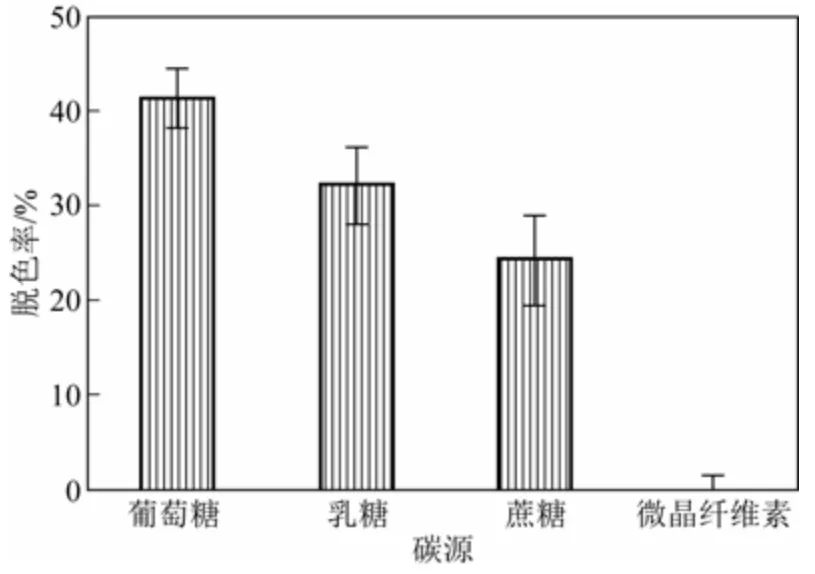
图6 碳源对脱色率的影响
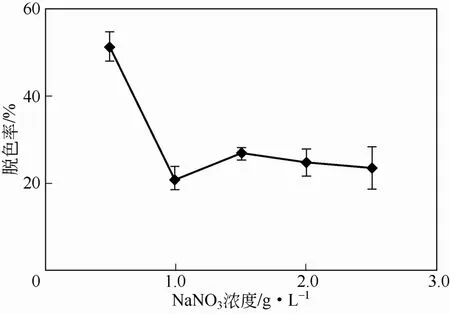
图7 NaNO3浓度对脱色率的影响

图8 pH值对脱色率的影响
2.3 响应面实验结果
依据单因素实验的结果,利用Design-expert设计响应面实验并分析实验结果(表1)。表2直观显示颜料紫1浓度200mg/L、NaNO3浓度0.5g/L、pH 值5.5的组合最有利于真菌对染料的脱色,平均脱色率可达78.03%。根据Box-Behnken的设计原理,拟合出二次回归方程为式(2)。

表1 响应面结果分析

表2 响应面设计及实验结果

式中,A、B、C均是3个因素的编码值,范围在-1~1。决定系数为R2=0.9176,回归模型的P值为0.0048<0.01,失拟P值=0.3851>0.1,说明模型回归极其显著,失拟不显著,因此可用于Aspergillus versicolor对颜料紫1脱色的理论预测,无需引入更高次项。其中AC、B2、C2影响显著,说明颜料紫1和NaNO3之间的相互作用影响脱色率。NaNO3浓度和pH值与脱色率间不是呈直线关系,而呈曲线关系。响应面分析图见图9。pH值5.5时,NaNO3浓度在0~0.8g/L范围内、颜料浓度>160mg/L时,可以获得最高的脱色率;NaNO3浓度确定为0.5g/L时,最高脱色率的染料浓度范围为160mg/L以上,pH值范围为5.3~5.7;染料浓度确定为200mg/L时,NaNO3浓度在0.1~0.8g/L范围内、pH值5.3~5.7范围内效果最佳,取得最大脱色率。综合分析三因素的最佳范围为:颜料紫1浓度>160mg/L,0.8g/L>NaNO3浓度>0.1g/L,5.7>pH值>5.3。利用Box-Behnken中的Optimization优化得到的较优值为颜料紫1浓度为250mg/L,NaNO3浓度为0.3g/L,pH值 5.5,脱色率可达到84.64%。此方案及预测值与响应面方案中第17个实验和结果接近。
2.4 FTIR测定结果
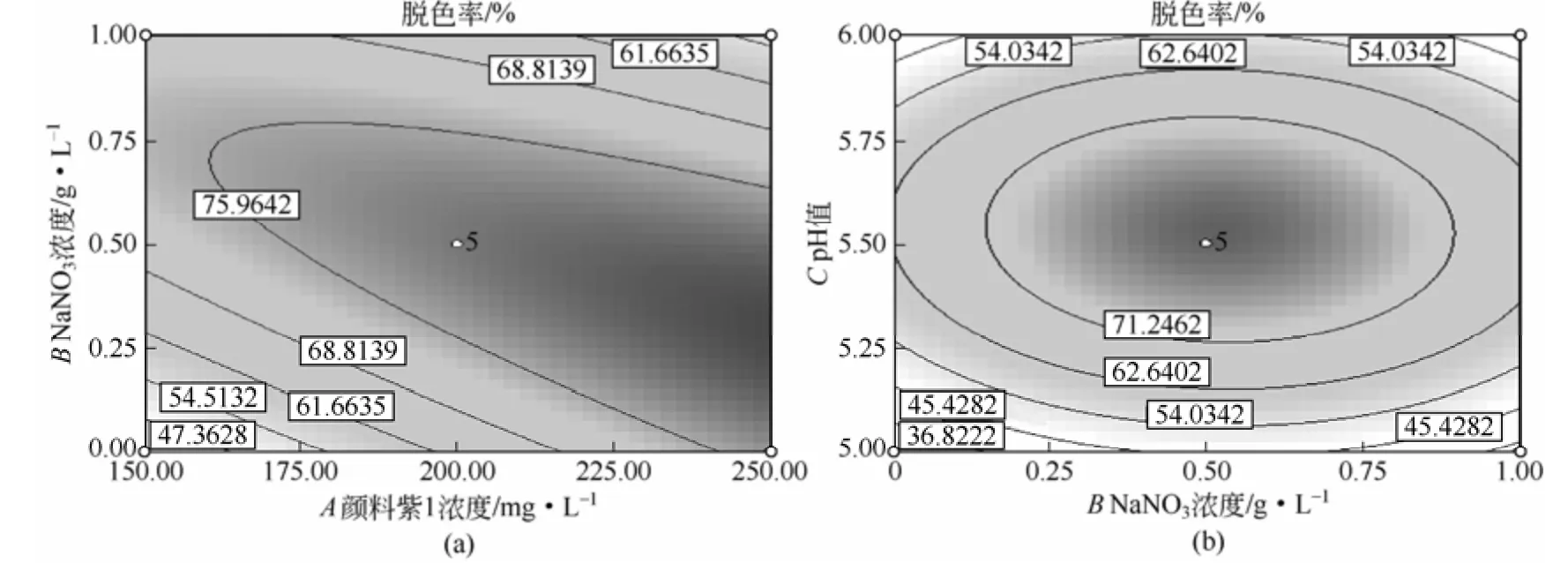
图9 响应面分析图

图10 发酵前后颜料紫1的FTIR分析图
利用FTIR分析发酵前后颜料紫1结构的变化,频率在400~4000cm-1,研究结果见图10,除了因为检测时压饼的量不同导致发酵后的吸光值较高外,总体而言发酵前后峰形基本没很大区别。箭头所示区域约频率为1700cm-1处是—C=O—基团吸收区,发酵后的吸收值较大,这与发酵后颜料紫1结构中—OH上的—H(见图8)发生移动有关。频率在1000~1400cm-1处是=CH—O—CH=的指纹图区域,发酵前后没什么变化,说明=CH—O—CH=没有被破坏。由此可以判断颜料紫1的结构基本没有发生大的变化,发酵过程中发生脱色现象的原因应该只是菌体对它的吸附。这也进一步解释了为何影响脱色的因素与菌体生长量有一定的正相关。
3 分析讨论
杂色曲霉(Aspergillus versicolor)又称为花斑曲霉,目前Aspergillus versicolor因为其产生了相当数量的细胞毒性化合物以及其他的生物活性化合物而受到人们的广泛关注[17-20]。也有利用杂色曲霉吸附金属元素,如吸附铅[21],吸附Cr(Ⅵ)、Ni(Ⅱ)、Cu(Ⅱ)等[22],减少金属释放到水中,降低水污染;有的研究了Aspergillus versicolor对有机物的降解,如用Aspergillus versicolor生物降解共聚物丁二酸/己二酸-丁二醇酯(PBSA)薄膜[23],效果很好;由Aspergillus versicolor解毒和消除雌激素4-壬基酚[24]。Aspergillus versicolor也被用于脱色,如对雷马素蓝活性染料(Remazol Blue Reactive textile dye)[22,25]的吸附脱色,但对脱色的原因没有具体分析。本研究首次深入分析了Aspergillus versicolor对颜料紫1的脱色,并且利用FTIR比较了发酵前后颜料紫1结构的变化,研究结果表明了该菌对颜料紫1的脱色机制主要是吸附脱色。生物吸附脱色的机理有很多[26],包括物理化学吸附、离子交换、配位络合、螯合、静电作用、微量沉淀等。本研究中通过单因素实验和响应面法优化分析,得出盐离子浓度和pH值的变化都会导致脱色率的不同。究其原因,一方面是菌体量发生变化;另一方面菌体表面结构、电荷以及颜料结构都会发生变化,所以离子交换、氢键的建立等都会导致吸附量不同,改变脱色率。
4 结 论
对一株从污染的广告颜料中分离的菌进行了筛选、镜检分析和分子鉴定。确定了该菌为杂色曲霉(Aspergillus versicolor)。首次对采用该菌对颜料紫1的脱色进行了较系统的研究,其中脱色的主要机制经过红外光谱分析确定为吸附脱色。此外,通过研究分析发现适合该菌生长的碳源为葡萄糖,综合单因素实验和响应面优化研究得出脱色实验过程NaNO3浓度在0.3g/L、pH值在5.5、颜料紫1的浓度约为250mg/L为最佳条件。对于吸附脱色的动力学研究与吸附脱色原理还有待进一步分析。
[1] Sharma P ,Kaur H ,Sharma M ,et al. A review on applicability of naturally available adsorbents for the removal of hazardous dyes from aqueous waste[J].Environ. Monit. Assess.,2011,183:151-195.
[2] Chowdhury S,Chakraborty S,Saha P D. Response surface optimization of a dynamic dye adsorption process:A case study of crystal violet adsorption onto NaOH-modified rice husk[J].Environ. Sci. Pollut. Res.,2013,20(3):1698-1705.
[3] Sun D,Zhang X ,Wu Y ,et al. Kinetic mechanism of competitive adsorption of disperse dye and anionic dye on fly ash[J].Int. J. Environ. Sci. Technol.,2013,10(4):799-808.
[4] Yuan Y L,Wen Y Z,Li X Y,et al. Treatment of wastewater from dye manufacturing industry by coagulation[J].J. Zhejiang Univ. Sci. A,2006,7(S2):340-344.
[5] Parsa J B,Chianeh F N. Evaluation of electro-coagulation method for decolorization and degradation of organic dyes in aqueous solutions[J].Korean J. Chem. Eng.,2012,29(11):1585-1590.
[6] Bhowon M G,Laulloo S J,Wah H L K,et al. Chemistry Education in the ICT Age[M]. America:Springer Netherlands,2009:225-234.
[7] Vinodgopal K,Peller J. Hydroxyl radical-mediated advanced oxidation processes for textile dyes:A comparison of the radiolytic and sonolytic degradation of the monoazo dye Acid Orange 7[J].Res. Chem. Intermed.,2003,29(3):307-316.
[8] 刘新颖,朱启忠,赵春媛,等. 双孢菇漆酶酶学性质及染料脱色初探[J]. 食用菌,2010(14):182-183.
[9] Kapdan I ,Kargi F,Mcmullan G,et al. Comparison of white-rot fungi cultures for decolorization of textile dyestuffs[J].Bioprocess. Eng.,2000,22(4):347-351.
[10] Prasad A S A ,Rao K V B. Aerobic biodegradation of Azo dye byBacillus cohniiMTCC 3616;an obligately alkaliphilic bacterium and toxicity evaluation of metabolites by different bioassay systems[J].Appl. Microbiol. Biotechnol.,2013,97(16):7469-7481.
[11] Vijayalakshmidevi S R,Muthukumar K. Biodegradation of malachite green byOchrobactrumsp.[J].World J. Microbiol. Biotechnol.,2014,30(2):429-437.
[12] 李慧,曲媛媛,时胜男,等. 一株高效广谱染料降解细菌的分离鉴定及其脱色特性初探[J]. 微生物学通报,2011,38(4):523-530.
[13] Bhawana P,Fulekar M H. Bioremediation of dyestuff compounds using indigenous microorganism in a bioreactor[J].Procedia APCBEE,2012,1(1):27-33.
[14] Dellai A,Dridi D,Lemorvan V,et al. Decolorization does not always mean detoxification:Case study of a newly isolatedPseudomonas pelifor decolorization of textile wastewater[J].Environ. Sci. Pollut. Res.,2013,20(8):5790-5796.
[15] 张朝晖,夏黎明,林建平,等. 黄孢原毛平革菌所产木素过氧化物酶系对染料降解的研究[J]. 环境污染与防治,2002,24(2):71-76.
[16] 李慧蓉,陈武,陈和谦. 黄孢原毛平革菌对三苯甲烷染料的生物脱色降解[J]. 上海环境科学,2003,22(11):738-742.
[17] Belofsky G N,Renner M K,Fenical W,et al. New cytotoxic sesquiterpenoid nitrobenzoyl esters from a marine isolate of the fungusAspergillus versicolor[J].Tetrahedron,1998,54(9):1715-1724.
[18] Lee Y M,Li H Y,Hong J,et al. Bioactive metabolites from the sponge-derived fungusAspergillus versicolor[J].Arch. Pharm. Res.,2010,33(2):231-235.
[19] Chung D H,Abouzied M M,Pestka J J. Immunochemical assay applied to mycotoxin biosynthesis:ELISA comparison of sterigmatocystin production byAspergillus versicolorandAspergillus nidulans[J].Mycopathologia,1989,107(2-3):93-100.
[20] Carvalho M R,Barbosa L C A,Queiróz J H,et al. Novel lactones fromAspergillus versicolor; production of sterigmatocystin byAspergillus versicolorQM 432 used in fungus resistance tests for United States military specifications[J].Tetrahedron Lett.,2001,42(5):809-811.
[21] Bairagia H,Khan M M R,Ray L,et al. Adsorption profile of lead onAspergillus versicolor:A mechanistic probing[J].J. Hazard. Mater.,2011,186(1):756-764.
[22] Tastan B E,Ertuğrul S,Dönmez G. Effective bioremoval of reactive dye and heavy metals byAspergillus versicolor[J].Bioresour. Technol.,2010,101(3):870-876.
[23] Zhao J H,Wang X Q,Zeng J,et al. Biodegradation of poly(butylene succinate-co-butylene adipate) byAspergillus versicolor[J].Polym. Degrad. and Stabil.,2005,90(1):173-179.
[24] Krupiński M,Szewczyk R,Dlugoński J. Detoxification and elimination of xenoestrogen nonylphenol by the filamentous fungusAspergillus versicolor[J].Int. Biodeterior. and Biodegrad.,2013,82:59-66.
[25] Gül Ü D,Dönmez G. Effects of dodecyl trimethyl ammonium bromide surfactant on decolorization remazol blue by a livingAspergillus versicolorstrain[J].J. Surfactants Deterg.,2012,15(6):797-803.
[26] Asgher M. Biosorption of reactive dyes:A review[J].Water Air Soil Pollut.,2012,223(5):2417-2435.
