不同晶相结构二氧化锰催化完全氧化乙醇
2015-08-15张江浩张长斌中国科学院生态环境研究中心大气污染控制中心环境模拟与污染控制国家联合重点实验室北京100085
张 洁 张江浩 张长斌 贺 泓(中国科学院生态环境研究中心大气污染控制中心,环境模拟与污染控制国家联合重点实验室,北京100085)
不同晶相结构二氧化锰催化完全氧化乙醇
张洁张江浩张长斌贺泓*
(中国科学院生态环境研究中心大气污染控制中心,环境模拟与污染控制国家联合重点实验室,北京100085)
采用水热合成法制备了α-MnO2、β-MnO2、γ-MnO2和δ-MnO2催化剂,运用N2吸脱附实验、X射线衍射(XRD)、X射线光电子能谱(XPS)和H2程序升温还原(H2-TPR)等方法对催化剂进行了表征,并将催化剂用于催化完全氧化乙醇反应中,考察了不同晶型MnO2催化剂催化氧化乙醇活性的差异,探讨了催化剂晶型结构与催化氧化活性的关联.结果表明,不同晶型的MnO2催化剂催化氧化乙醇活性差异显著,活性顺序为α-MnO2>δ-MnO2>γ-MnO2>β-MnO2.系列表征结果显示,晶体结晶度和比表面积不是影响不同晶型MnO2催化剂活性的主要原因,α-MnO2催化剂具有的较高晶格氧浓度和较高的可还原性是其具有良好催化氧化乙醇活性的关键因素.
MnO2催化剂;低温催化氧化;乙醇完全氧化;挥发性有机物;晶格氧
www.whxb.pku.edu.cn
1 引言
挥发性有机物(VOCs)是大气污染的主要来源之一,是大气细粒子(PM2.5)的主要前驱物之一,1降低VOCs的排放对保护人类健康和生态环境具有重要意义.乙醇作为一种常见的挥发性有机物,存在于以乙醇为混合燃料的机动车尾气中,乙醇混合汽油为动力的机动车尾气中释放的乙醇气体及其部分氧化产物乙醛,对人体健康具有直接危害.2,3随着乙醇添加燃料在我国的推广普及,针对机动车尾气中乙醇污染物高效去除手段的研究具有重要的环境意义和社会价值.
催化氧化法因具有转化率高,起燃温度低,工艺简单,节约能源和无二次污染等优点,已成为广泛应用的醇类污染物去除手段.现有催化氧化方法中使用的催化剂主要分为两大类:贵金属催化剂和金属氧化物催化剂.在贵金属催化剂中,Pt、Pd、Au、Ru已被研究作为氧化乙醇的催化剂;4-6金属氧化物催化剂中,Cu、Cr、V、Co、Ce、Mn氧化物是常用的乙醇等有机污染物氧化催化剂.7-13目前,某些金属氧化物催化剂已经可以达到和贵金属催化剂相近的低温催化氧化活性,Wang和Li10报道了以Mn-SO4为前驱体制备的OMS-2型锰氧化物催化剂催化乙醇完全氧化为CO2的温度仅为160°C,活性优于贵金属催化剂.金属氧化物催化剂使用成本低廉并具有很好的抵抗反应中有毒物质的能力.基于以上优点,关于金属氧化物催化剂用于催化完全氧化乙醇的研究具有很高的现实意义.
在众多氧化物催化剂中,锰氧化物具有优异的催化氧化活性,越来越多的学者将研究重点转向此处,以期研制出更为高效实用的催化剂.14-17其中MnO2催化剂是近期的研究热点,它由[MnO6]八面体基元通过不同排列方式形成不同的晶型结构,如α-、β-、γ-、δ-MnO2等,18-21晶格结构和晶胞参数不同,催化性能也存在很大差别.22-25Liang等22研究了α-、β-、γ-、δ-MnO2催化剂CO氧化活性的差异,发现催化剂对CO的吸附能力、Mn―O键强度和Mn物种的氧化还原过程是影响催化剂活性的主要原因.Xu等23制备了α-、β-MnO2为载体的Ag-MnO2催化剂,通过对比催化剂CO氧化性能,发现晶体结构和表面结构是影响催化剂活性的主要因素.戴韵等24制备了α-、δ-MnO2,并考察了其低温NH3选择性催化还原(NH3-SCR)NOx的性能,研究发现比表面积不是影响两种MnO2催化剂活性的主要因素,影响活性的主要因素是催化剂的晶相结构和表面性质.李经纬等25采用水热法分别合成了α-、β-、γ-MnO2纳米棒,考察了其催化氧化氯苯的能力差异,发现三种晶型MnO2纳米棒中氧物种的可还原能力与晶格氧的相对含量是影响其催化氧化活性的主要因素.上述研究都发现了晶型的差异会导致MnO2催化剂活性的差别,因此进行不同晶型MnO2催化乙醇性能的研究对寻找和制备具有更高催化性能的锰氧化物催化剂具有重要意义.
本文通过水热合成法制备了α-、β-、γ-、δ-MnO2催化剂,比较了它们催化乙醇气体完全氧化的活性,探索了晶体结构对催化剂乙醇完全氧化活性的影响.
2 实验部分
2.1催化剂的制备
利用水热合成法制备不同晶型的MnO2催化剂.10,22α-MnO2,0.525 g MnSO4·H2O(国药集团化学试剂有限公司,分析纯)和1.25 g KMnO4(国药集团化学试剂有限公司,分析纯)混合于80 mL去离子水中,添加2 mL浓HNO3(国药集团化学试剂有限公司,分析纯),磁力搅拌1 h,将混合溶液移至100 mL的特氟龙反应釜中,100°C水热反应24 h.β-MnO2,1.69 g MnSO4·H2O(国药集团化学试剂有限公司,分析纯)和2.28 g(NH4)2S2O8(天津市福晨化学试剂厂,分析纯)混合于80 mL去离子水中,搅拌1 h,将混合溶液移至100 mL的特氟龙反应釜中,140°C水热反应12 h.γ-MnO2,3.375 g MnSO4·H2O(国药集团化学试剂有限公司,分析纯)和4.575 g (NH4)2S2O8(天津市福晨化学试剂厂,分析纯)混合于80 mL去离子水中,搅拌1 h,将混合溶液移至100 mL的特氟龙反应釜中,90°C水热反应24 h.δ-MnO2,0.275 g MnSO4·H2O(国药集团化学试剂有限公司,分析纯)和1.5 g KMnO4(国药集团化学试剂有限公司,分析纯)混合于80 mL去离子水中,搅拌1 h,将混合溶液移至100 mL的特氟龙反应釜中,240°C水热反应24 h.19将以上反应得到的固体氧化物多次洗涤至中性,置于100°C干燥过夜,得到固体样品经400°C焙烧2 h后研磨至40-60目备用.
2.2催化剂的表征
N2吸附-脱附实验使用美国Quantachrome公司的Autosorb-iQ-1MP自动吸附装置,在-196°C(77 K)温度下,用液氮吸附法测定.测量前,将样品在氮气流中100°C持续加热1 h以除去样品表面吸附水,然后在300°C持续4 h真空脱气.测定了催化剂的比表面积,孔容和孔径.粉末X射线衍射(XRD)分析使用瑞士Bruker公司D8-ADVANCE射线衍射仪,入射光源为Cu Kα辐射,管电压40 kV,管电流40 mA,扫描范围10°-90°,扫描速率4(°)·min-1.实验采用日本ULVAC-PHI公司的PHI Quantera型扫描X射线光电子能谱仪对样品进行分析.采用Al Kα(1486.7 eV)作为X射线靶,所有元素的结合能用C 1s(284.8 eV)校正电荷位移,扫描步长为0.1 eV.程序升温还原(H2-TPR)测试采用美国Micro公司Auto Chem II 2920化学吸附仪,以10%(体积分数,φ)H2/ Ar混合气为还原气,样品用量为30 mg,以10°C· min-1的速率升温至900°C.
2.3催化剂的评价
在自制的石英管微型固定床反应器中评价了催化剂的乙醇氧化反应性能.反应过程中采用的乙醇浓度为800×10-6(φ),O2浓度为20%(φ),N2为平衡气,反应气总流量为100 mL·min-1.催化剂用量为50 mg,为消除内外扩散影响,采用40-60目的催化剂进行评价,空速(GHSV)约为36000 h-1.40-220° C,每隔10或20°C,采集2-3个数据点,平衡时间为1.5 h.采用气相色谱Agilent 7890(美国安捷伦公司)对产物进行检测,气相色谱配有Porapak-Q色谱柱,采用热导检测器(TCD)检测乙醇、乙醛和CO2等产物.碳平衡达到100%±5%.
乙醇转化率(X),乙醛和二氧化碳(CO2)生成率(Y)分别由以下公式计算而得:


图1 不同晶型的MnO2催化剂氧化乙醇反应的乙醇转化率(A),乙醛生成率(B)和CO2生成率(C)Fig.1 Ethanol conversion(A),acetaldehyde yield(B),and CO2yield(C)of MnO2catalysts with different phase structures during ethanol oxidation reactionreaction conditions:800×10-6(volume fraction,φ)ethanol,20%(φ)O2,N2as balance gas;gaseous hourly space velocity(GHSV):36000 h-1
3 结果与讨论
3.1不同晶型MnO2氧化乙醇活性
不同晶型的MnO2氧化物催化氧化乙醇的活性如图1所示.四种晶型MnO2催化剂对乙醇均有较高的催化氧化活性,特别是低温活性远高于相关文献报道的,包括贵金属负载型催化剂、4-6锰氧化物、26Cu-Mn27和Mn-Ce28催化剂.从图1A中可以看出,不同晶型的MnO2氧化物催化剂对乙醇氧化反应活性具有很大差异,乙醇氧化活性排序为α-MnO2>δ-MnO2>γ-MnO2>β-MnO2.α-MnO2催化剂活性最优,在120°C即可将反应气中的乙醇气体完全转化;β-MnO2催化剂活性最差,其完全转化乙醇的温度为180°C.如图1B所示,δ-MnO2催化剂氧化乙醇气体反应中,有害副产物乙醛的生成率最低,最高产率小于30%;γ-、β-MnO2乙醇氧化反应过程中副产物乙醛的生成率较高,最高达80%,对于多步氧化反应而言,反应物或中间产物在催化剂表面的强吸附可能会占据催化剂的活性位,从而降低反应活性,因此较高的乙醛生成率导致了其乙醇完全氧化活性大大降低.如图1C所示,α-、β-、γ-、δ-MnO2催化剂将乙醇完全氧化为CO2的温度分别为140,220,200,160°C.可以看出γ-和δ-MnO2两种催化剂二氧化碳生成率的差别与两者乙醇转化率的差别相比更大,说明虽然乙醇的转化率在γ-和δ-MnO2上几乎一样,但是在γ-MnO2催化剂上,更多的乙醇被部分氧化生成乙醛,从而导致两者完全氧化乙醇为CO2的活性存在较大差异.β-MnO2同样有大量乙醇被部分氧化生成乙醛,导致在该催化剂上乙醇完全氧化为CO2的温度远远高于其它三种晶型的MnO2催化剂.
3.2物理性质与晶体结构
不同晶相MnO2催化剂的XRD图如图2所示. 图2a在2θ为12.7°、18.0°、25.5°、37.4°、41.8°、52.0°、55.3°和60.0°处分别出现对应α-MnO2四方晶相(110)、(200)、(310)、(211)、(301)、(411)、(600)和(521)晶面的衍射峰,氧化物的晶型结构完全符合α-MnO2结构(JCPDS 44-0141).图2b在2θ为28.6°、37.3°、41.0°、42.8°、56.7°和59.4°处分别出现对应β-MnO2的(110)、(101)、(200)、(111)、(211)和(220)晶面的衍射峰,衍射峰归属于β-MnO2的四方晶系(JCPDS 24-0735).图2c在2θ为22.3°、37.1°、42.3°和56.9°处分别出现对应γ-MnO2的(120)、(131)、(300)和(160)晶面的衍射峰,归属为γ-MnO2(JCPDS 14-0644).图2d在 2θ为12.3°、25.1°和37.2°处分别出现对应δ-MnO2的(001)、(002),和(111)晶面衍射峰,归属为δ-MnO2(JCPDS 80-1098)结构.与α-、β-MnO2相比,γ-、δ-MnO2的XRD的衍射峰强度低,峰形展宽大,表明γ-、δ-MnO2这两种氧化物的结晶度较低.对比这四种晶型MnO2催化剂催化氧化乙醇性能的结果,发现结晶度对催化剂活性的影响效果不显著,李经纬等25的研究中也发现,MnO2催化剂的结晶程度不是影响其活性的主要原因.
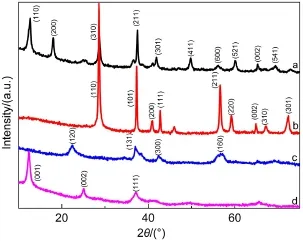
图2 不同晶相MnO2催化剂的XRD谱图Fig.2 XRD patterns of MnO2catalysts with different phase structures(a)α-MnO2,(b)β-MnO2,(c)γ-MnO2,(d)δ-MnO2
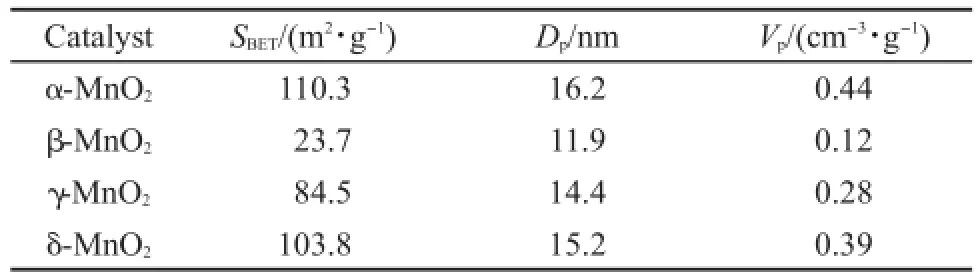
表1 不同晶相MnO2催化剂的物理性质Table 1 Physical properties of MnO2catalysts with different phase structures
表1是四种催化剂样品通过N2-吸附-脱附实验得到的催化剂样品比表面积(SBET),平均孔径(DP)和总孔容(VP)等孔结构参数.结果表明,四种不同晶型MnO2催化剂的比表面积差异显著,其比表面积变化规律为α-MnO2>δ-MnO2>γ-MnO2>β-MnO2.
由于不同晶型的MnO2比表面积差异显著,为了扣除比表面积对催化剂活性的影响,在110°C条件下,不同MnO2催化剂的比活性进行了单位面积归一化换算研究,结果列于表2中.其中,计算所用的比表面积为各个MnO2催化剂根据BET方法计算所得的表面积.可以看出归一化之后,催化剂在110°C时的催化活性顺序为α-MnO2>δ-MnO2>γ-MnO2>β-MnO2,说明催化剂的比表面积不是影响MnO2催化剂活性的主要因素.
3.3不同晶型MnO2催化剂的H2-TPR分析
采用H2-TPR方法对不同催化剂可还原性进行了表征,结果如图3所示.α-、β-、γ-、δ-MnO2催化剂H2气还原峰峰型具有很大差异.α-MnO2氧化物在280和310°C分别出现两个H2消耗峰,经过分峰处理得到此两处的氢气消耗量分别为6.87和3.79 mmol·g-1,与理论上还原过程中H2消耗量比例(2:1)相近,表明这两个还原过程分别对应了MnO2→Mn3O4和Mn3O4→MnO.24,25β-MnO2氧化物的第一个主要还原峰出现在290°C,该还原过程由两部分叠加而成,通过分峰计算,其第一峰氢气总消耗量为7.41 mmol·g-1,第二个还原峰出现在400°C,氢气消耗量为3.71 mmol·g-1,同样对应于MnO2→Mn3O4→MnO的还原过程,其高温还原峰出现温度远大于α-MnO2.γ-MnO2催化剂的还原峰与β-MnO2相似,但向低温方向偏移,分别位于280和380°C处.δ-MnO2氧化物具有总包H2消耗峰,根据峰型可分成3个叠加峰,分别出现在280、293和320°C,经过分峰处理得到此三处的氢气消耗量分别为5.4、1.9和4.2 mmol·g-1,分别对应了MnO2→Mn2O3,Mn2O3→Mn3O4和Mn3O4→MnO,这与叶青等31的研究结果相似.四种晶型催化剂的H2-TPR实验结束后样品均变为绿色,总氢气消耗量在10.66-11.48 mmol·g-1之间,H/Mn摩尔比均约等于2,这对应了MnO2还原至MnO的消耗量,说明四种晶型MnO2催化剂氢气还原的最终产物均MnO,也与样品最终形态匹配.
催化剂还原峰出现的温度范围越低,其可被还原的能力就越强,催化剂氧物种的流动性越好.因此,β-MnO2中氧物种的流动性要差于其他三种MnO2催化剂.值得注意的是,与δ-MnO2相比,α-MnO2的低温峰与δ-MnO2相近,但高温峰远低于δ-MnO2.α-MnO2的还原过程高度集中于250-320°C这个温度范围内,在320°C左右即完全还原为MnO,无论是还原温度区间还是还原终止温度均低于其它晶型的MnO2,因此α-MnO2催化剂中氧物种的流动性最优.综上所述,不同晶型MnO2催化剂氧物种流动性从优到劣的次序为α-MnO2>δ-MnO2>γ-MnO2>β-MnO2.
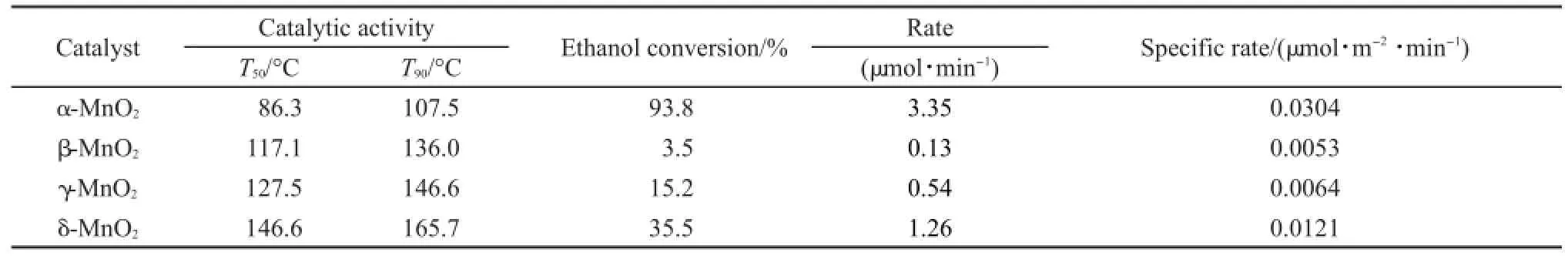
表2 MnO2催化剂上乙醇氧化T50,T90和单位表面积转化率Table 2 T50,T90,and specific rate of ethanol oxidation over the MnO2catalysts
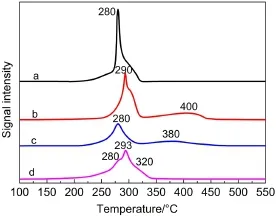
图3 MnO2催化剂的H2-TPR图Fig.3 H2-TPR profiles of MnO2catalysts(a)α-MnO2,(b)β-MnO2,(c)γ-MnO2,(d)δ-MnO2
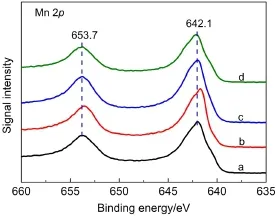
图4 MnO2催化剂中Mn 2p的XPS图Fig.4 Mn 2p XPS spectra of MnO2catalysts(a)α-MnO2,(b)β-MnO2,(c)γ-MnO2,(d)δ-MnO2
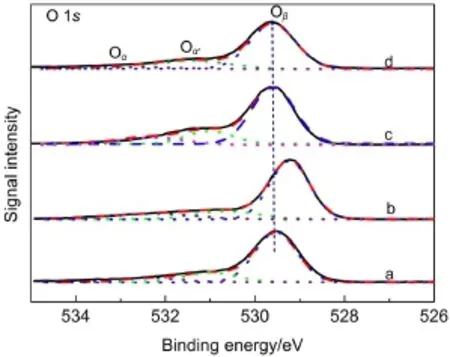
图5 MnO2催化剂中O 1s的XPS图Fig.5 O 1s XPS spectra of MnO2catalysts(a)α-MnO2,(b)β-MnO2,(c)γ-MnO2,(d)δ-MnO2
3.4不同晶型MnO2催化剂的XPS分析
图4和图5为不同晶型MnO2催化剂Mn 2p和O 1s的XPS图谱,用Peakfit软件对O 1s谱图进行了拟合,并计算了氧物种Oα、Oαʹ和Oβ的摩尔比例,结果汇总于表3.从图4中可以看出,α-、β-、γ-、δ-MnO2催化剂中Mn 2p2/3特征峰的结合能都位于642.1 eV左右,表明四种晶型MnO2中锰元素主要为Mn4+,25不同晶型MnO2催化剂表面Mn的价态相同.
由图5知,经过对O 1s分峰拟合,可将氧物种分为三种类型:Oβ、Oα和Oα'.结合能位于529.3-529.7 eV的氧物种Oβ归属于MnO2的晶格氧(O2-)31;结合能位于531.0-531.4 eV的氧物种Oαʹ归属于MnO2的表面氧(如O-、OH-、CO23-等);结合能位于532.4-532.8 eV左右的氧物种Oα归属于MnO2吸附的水分子.32从表3可知,α-、β-、γ-、δ-MnO2催化剂中晶格氧含量Oβ/(Oα+Oαʹ+Oβ)的摩尔比值依次为78.7%、69.5%、70.5%、75.5%,在这四种MnO2催化剂中,β-MnO2的晶格氧占总的氧物种的比例最低,α-MnO2的晶格氧含量最高,晶格氧相对含量的顺序为α-MnO2>δ-MnO2>γ-MnO2>β-MnO2.α-MnO2的晶格氧浓度高于其它三种催化剂,这与乙醇催化氧化反应中得到的活性数据相吻合.表面积归一化的活性结果中,γ-、β-MnO2催化剂单位比表面上的转化率相近,与两个晶格氧含量相近的结果吻合.在锰氧化物催化剂催化氧化醇类的反应中,催化剂的晶格氧是影响催化剂的重要因素,晶格氧含量高的催化剂其活性更好.17,33因此,在系列不同晶型催化剂中,α-MnO2催化剂具有最高的晶格氧含量是其具有最高反应活性的重要因素之一.
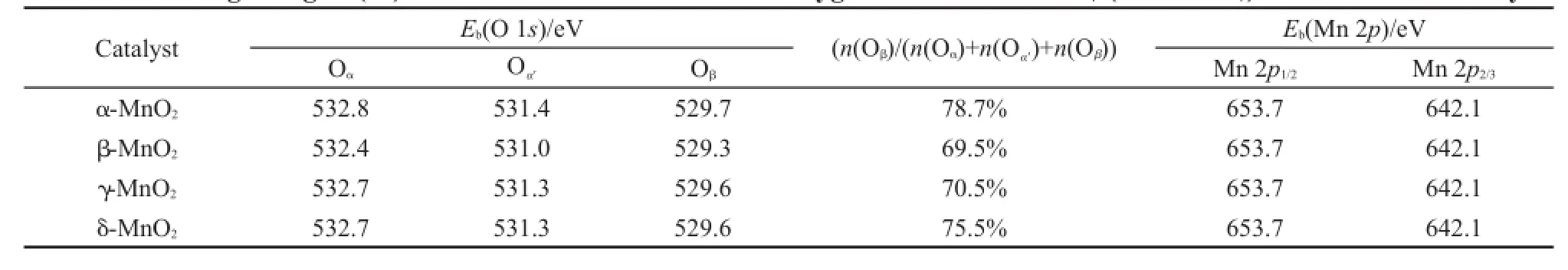
表3 MnO2催化剂的表面原子结合能(Eb)及晶格氧Oβ/(Oα+Oα'+Oβ)的摩尔比Table 3 Binding energies(Eb)of surface elements and lattice oxygen molar ratios of Oβ/(Oα+Oα'+Oβ)over the MnO2catalysts
4 结论
本文用水热合成法制备了具有不同晶型结构的α-MnO2、β-MnO2、γ-MnO2、δ-MnO2催化剂,考察了此类MnO2催化剂催化完全氧化乙醇的性能,并对催化剂进行了系列表征.结果表明,MnO2催化剂的晶体结构对其乙醇氧化活性具有重要影响;α-MnO2催化剂具有最优的低温乙醇氧化性能,乙醇完全转化的温度为120°C,并在140°C将乙醇完全氧化生成二氧化碳,β-MnO2催化剂的活性最差,乙醇完全氧化的温度高达220°C;通过比较催化剂的比表面积反应速度,可以看出不同晶型的MnO2催化剂的比表面积对反应活性影响不大.催化剂的活性主要受晶格氧含量和其流动性的影响.
References
(2)Grosjean,D.;Grosjean,E.;Gertler,A.W.Environ.Sci.Technol. 2001,35,45.doi:10.1021/es001326a
(3)Jacobson,M.Z.Environ.Sci.Technol.2007,41,4150.doi:10.1021/es062085v
(4)Avgouropoulos,G.;Oikonomopoulos,E.;Kanistras,D.;Ioannides,T.Appl.Catal.B:Environ.2006,65,62.doi:10.1016/j.apcatb.2005.12.016
(5)Cordi,E.M.;Falconer,J.L.J.Catal.1996,162,104.doi:10.1006/jcat.1996.0264
(6)Mitsui,T.;Tsutsui,K.;Matsui,T.;Kikuchi,R.;Eguchi,K.Appl. Catal.B:Environ.2008,81,56.doi:10.1016/j. apcatb.2007.12.006
(7)Idriss,H.;Seebauer,E.G.J.Mol.Catal.A 2000,152,201.doi:10.1016/S1381-1169(99)00297-6
(8)Li,H.J.;Tana;Zhang,X.J.;Huang,X.M.;Shen W.J.Catal. Commun.2011,12,1361.doi:10.1016/j.catcom.2011.05.016
(9)Ye,Q.;Gao,Q.;Zhang,X.R.;Xu,B.Q.Catal.Commun.2006,7,589.doi:10.1016/j.catcom.2006.01.023
(10)Wang,R.H.;Li,J.H.Environ.Sci.Technol.2010,44,4282. doi:10.1021/es100253c
(11)Zhao,P.;Wang,C.N.;He,F.;Liu,S.T.RSC Adv.2014,4,45665.doi:10.1039/C4RA07843H
(12)Liang,S.H.;Teng,F.;Yao,W.Q.;Zhu,Y.F.Acta Phys.-Chim. Sin.2008,24,205.[梁淑惠,滕飞,姚文清,朱永法.物理化学学报,2008,24,205.]doi:10.3866/PKU.WHXB20080205
(13)Li,J.W.;Zhao,P.;Liu,S.T.Appl.Catal.A:Gen.2014,482,363.doi:10.1016/j.apcata.2014.06.013
(14)Tang,X.F.;Li,Y.G.;Huang,X.M.;Xu,Y.D.;Zhu,H.Q.;Wang,J.G.;Shen,W.J.Appl.Catal.B:Environ.2006,62,265.doi:10.1016/j.apcatb.2005.08.004
(15)Morales,M.R.;Barbero,B.P.;Cadús,L.E.Appl.Catal.B:Environ.2007,74,1.doi:10.1016/j.apcatb.2007.01.008
(16)Njagi,E.C.;Chen,C.H.;Genuino,H.;Galindo,H.;Huang,H.;Suib,S.L.Appl Catal.B:Environ,2010,99,103.doi:10.1016/j. apcatb.2010.06.006
(17)Luo,J.;Zhang,Q.H.;Garcia-Martin z,J.;Suib,S.L.J.Am. Chem.Soc.2008,130,3198.doi:10.1021/ja077706e
(18)Ye,Q.;Zhao,J.S.;Huo,F.F.;Wang,D.;Cheng,S.Y.;Kang,T. F.;Dai,H.X.Microporous Mesoporous Mat.2013,172,20.doi:10.1016/j.micromeso.2013.01.007
(19)Wu,X.Q.;Zong,R.L.;Zhu,Y.F.Acta Phys.-Chim.Sin.2012,28,437.[吴小琴,宗瑞隆,朱永法.物理化学学报,2012,28,437.]doi:10.3866/PKU.WHXB201112082
(20)Sui,N.;Duan,Y.Z.;Jiao,X.L.;Chen,D.R.J.Phys.Chem.C 2009,113,8560.
(21)Lin,J.;Cai,F.;Zhang,G.Y.;Yang,L.F.;Yang,J.Y.;Fang,W. P.Acta Phys.-Chim.Sin.2013,29,597.[林健,蔡钒,张国玉,杨乐夫,杨金玉,方维平.物理化学学报,2013,29,597.]doi:10.3866/PKU.WHXB201301041
(22)Liang,S.H.;Teng,F.;Bulgan,G.;Zong,R.L.;Zhu,Y.F. J.Phys.Chem.C 2008,112,5307.doi:10.1021/jp0774995
(23)Xu,R.;Wang,X.;Wang,D.S.;Zhou,K.B.;Li,Y.D.J.Catal. 2006,237,426.doi:10.1016/j.jcat.2005.10.026
(24)Dai,Y.;Li,J.H.;Peng,Y.;Tang,X.F.Acta Phys.-Chim.Sin. 2012,28,1771.[戴韵,李俊华,彭悦,唐幸福.物理化学学报,2012,28,1771.]doi:10.3866/PKU.WHXB201204175
(25)Li,J.W.;Song,C.;Liu,S.T.Acta Chim.Sin.2012,70,2347.[李经纬,宋灿,刘善堂.化学学报,2012,70,2347.]doi:10.6023/A12080562
(26)Bastos,S.S.T.;Órfão,J.J.M.;Freitas,M.M.A.;Pereira,M.F. R.;Figueiredo,J.L.Appl.Catal.B:Environ.2009,93,30.doi:10.1016/j.apcatb.2009.09.009
(27)Morales,M.R.;Barbero,B.P.;Cadús,L.E.Appl.Catal.B:Environ.2006,67,229.doi:10.1016/j.apcatb.2006.05.006
(28)Delimaris,D.;Ioannides,T.Appl.Catal.B:Environ.2008,84,303.doi:10.1016/j.apcatb.2008.04.006
(29)Fu,X.B.;Feng,J.Y.;Wang,H.;Ng,K.M.Catal.Commun. 2009,10,1844.doi:10.1016/j.catcom.2009.06.013
(30)Hu,J.;Sun,K.Q.;He,D.P.;Xu,B.Q.Chin.J.Catal.2007,28,1025.[胡敬,孙科强,何代平,徐柏庆.催化学报,2007,28,1025.]doi:10.1016/S1872-2067(08)60001-7
(31)Ye,Q.;Huo,F.F.;Yan,L.N.;Wang,J.;Cheng,S.Y.;Kang,T. F.Acta Phys.-Chim.Sin.2011,27,2872.[叶青,霍飞飞,闫立娜,王娟,程水源,康天放.物理化学学报,2011,27,2872.]doi:10.3866/PKU.WHXB20112872
(32)Dai,Y.;Wang,X.Y.;Li,D.;Dai,Q.G.J.Hazard.Mater.2011,188,132.doi:10.1016/j.jhazmat.2011.01.084
(33)Liu,J.;Makwana,V.;Cai,J.;Suib,S.L.;Aindow,M.J.Phys. Chem.B 2003,107,9185.doi:10.1021/jp0300593
Complete Catalytic Oxidation of Ethanol over MnO2with Different Crystal Phase Structures
ZHANG JieZHANG Jiang-HaoZHANG Chang-BinHE Hong*
(State Key Joint Laboratory of Environmental Simulation and Pollution Control,Center for Air Pollution Control Technology,Research Center for Eco-Environmental Sciences,Chinese Academy of Sciences,Beijing 100085,P.R.China)
α-MnO2,β-MnO2,γ-MnO2,and δ-MnO2catalysts were synthesized by hydrothermal methods,and their catalytic performances towards the oxidation of ethanol were evaluated in detail.The as-synthesized MnO2catalysts were characterized by N2adsorption-desorption measurements,X-ray diffraction(XRD),X-ray photoelectron spectroscopy(XPS),and H2temperature-programmed reduction(H2-TPR).The α-MnO2catalyst showed the best activity of the catalysts tested for the combustion of ethanol and the trend in the activity of different MnO2catalysts towards the oxidation of ethanol was of the order α-MnO2>δ-MnO2>γ-MnO2>β-MnO2. The effect of the crystal phase structure on the activity of the MnO2catalysts was investigated.The XRD results showed that there were differences in the crystallinities of the α-,β-,γ-,δ-MnO2catalysts,but these differences did not have a significant effect on their catalytic performances towards the oxidation of ethanol.The BET surface areas of the α-,β-,γ-,δ-MnO2catalysts exhibited similar tendencies to their ethanol oxidation activities,although the results of standardization calculations showed that the surface area was not the main factor affecting their catalytical activities.The XPS results showed that the lattice oxygen concentration played an important role in defining the catalytic performance of the MnO2.The α-MnO2catalyst showed the best reducibility of all of the MnO2catalysts tested,as determined by H2-TPR.The excellent performance of α-MnO2was attributed to its higher lattice oxygen concentration and reducibility,which were identified as the main factors affecting the activity of the MnO2towards the complete oxidation of ethanol.
November 3,2014;Revised:December 5,2014;Published on Web:December 8,2014.
MnO2catalyst;Low temperature catalytic oxidation;Ethanol complete oxidation;Volatile organic compound;Lattice oxygen
O643
10.3866/PKU.WHXB201412081
The project was supported by the National Natural Science Foundation of China(21422706)and National High Technology Research and Development Program of China(863)(2012AA062702).
国家自然科学基金(21422706)及国家高技术研究发展计划项目(863)(2012AA062702)资助
©Editorial office ofActa Physico-Chimica Sinica
