固有无序超嗜热菌FlgM蛋白在两种不同温度下的构象变化特征
2015-08-15朱玉风曹赞霞赵立岭王吉华山东师范大学物理与电子科学学院济南5004山东省功能大分子生物物理重点实验室山东德州50德州学院生物物理研究所山东德州50
朱玉风 曹赞霞 赵立岭 王吉华(山东师范大学物理与电子科学学院,济南5004;山东省功能大分子生物物理重点实验室,山东德州50;德州学院生物物理研究所,山东德州50)
固有无序超嗜热菌FlgM蛋白在两种不同温度下的构象变化特征
朱玉风1,2,3曹赞霞2,3赵立岭2,3王吉华2,3,*
(1山东师范大学物理与电子科学学院,济南250014;2山东省功能大分子生物物理重点实验室,山东德州253023;3德州学院生物物理研究所,山东德州253023)
基于分子动力学模拟方法比较了超嗜热菌FlgM蛋白在常温(293 K)和生理温度(358 K)下的结构特征.基于GROMACS软件包,采用OPLS-AA分子力场和TIP3P水模型,对超嗜热菌FlgM蛋白在293和358 K进行了2组独立的长时间分子动力学模拟,每组体系模拟时间为1500 ns.主要分析了两种温度下超嗜热菌FlgM蛋白的二级结构特征、整体构象变化及半无序化区域和结构化区域的构象特征.研究结果表明:在常温下,N端具有一定程度的螺旋成分,但在生理温度下,超嗜热菌FlgM蛋白的结构变得松散,螺旋结构减少,构象稳定性减弱,H1螺旋散开,FlgM蛋白构象灵活性增强,不稳定程度增加.这些不同温度的结构变化说明:半无序化区域(N端)在非结合状态下有一定的螺旋结构,但该段螺旋的稳定性随温度升高而降低.超嗜热菌FlgM蛋白会通过增加结构的无序程度使结构更加灵活,以适应高温,从而使该类固有无序蛋白更好地行使其功能,如提高同其他成分的结合速率等.
FlgM蛋白;固有无序蛋白;分子动力学模拟;温度适应性;结构特征
www.whxb.pku.edu.cn
1 引言
自然界亿万年的发展进化使细菌具有极强的适应性.在温度适应性方面,如嗜热菌和嗜冷菌这类嗜极细菌能够在极端的温度下生存.嗜热蛋白、嗜常温蛋白和嗜冷蛋白1的相关研究表明,嗜冷蛋白具有高柔韧性和低耐热性,而嗜热蛋白能形成较稳定的结构,这些都表明温度能够影响蛋白质结构. FlgM蛋白是一类典型的温度感应蛋白质,同源FlgM蛋白在不同生理温度的细菌中广泛存在,如在生理温度273 K(0°C)的Leptothrix cholodnii和生理温度358 K(85°C)的Aquifex aeolicus.FlgM蛋白作为RNA转录因子抑制剂,是鞭毛综合体运动性和趋药性基因的负调节器,在革兰氏阴性和革兰氏阳性细菌中大量存在.2-7FlgM蛋白的基因功能在物种间高度保守,但同源FlgM蛋白在序列结构上差别很大.8
我们的前期预测研究8表明:39个物种的同源FlgM蛋白的生理温度与其结构无序性具有相关性.其生理温度的变化范围为0°C(273 K)到85°C(358 K),不同蛋白具有不同程度的序列长度、序列相似性、二级结构含量及无序程度等等.39个同源FlgM蛋白均为固有无序蛋白,而且随着生理温度的升高,蛋白长度变短,无序区的无序程度减小.这39个同源FlgM蛋白在无序程度上相差很大,分为有序态、半无序态和全无序态.其中序列较短的蛋白(长度<97个氨基酸残基)具有高温适应性(温度>45°C 或318 K),其高温适应性在结构上表现为N端为半无序态且具有较高螺旋含量.8而非高温最适生长温度的FlgM蛋白的N端含有极少二级结构,呈全无序态.这些结果表明:不同物种的FlgM蛋白通过由含有极少二级结构的全无序态转变为具有较高螺旋含量的半无序态来适应高温,全无序到半无序的转变可能是自然界生物适应高温的策略.
超嗜热菌(the thermophile Aquifex aeolicus,A. aeolicus)可适应85-95°C的高温.其FlgM(简写A.a. FlgM)蛋白是固有无序蛋白质,9同时具有半无序特征.10固有无序蛋白的无序特征有利于其同其他成分发生相互作用.11,12圆二色谱(CD)实验研究发现,13A.a.FlgM蛋白在室温20°C(293 K)下稀溶液和粘性溶液中都表现出明显的α螺旋结构(A.a.FlgM蛋白在室温下具有活性),形成α螺旋的百分含量高达40.5%;随着温度升高直至生理温度85°C(358 K)时,α螺旋特性逐渐减弱.CD实验证明A.a.FlgM蛋白柔性结构与温度明显相关.
但是,这个半无序蛋白在原子水平的构象如何随着温度发生变化?该蛋白半无序区的构象集合特征如何?半无序区和结构区的变化有何不同?这些变化与其高温适应性调节有何关联?这一系列问题都有待解决.到目前为止,已经有针对A.a.FlgM蛋白的实验方面的结构研究,13,14但并没有揭示温度是如何影响A.a.FlgM蛋白的结构特征的.分子动力学模拟15-18作为一种有效工具,能将蛋白结构及其结构变化可视化和量化,能够清楚地得出蛋白结构及其变化.
本文使用分子动力学模拟的方法研究A.a. FlgM蛋白在不同温度下的结构特征,比较不同温度对半无序蛋白A.a.FlgM构象变化的影响.为了与实验信息相比较,分子动力学模拟选择293 K(20°C)和358 K(85°C)两个温度.分析了两个温度下的主链二面角、二级结构、代表性构象、回旋半径、均方根涨落(RMSF)等参数.
2 材料和方法
2.1超嗜热菌FlgM(A.a.FlgM)蛋白的结构
A.a.FlgM蛋白的序列14为:1MVNRIELSRLI GLLLETEKRKNEQKESGTNKIEDKVTLSKIAQEL SKNDVEEKDLEKKVKELKEKIEKGEYEVSDEKV VKGLIEFFT88,共88个残基.2004年14首次测定了A.a.FlgM蛋白的晶体结构,使用X射线晶体衍射(分辨率:0.325 nm和0.23 nm)得到超嗜热菌σ28/FlgM复合物的晶体结构(PDB ID:1SC5),该结构中没有1-2号和18-31号残基信息.使用Discovery Studio建模软件,在晶体结构的基础上将18-31号缺失残基补齐,残基序列为:3NRIELSRLIGLLLETEKRKNTEQ KESGTNKIEDKVTLSKIAQELSKNDVEEKDLEKK VKELKEKIEKGEYEVSDEKVVKGLIEFFT88,共86个残基.我们以此结构(图1)作为本文模拟研究的初始结构.该结构有四段螺旋:2-14、35-46、56-67及74-83片段,依次为H1、H2、H3、H4螺旋(86个残基,序号从1开始).
2.2分子动力学模拟和体系准备
基于GROMACS软件(版本4.5.3),19采用OPLSAA力场20及TIP3P水模型,21研究A.a.FlgM蛋白.初始构象见2.1节,采用NPT系综,将蛋白溶解在周期性截断八面体盒子里,蛋白到盒子的最小距离设定为1.0 nm.带电基团选择在中性pH下的质子化状态.添加的水分子为13495个,加入了2个Na+离子替换2个水分子使pH保持电中性.首先使用最陡下降法方法进行第一次能量优化,然后使用共轭梯度法进行第二次能量优化.本模拟采用particle-mesh Ewald(PME)方法22,23处理长程静电相互作用,采用cut-off方法处理范德华相互作用,采用长度为0.12 nm的网格,温度耦合采用V-rescale算法,24压强耦合采用Berendsen算法,25每10步更新一次邻居列表.模拟温度设定为293 K(20°C)和358 K(85°C)两个温度,对得到的体系进行约束分子动力学模拟.对293 K的模拟,采用六步升温,设定为50、100、150、200、250、293 K.对358 K的模拟,采用七步升温,设定为50、100、150、200、250、293、358 K.随后在两个不同温度下分别进行1500 ns的自由动力学模拟.最后,取各自最后200 ns的坐标轨迹进行后续分析.通过计算二级结构、残基涨落、聚类分析、快照分析、回旋半径等等,分析了温度对半无序蛋白二级结构、结构松散程度、构象变化的影响.

图1 A.a.FlgM蛋白分子动力学模拟的初始结构Fig.1 Initiating structure ofA.a.FlgM protein on molecular dynamics simulations
3 结果与讨论
3.1A.a.FlgM蛋白具有鲜明的固有半无序态蛋白特征
我们的早期研究8基于SPINE-D10,26和SPINEX27,28对A.a.FlgM蛋白进行无序程度和二级结构预测.SPINE-D是基于序列集成神经网络无序预测程序,预测结果以无序程度P取值从0到1呈现(0和1分别对应完全有序态和完全无序态),能够很好地计算和区分全无序区与半无序区.在该预测结果中,A.a.FlgM蛋白有两段半无序区:2-64及78-88片段,一段有序区:65-77片段;有四段螺旋结构:3-15、33-47、58-65及76-87片段.预测结果表明A.a.FlgM蛋白属于固有半无序蛋白,其N端部分属于半无序区,而C端部分属于结构化区域.
3.2不同温度下A.a.FlgM蛋白的总体构象变化情况
为了探讨温度对A.a.FlgM蛋白总体构象的影响,我们分析了构象snapshot和残基涨落.Snapshot可以从一系列蛋白质构象中得到一组具有代表性的构象,缩减了构象数据,方便进行总体构象分析.在1500 ns的轨迹中,每100 ns轨迹聚类得到一个代表性构象(聚类是基于构象相互之间的Cα原子的均方根偏差进行分析的,cutoff设为0.1),共聚类15次,得到15个代表性构象,如图2所示.为了更加明显地呈现结构变化,另外使用了STRIDE程序29,30计算了二级结构随时间的变化来分析蛋白质在不同温度下的二级结构变化情况,31,32如图3所示.初始构象含有四段螺旋结构,随着模拟时间的增长,C端的两个螺旋H3和H4在两个温度下都解开.在293 K下,H1和H2螺旋基本保持稳定,与在复合物中的结构基本相同;但在358 K下,H2螺旋基本保持不变,H1螺旋慢慢解开,并且有向折叠片转变的趋势.
另一方面,我们分析了构象总体的稳定性,计算了两个不同温度下最后200 ns即1301-1500 ns的残基涨落情况,如图4所示.残基的均方根涨落反映了构象系综中原子的涨落情况,RMSF越大表示分子动力学模拟过程中残基偏离参考构象的程度越大.在图4中,1-20号残基、25-32号残基、49-86号残基涨落明显增加,即H1、H3和H4螺旋稳定性较差. 在RMSF概率分布中,变化最明显的是0-0.2和0.2-0.6区间内,温度升高,RMSF在0-0.2之间的概率明显减少,RMSF在0.2-0.6之间的概率明显增加.温度升高之后残基涨落整体增加,结构稳定性变差,但是358 K左右是超嗜热菌的生理温度,说明FlgM蛋白功能的实现需要一定的无序程度.
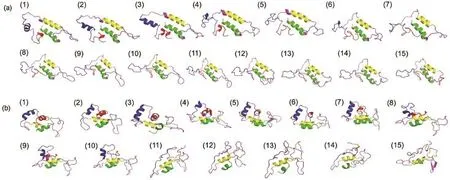
图2 293和358 K温度下在0-1500 ns内从snapshot取出的连续构象Fig.2 Sequential conformations from snapshot during 0-1500 ns at temperatures of 293 and 358 K(a)293 K,(b)358 K.(1)-(15)indicate the most clustered structure of selected group.Conformations are represented as cartoon in the same proportion.The four helixes colored with green,yellow,blue,and red,respectively.

图3 293和358 K温度下在0-1500 ns内各构象二级结构随时间变化Fig.3 The second structure content plotted as a function of time of each conformation during 0-1500 ns at temperatures of 293 and 358 K(a)293 K;(b)358 K.The structures of H,G,I,B,b,E,T,C are colored of blueviolet,black,yellow,blue,cyan,red,green,and white,respectively. H:Alpha helix;G:3-10 helix;I:PI-helix;E:extended conformation;B or b:Isolated bridge;T:Turn;C:Coil(none of the above)
3.3在不同温度下A.a.FlgM蛋白的聚类分析
前面分析发现蛋白在358 K下稳定性减弱.根据预测结果,A.a.FlgM蛋白的N端部分属于半无序化区域,而C端部分属于结构化区域.为了分析温度对半无序化区域和结构化区域是否存在不同影响,我们选取了N端的1-38号残基片段和C端的47-84号残基片段各38个残基作为研究对象,进行聚类分析.聚类使用g_cluster程序,基于构象相互之间的Cα原子的均方根偏差进行分析,cutoff设为0.1,结果如表1所示.从表1可以看出,无论是半无序化区域还是结构化区域,358 K下聚类数都要比293 K下多,表明358 K下的构象类型较多,构象采样更丰富;同时说明相同时间内,采样构象数多,即构象变化范围更广阔.在生理温度下,A.a.FlgM蛋白的灵活性增大,有利于它同其它成分相互作用,进而行使其生物功能.
3.4在不同温度下A.a.FlgM蛋白的二级结构变化
前面是基于整体分析温度对构象的影响.下面基于二面角分布和二级结构形成情况,分析温度对二级结构的影响.
首先,使用g_rama程序计算1301-1500 ns内残基主链二面角进而得到其分布,使用平均力势(PMF)分布来表征.二面角平均力势PMF定义为:
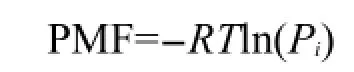
其中R为理想气体常数,T为温度,Pi为残基主链二面角落入区域i的几率.区域i为-180°≤ψ≤180° 且-180°≤φ≤180°范围内的小区间.两模拟体系的残基主链二面角平均力势分布如图5所示.平均力势越低,相应构象被采样的几率就越大,图中红色区域为平均力势极小区域,相邻力势曲线间隔为2 kJ·mol-1.由图5可知,在293 K下半无序区域的主链二面角主要分布在α螺旋区域,其他区域较少;结构化区域的主链二面角主要分布在β折叠区域.在358 K下,半无序区域的主链二面角平均分布在β折叠区域和α螺旋区域;结构化区域的主链二面角主要分布在β折叠区域.能量低点说明相应二级结构形成的可能性较大,但不一定形成.表2给出了不同温度下不同片段落在α螺旋区域和β折叠区域的平均力势极小值的相对深度及坐标.结果表明,对半无序化片段,温度升高后其在α螺旋区域的采样明显减少,β折叠区域的采样明显增加;而对结构化区域,温度升高后其在α螺旋区域的采样和β折叠区域的采样无明显变化.有实验13发现,在0 mol·L-1葡萄糖浓度下,293 K下形成31%的α螺旋结构和11%的β折叠结构,358 K下形成24%的α螺旋结构和21% 的β折叠结构,这就意味着温度升高后α螺旋结构成分减少,β折叠结构成分增加,我们的模拟结果与实验结果是相符合的.

图4 293和358 K温度下在1301-1500 ns内各残基的均方根涨落分布(RMSF)Fig.4 Root mean square fluctuation(RMSF)of each residue during 1301-1500 ns at temperatures of 293 and 358 K
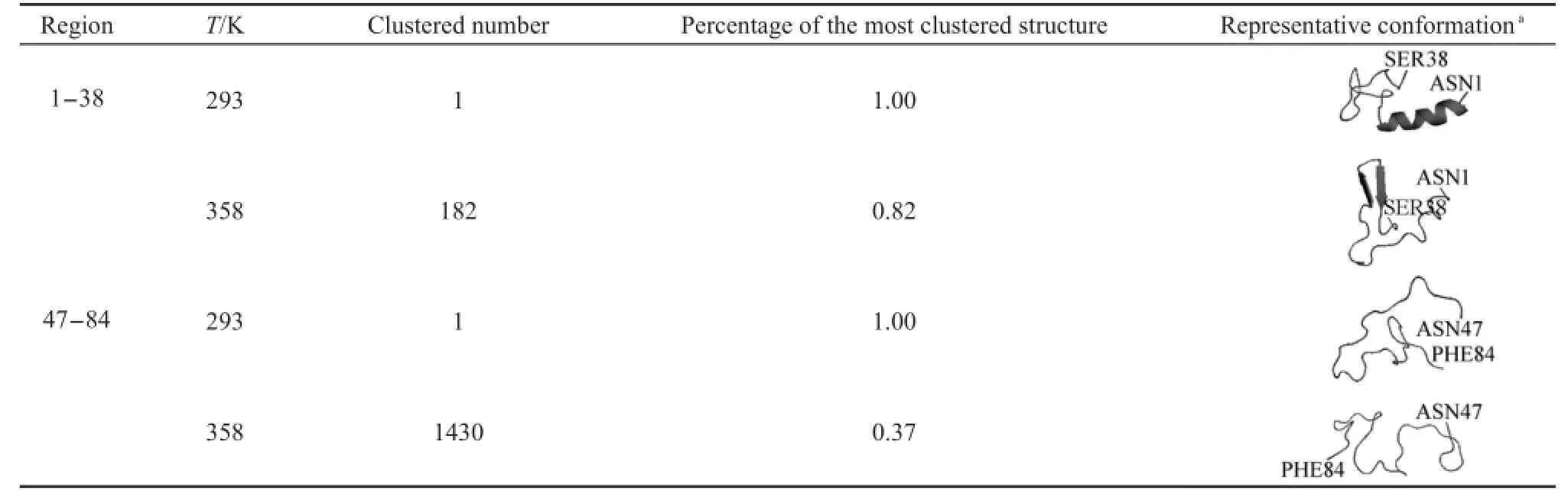
表1 293和358 K下1301-1500 ns构象聚类分布Table 1 Clustered conformation distribution during 1301-1500 ns at temperatures of 293 and 358 K
同时,使用STRIDE软件29,30分别计算1301-1500 ns时间内的残基形成二级结构的变化情况.结果表明,293 K下,螺旋(包括α螺旋和3-10螺旋)结构所占的比例为18.8%,β折叠片结构所占的比例为0.8%,Turn结构所占的比例为45.7%,无规卷曲(Coil)结构所占的比例为31.2%.358 K下,螺旋(包括α螺旋和3-10螺旋)结构所占的比例为12.9%,β折叠片结构所占的比例为13.8%,Turn结构所占的比例为48.0%,Coil结构所占的比例为24.4%.说明随着温度增加α螺旋含量减少,而β折叠结构增加.

图5 293和358 K温度下半无序化区域和结构化区域中残基主链Ramachandran二面角(φ,ψ)对应的平均力势(PMF)分布Fig.5 Distributions of potentials of mean force(PMF)plotted as a function of the Ramachandran angles(φ,ψ)of residue backbones for semi-disordered region and structured region respectively at the temperatures of 293 and 358 K(a)semi-disordred region at the temperature of 293 K;(b)structured region at the temperature of 293 K;(c)semi-disordered region at the temperature of 358 K;(d)structured region at the temperature of 358 K.Neighboring contour lines are separated by 2 kJ·mol-1.

表2 A.a.FlgM蛋白残基主链二面角(φ,ψ)PMF极小值分布及相应坐标Table 2 Distributions of the PMF minima of Ramachandran angle(φ,ψ)of residue backbones ofA.a.FlgM protein and corresponding coordinates
为进一步分析比较293和358 K下形成螺旋结构的差异,计算了各残基形成螺旋结构或折叠结构的概率,如图6所示.在293 K下,形成两段螺旋:2-14段残基,形成概率介于17.6%-99.0%;35-45段残基,形成概率介于17.6%-99.0%.在358 K下,同样形成两段螺旋:2-8段残基,形成概率介于14.5%-66.0%;37-45段残基,形成概率介于63.9%-99.4%.在两个不同温度下,第二段螺旋没有明显变化,第一段螺旋形成概率明显减小.初始结构具有4段螺旋,在两种温度下,H3和H4都已经消失,与图2结果一致,表明在这部分区域即C端区域只有与核苷酸聚合酶σ因子结合时才形成稳定的结构,而在单体情况下呈无序状,与SPINE-D预测结果一致.螺旋H2在两种温度下变化不大,表明该部分区域稳定性较强;H1在生理温度(358 K)时稳定性较差.上述分析表明,A.a.FlgM蛋白为适应温度变化,可能主要通过N端无序化区域的螺旋形成概率或者无序程度的变化来进行调节的.其他同源FlgM蛋白是否也具有类似的温度适应性规律,有待于进一步研究.
3.5在不同温度下A.a.FlgM蛋白的三级结构分析
以上分析已经证明了温度对A.a.FlgM蛋白二级结构形成具有影响,为了更准确地分析构象稳定性的变化,使用参数Contact进行了蛋白质三级结构的分析.Contact是三维蛋白质分子中所有氨基酸残基Cα原子之间距离的反映.定义距离阈值为0.8 nm,33即若两残基Cα原子之间距离小于0.8 nm,则认为它们之间存在Contact.计算两温度下1301-1500 ns内的Contact分布,如图7所示.Percent为残基间形成Contact的概率.图中颜色越深,表示形成Contact的概率越大.图中293 K下,在1-40号残基片段之间有“U”型结构,说明在20号残基附近形成弯曲;在65-80号残基片段附近也有部分弯曲.在358 K下,在20-30、45-60、65-85号残基片段附近有部分“U”型结构.20-30、45-60号残基片段附近有明显弯曲形成,结构变化较大.在358 K还有一部分Contact形成,零散分布,结合作用较弱.由此可以得出温度升高使得A.a.FlgM蛋白的构象更加卷曲,构象稳定性减弱.

图6 293和358 K下A.a.FlgM蛋白二级结构的螺旋结构(a)和折叠结构(b)分布Fig.6 Residue-specific second structure helix(a)and strand(b)percentages ofA.a.FlgM protein respectively at the temperatures of 293 and 358 K

图7 293和358 K下1301-1500 ns模拟内各残基间contact形成情况Fig.7 Formation of contacts between residues at the temperatures of 293 and 358 K during the 1301-1500 ns simulation(a)293 K;(b)358 K.Percent is representing the formation rates of contact between residues.
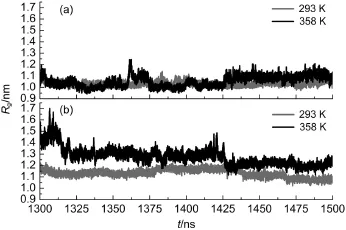
图8 293和358 K温度下A.a.FlgM蛋白半无序化区域和结构化区域在1301-1500 ns模拟内回旋半径(Rg)分布Fig.8 Distributions of radius of gyration(Rg)plotted as a function of time at the semi-disordered region and structured region fromA.a.FlgM protein at the temperatures of 293 and 358 K during the 1301-1500 ns simulation(a)semi-disordered region,(b)structured region
3.6在不同温度下A.a.FlgM蛋白半无序化区域和结构化区域的结构特征
蛋白回旋半径反映了蛋白的松散程度.我们选取了N端的1-38号残基片段和C端的47-84号残基片段各38个残基作为研究对象,分析不同无序程度区域的回旋半径受温度的影响(见图8).对于N端半无序化区域而言,其回旋半径受温度影响较小,358 K下略大于293 K下的变化.而对于C端结构化区域,其回旋半径受温度影响比较大.同时,对N端半无序化区域和C端结构化区域进行比较发现,C端结构区域的伸展范围在生理温度下更广,有利于它同其他成分相互作用.由此可以看出,半无序蛋白A.a.FlgM蛋白的N端半无序化区域的伸展程度随温度变化较小,而且高温的伸展程度与低温的不相上下,C端的结构化区域的伸展程度随温度的变化较大,且高温时的伸展程度明显大于低温的情况.这给我们以启迪,是否可以通过温度影响伸展效应来区分有序化区域和无序化区域?值得进一步研究.
4 结论
A.a.FlgM蛋白是超嗜热菌鞭毛组装的负反馈阶段的关键蛋白,而高温影响A.a.FlgM蛋白结构这一关键对其功能的实现至关重要,实验表明温度升高会导致A.a.FlgM蛋白构象扩展.为了深入探索温度对A.a.FlgM蛋白构象影响的微观过程,本文模拟研究了A.a.FlgM蛋白在293和358 K下的动力学特征.采用OPLS-AA力场以及TIP3P水模型,完成了两个1500 ns的独立长时间分子动力学模拟,总模拟时间长达3000 ns.针对模拟轨迹,计算了残基主链二面角、二级结构、回旋半径、RMSF等参数,分析了半无序化区域及结构化区域的结构特征等.分析结果表明,在生理温度下,H1螺旋散开,A.a.FlgM蛋白构象灵活性增加,不稳定程度增加,结构松散性增加;半无序区在非结合状态下有一定的螺旋结构,并且该段螺旋的稳定性随温度升高而降低,同时温度升高会使得蛋白C端结构区的伸展范围更广.处于结构化区域的C端是A.a.FlgM蛋白的功能化区域,温度升高提高了A.a.FlgM蛋白的灵活性,有利于它同其他成分或蛋白发生相互作用.这些研究,有助于我们认识固有无序蛋白质的温度效应,为揭示有序和无序的区别提供了新的启迪.
References
(1)Feller,G.J.Phys.:Condes.Matter 2010,22(32),323101.doi:10.1088/0953-8984/22/32/323101
(2)Ohnishi,K.;Kutsukake,K.;Suzuki,H.;Iino,T.Mol.Genet. Metab.1990,221(2),139.
(3)Gillen,K.L.;Hughes,K.T.J.Bacteriol.1991,173(20),6453.
(4)Ohnishi,K.;Kutsukake,K.;Suzuki,H.;Lino,T.Mol. Microbiol.1992,6(21),3149.doi:10.1111/mmi.1992.6.issue-21
(5)Gillen,K.L.;Hughes,K.T.J.Bacteriol.1993,175(21),7006.
(6)Hughes,K.T.;Gillen,K.L.;Semon,M.J.;Karlinsey,J.E. Science 1993,262(5137),1277.doi:10.1126/science.8235660
(7)Kutsukake,K.Mol.Genet.Metab.1994,243(6),605.
(8)Wang,J.H.;Yang,Y.D.;Cao,Z.X.;Li,Z.X.;Zhao,H.L.;Zhou,Y.Q.Biophys.J.2013,105(11),1.
(9)Dunker,A.K.;Brown,C.J.;Lawson,J.D.;Iakoucheva,L.M.;Obradovic,Z.Biochemistry 2002,41(21),6573.doi:10.1021/ bi012159+
(10)Zhang,T.;Faraggi,E.;Li,Z.X.;Zhou,Y.Q.Cell Biochem. Biophys.2013,76(3),1193.
(11)Huang,Y.Q.;Liu,Z.R.Acta Phys.-Chim.Sin.2010,26,2061.[黄永棋,刘志荣.物理化学学报,2010,26,2061.]doi:10.3866/ PKU.WHXB20100644
(12)Liu,Z.R.;Huang,Y.Q.Protein Sci.2014,23(5),539.doi:10.1002/pro.2443
(13)Molloy,R.G.;Ma,W.K.;Allen,A.C.;Greenwood,K.;Bryan,L.;Sacora,R.;Williams,L.;Gage,M.J.Biochim.Biophys.Acta 2010,1804(7),1457.doi:10.1016/j.bbapap.2010.03.002
(14)Sorenson,M.K.;Ray,S.S.;Darst,S.A.Mol.Cell 2004,14(1),127.doi:10.1016/S1097-2765(04)00150-9
(15)Xu,Z.Y.;Zhao,L.L.;Cao,Z.X.;Wang,J.H.Acta Phys.-Chim.Sin.2012,28,1665.[许朝莹,赵立岭,曹赞霞,王吉华.物理化学学报,2012,28,1665.]doi:10.3866/PKU. WHXB201204182
(16)Luo,F.;Gao,J.;Cheng,Y.H.;Cui,W.;Ji,M.J.Acta Phys.-Chim.Sin.2012,28,2191.[罗芳,高剑,成元华,崔巍,计明娟.物理化学学报,2012,28,2191.]doi:10.3866/ PKU.WHXB201207063
(17)Dong,X.Y.;Du,W.J.;Liu,F.F.Acta Phys.-Chim.Sin.2012,28,2735.[董晓燕,都文婕,刘夫锋.物理化学学报,2012,28,2735.]doi:10.3866/PKU.WHXB201207162
(18)Cao,J.;Cao,Z.X.;Zhao,L.L.;Wang,J.H.Acta Phys.-Chim. Sin.2012,28,479.[曹剑,曹赞霞,赵立岭,王吉华.物理化学学报,2012,28,479.]doi:10.3866/PKU.WHXB201111231
(19)Van der Spoel,D.;Lindahl,E.;Hess,B.;Groenhof,G.;Mark,A. E.;Berendsen,H.J.J.Comput.Chem.2005,26(16),1701.
(20)Jorgensen,W.L.;Tirado-Rives,J.Proc.Natl.Acad.Sci.U.S.A. 2005,102(19),6665.doi:10.1073/pnas.0408037102
(21)Jorgensen,W.L.;Chandrasekhar,J.;Madura,J.D.;Impey,R. W.;Klein,M.L.J.Chem.Phys.1983,79(2),926.doi:10.1063/ 1.445869
(22)Essmann,U.;Perera,L.;Berkowitz,M.L.;Darden,T.;Lee,H.;Pedersen,L.G.J.Chem.Phys.1995,103(19),8577.doi:10.1063/1.470117
(23)Darden,T.;York,D.;Pedersen,L.J.Chem.Phys.1993,98(12),10089.doi:10.1063/1.464397
(24)Bussi,G.;Donadio,D.;Parrinello,M.J.Chem.Phys.2007,126(1),014101.doi:10.1063/1.2408420
(25)Berendsen,H.J.;Postma,J.P.M.;Van Gunsteren,W.F.;DiNola,A.;Haak,J.J.Chem.Phys.1984,81(8),3684.doi:10.1063/1.448118
(26)Zhang,T.;Faraggi,E.;Xue,B.;Dunker,A.K.;Uversky,V.N.;Zhou,Y.Q.J.Biomol.Struct.Dyn.2012,29(4),799.doi:10.1080/073911012010525022
(27)Faraggi,E.;Yang,Y.D.;Zhang,S.S.;Zhou,Y.Q.Structure 2009,17(11),1515.doi:10.1016/j.str.2009.09.006
(28)Faraggi,E.;Zhang,T.;Yang,Y.D.;Kurgan,L.;Zhou,Y.Q. J.Comput.Chem.2012,33(3),259.doi:10.1002/jcc.v33.3
(29)Frishman,D.;Argos,P.Proteins:Struct.Funct.Bioinf.1995,23 (4),566.
(30)Heinig,M.;Frishman,D.Nucleic Acids Res.2004,32(suppl 2),W500.
(31)Liu,F.F.;Ji,L.;Dong,X.Y.;Sun,Y.J.Phys.Chem.B 2009,113(32),11320.doi:10.1021/jp905580j
(32)Liu,F.F.;Dong,X.Y.;He,L.Z.;Middelberg,A.P.J.;Sun,Y. J.Phys.Chem.B 2001,115(41),11879.
(33)Tegge,A.N.;Wang,Z.;Eickholt,J.;Cheng,J.L.Nucleic Acids Res.2009,37(suppl 2),W515.
Conformational Change Characteristics in the lntrinsically Disordered FlgM Protein from a Hyperthermophile at Two Different Temperatures
ZHU Yu-Feng1,2,3CAO Zan-Xia2,3ZHAO Li-Ling2,3WANG Ji-Hua2,3,*
(1Department of Physics and Electronic Science,Shandong Normal University,Jinan 250014,P.R.China;2Shandong Province Key Laboratory of Biophysics for Functional Macromolecules,Dezhou 253023,Shandong Province,P.R.China;3Institute of Biophysics,Dezhou University,Dezhou 253023,Shandong Province,P.R.China)
The aim of this work was to compare the structural characteristics of the FlgM protein from the thermophile aquifex aeolicus at room temperature(293 K)and at the physiological temperature(358 K)using molecular dynamics simulations.Two independent long-time molecular dynamics simulations were performed using the GROMACS software package at 293 and 358 K,respectively.The OPLS-AAforce field and the TIP3P water model were used.Each simulation was run for 1500 ns.We mainly analyzed the secondary structural characteristics,the overall conformation variation,the conformational characteristics of a semi-disordered region and the structured region of the FlgM protein at two different temperatures.The results indicate that the helix structure of the N terminal increased at room temperature.The FlgM protein had the following characteristics at the physiological temperature:the structure loosed,the helix structure reduced in size,the conformational stability weakened,the H1 helix spread,the conformational flexibility increased,and the degree of instability increased.In summary,the semi-disordered region(N terminal)formed a helical structure in the unbound state and its stability decreased with an increase in temperature.The FlgM protein adapts to temperature by increasing the degree of disorder,creating a more flexible structure by improving the binding rate.
September 15,2014;Revised:December 16,2014;Published on Web:December 16,2014.∗
.Email:jhw25336@126.com;Tel:+86-534-8985933.
FlgM protein;Intrinsically disordered protein;Molecular dynamics simulation;Temperature adapting;Structure characteristic
©Editorial office ofActa Physico-Chimica Sinica
O643;O641
10.3866/PKU.WHXB201412161
The project was supported by the National Natural Science Foundation of China(61271378,31000324).
国家自然科学基金(61271378,31000324)资助项目
