构建M23-AQP4稳定表达的HEK293细胞应用于血清抗AQP4抗体检测的研究
2015-08-14吴晓牧符青青刘诗英项正兵熊英琼张昆南
吴晓牧 符青青 刘诗英 项正兵 熊英琼 张昆南
视神经脊髓炎(NMO)是主要累及视神经和脊髓的严重自身免疫性脱髓鞘性疾病。2004年Lennon等[1]首次在NMO患者血清中发现NMOIgG抗体,即抗AQP4抗体[2],从而为认识NMO为有别于MS的独立性疾病提供了依据。目前已将血清抗AQP4抗体作为支持条件纳入NMO诊断标准[3]。血清抗AQP4抗体的检测方法主要有鼠脑间接免疫荧光法(IIF)和细胞间接免疫荧光法(CBA),以CBA 敏感性较高[4-5],尤其以表达 M23-AQP4亚型的细胞作为底物的CBA,其抗AQP4抗体检出率可高达97%[6]。由于CBA技术要求高且耗时,难以推广使用。本文拟构建 M23-AQP4稳定的HEK293细胞(HEK293-M23-AQP4)用于血清抗AQP4抗体的检测,并探讨本研究方法检测血清抗AQP4抗体对NMO的诊断敏感性和临床实用性。
1.1 观察对象 收集2012-04-2014-04作者医院神经内科住院治疗的52例脱髓鞘性疾病患者,其中NMO符合 Wingerchuck诊断标准[3],MS符合McDonald诊断标准,其他脱髓鞘疾病均为结合临床表现、影像、脑脊液、肌电图等检查确诊病例。其中NMO 6例、多发性硬化(MS)16例、其他脱髓鞘疾病患者30例〔包括视神经炎6例、脊髓炎14例、吉兰-巴雷综合征9例、急性播散性脑脊髓炎1例〕。以同期神经内科住院的10例非脱髓鞘性疾病患者(脑梗死3例、脑出血3例、重症肌无力2例,中枢神经系统感染2例)为对照。标本采集均征得患者同意。
1.2 主要试剂 HEK293细胞(中科院上海细胞库),pEGFP-N1-M23-AQP4质粒及pEGFP-N1质粒30%甘油菌(Invitrogen公司),无内毒素质粒提取 试 剂 〔Endo-free Plasmid Mini Kit Ⅱ (50),OMEGA公司〕,磷酸钙转染试剂、正常山羊血清工作液(碧云天生物技术公司),DMEM高糖培养基(Hyclone公司),胎牛血清、胰酶(Transgen公司),G418、7~15万单位多聚赖氨酸、4%(质量分数)多聚甲醛(Solarbio公司),兔源抗人AQP4多克隆抗体、Cy3标记的羊抗人二抗(Abcam公司),TRITC标记的羊抗兔二抗(EarthOx公司)。
1.3 方法
1.3.1 标本采集:用促凝管采集患者清晨空腹静脉血3mL,2000r/min离心10min,收集血清,-80℃保存备用。
1.3.2 HEK293-M23-AQP4的构建:接种含有pEGFP-N1-M-23AQP4质粒的甘油菌于含硫酸卡那霉素的液体LB培养基扩增并纯化质粒,用Endo-free Plasmid Mini KitⅡ(50)抽提质粒(按说明书操作)。构建方法参考文献[8],将HEK293细胞接种于6孔细胞培养板,待细胞长至80%~90%覆盖孔底时用磷酸钙转染试剂转染pEGFPN1-M23-AQP4质粒(按说明书操作),转染24h后,在荧光显微镜下观察,蓝光激发下观察到绿色荧光表明转染成功,将转染成功细胞按1∶10传代,用含G418(终浓度400μg/mL)培养基筛选,每3d更换G418筛选培养基,2周后挑选单克隆,用含G418(200μg/mL)培养基维持培养,获得绿色荧光较强且持续的细胞。用CBA法进行鉴定,将获得的细胞接种于经多聚赖氨酸包被的96孔细胞培养板(1×105个/孔),置37℃、5%(体积分数)CO2培养24h,PBS浸洗2min×5次,4%(质量分数)多聚甲醛固定30min,PBS浸洗2min×5次,设3个平行孔,正常山羊血清工作液(50μL/孔)室温封闭1h,去除封闭液,兔源抗人AQP4多克隆抗体(1∶100稀释,50μL/孔)4℃孵育过夜,PBS浸洗2min×5次,TRITC标记的羊抗兔二抗(1∶200稀释,50μL/孔)室温孵育1h,PBS浸洗2min×5次,50%(体积分数)甘油-0.5 mol/L pH 9.0~9.5碳酸盐缓冲液封闭,荧光显微镜下观察,蓝光(420~490nm)激发下的绿色荧光区域,经绿光(535~550nm)激发后观察到红色荧光则表明有 M23-AQP4 表 达,HEK293-M23-AQP4构建成功。同样的方法构建 HEK293-pEGFP-N1细胞,荧光显微镜下蓝光激发时出现持续可见绿色荧光表明构建成功;采用CBA法进行鉴定,若显微镜下观察到红色荧光则表明HEK293-pEGFP-N1细胞能与抗 AQP4抗体结合,若不能观察到红色荧光则表明HEK293-pEGFP-N1细胞不能与抗 AQP4抗体结合,作为HEK293-M23-AQP4细胞的对照。
1.3.3 4组患者的抗AQP4抗体检测:HEK293-M23-AQP4接种并固定于96孔细胞培养板,PBS浸洗2min×5次,正常山羊血清工作液(50μL/孔)室温封闭1h,去除封闭液,血清标本(1∶50稀释,50μL/孔,每个标本设3个孔)4℃孵育过夜,PBS浸洗2min×5次,Cy3标记的羊抗人二抗(1∶500稀释,50μL/孔)室温孵育1h,PBS浸洗2 min×5 次,50% (体积分数)甘油-0.5mol/L pH9.0~9.5碳酸盐缓冲液封闭,荧光显微镜下观察,蓝光激发下的绿色荧光区域,经绿光激发后观察到红色荧光为阳性,无红色荧光为阴性。将检测结果为阳性的血清标本用倍比稀释法稀释为1∶50~1∶1638400检测抗AQP4抗体,以不能观察到红色荧光的最小稀释比例的前一比例作为该标本的抗AQP4抗体滴度。记录并比较4组患者抗AQP4抗体阳性率,计算抗AQP4抗体诊断NMO的敏感性和特异性。阳性率=抗体阳性例数/相应组中患者总例数;敏感性=NMO组中抗体检测阳性例数/NMO组总例数×100%,特异性=对照组阴性例数/对照组总例数×100%。
1.3.4 HEK293-M23-AQP4的稳定性检测:HEK293-M23-AQP4接种并固定于96孔细胞培养板,将上述96孔细胞培养板分别于室温、4℃、-20℃下保存4周后作为底物,用1.3.3方法检测经首次检测为阳性的标本及随机选取的5例阴性标本的抗AQP4抗体及滴度,比较各保存温度下所测得的抗AQP4抗体阳性率及其滴度与首次检测结果的差异,以观察HEK293-M23-AQP4的稳定性。
1.3.5 抗AQP4抗体稳定性检测:上述经首次检测抗AQP4抗体为阳性的标本及随机选取的5例阴性标本反复3次冻融后分装3份(10μL/Ep管),分别于室温、4℃、-20℃下保存1周后检测抗AQP4抗体及其滴度,比较各保存温度下所测得的抗AQP4抗体阳性率及其滴度与首次检测结果的差异,以观察血清抗AQP4抗体的稳定性。
1.4 统计学处理 采用SPSS17.0软件进行分析,4组血清抗AQP4抗体阳性率比较采用Fisher确切概率法,本研究中测得的血清抗AQP4抗体滴度经对数转化(Lg),采用Wilcoxon带符号秩检验进行比较。以P<0.05为差异有统计学意义。
2 结果
2.1 HEK293-M23-AQP4构建 经 G418筛选获得的细胞,在荧光显微镜下可见蓝光激发下所发出绿色荧光定位在细胞膜(图1A),经CBA法检测显示TRITC红色荧光标记主要在细胞膜区域(图1B),表明 HEK293-M23-AQP4构建成功,M23-AQP4主要表达在细胞膜。G418筛选获得的HEK293-pEGFP-N1细胞持续表达绿色荧光,且绿色荧光充满整个细胞(图1D),CBA法未观察到红色荧光,显示FRITC羊抗兔二抗未结合(图1E),对照表明 HEK293-M23-AQP4细胞表达M23-AQP4。
2.2 4组患者抗AQP4抗体检测 以HEK293-M23-AQP4细胞为底物的CBA法检测显示,与抗AQP4抗体阳性血清标本结合时,荧光显微镜下经绿光激发可观察到红色荧光(图2B),且红色荧光与绿色荧光重叠(图2C),而与抗AQP4抗体阴性血清标本结合则不能观察到红色荧光(图2E),以HEK293-pEGFP-N1细胞为底物亦不能观察到红色荧光(图2F)。6例NMO患者血清抗AQP4抗体阳性率为83.3%(5/6),显著高于 MS患者阳性率〔6.3%(1/16),P=0.001〕、其他脱髓鞘性疾病〔3.3%(1/30),P<0.001〕和非脱髓鞘性疾病患者〔0.0%(0/10),P=0.001〕;MS患者和其他脱髓鞘性疾病的阳性率差异无统计学意义(P=0.58);非NMO脱髓鞘疾病患者和非脱髓鞘性疾病患者抗AQP4抗体阳性率差异无统计学意义(P=0.82);抗AQP4抗体诊断NMO的敏感性为83.3%(5/6),以 MS作为对照时,其特异性为93.8%(15/16),以其他脱髓鞘性疾病和非NMO的脱髓鞘疾病作为对照时,其特异性分别为96.7%(29/30)、95.6%(44/46),以非脱髓鞘疾病作对照时,其诊断NMO 特异性为100% (10/10)。阳性标本抗AQP4抗体滴度在1∶400~1∶120 400之间(表1)。
2.3 HEK293-M23-AQP4稳定性检测 7例阳性标本均仍为阳性,5例阴性标本也均仍为阴性,其阳性结果未发生改变(P=1.0);7例阳性标本的抗AQP4抗体滴度与首次检测结果比较差异均无统计学意义(z=0,P=1.0,表2)。
2.4 抗AQP4抗体稳定性检测 血清标本经4℃和-20℃保存后抗AQP4抗体及其滴度与首次检测结果比较差异均无统计学意义(P=1.0,表1),室温保存其抗AQP4抗体检测结果与首次检测结果比较差异无统计学意义(P=1.0),但抗AQP4抗体滴度显著下降(z=-2.64,P<0.01)(表2)。
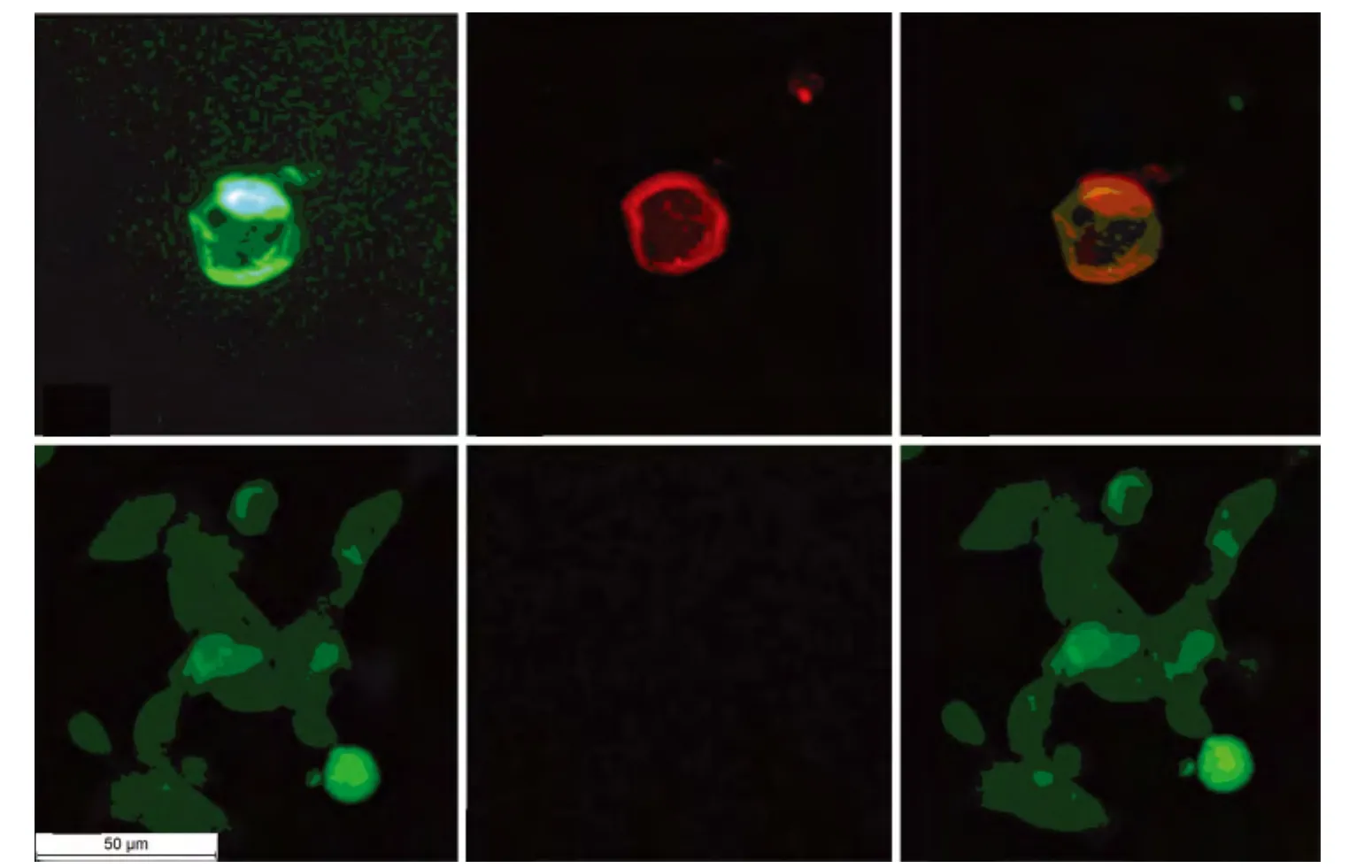
图1 HEK293-M23-AQP4鉴定:M23-AQP4主要在细胞膜表达,抗AQP4抗体结合在细胞膜区域(CBA法,荧光显微镜,标尺50 μm)
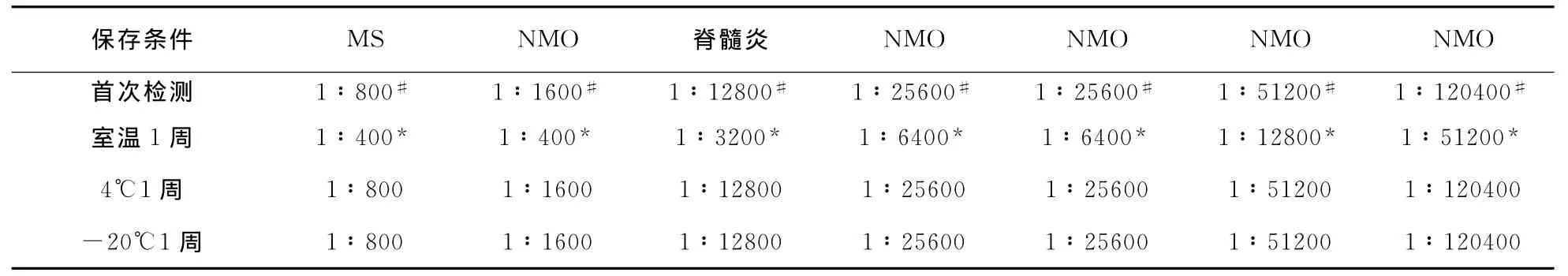
表1 不同保存条件下抗AQP4抗体阳性标本抗体滴度比较
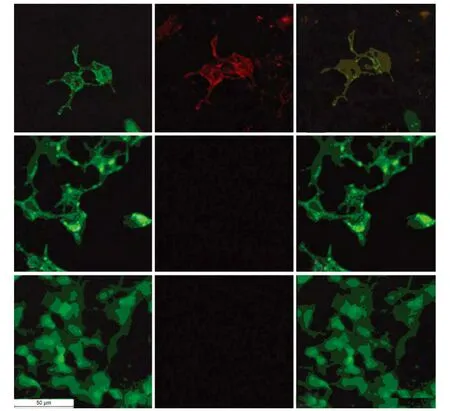
图2 抗AQP4抗体检测(CBA法,荧光显微镜,标尺50μm)
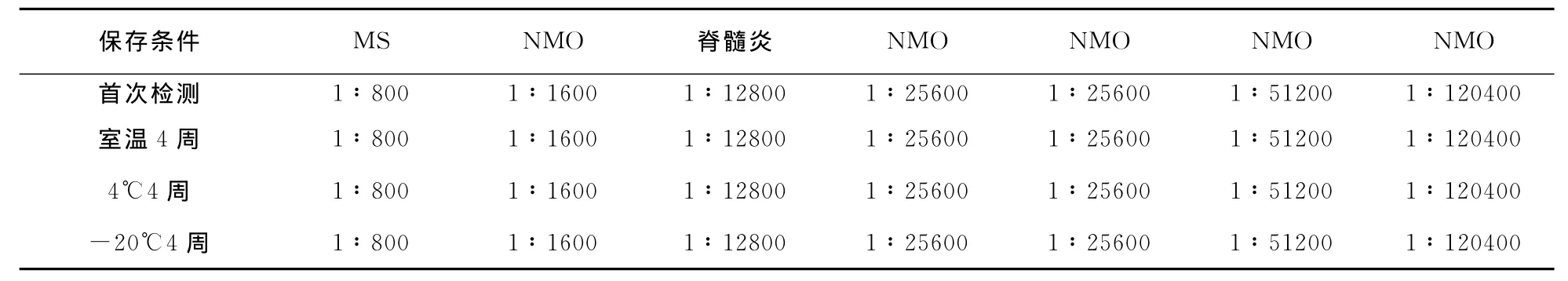
表2 不同温度保存4周后的96孔细胞培养板检测阳性标本抗AQP4抗体滴度
3 讨论
本研究采用磷酸钙转染试剂将M23-AQP4基因转入HEK293细胞,经G418筛选、挑取单克隆扩增并经CBA法鉴定,最终成功构建HEK293-M23-AQP4细胞,与国内外使用较多的脂质体转染试剂相比较,磷酸钙转染试剂转染时不需要去除培养液中的血清,能减轻转染试剂对细胞的毒性,保持转染细胞的活性以利于后续稳定表达细胞的筛选。此外,磷酸钙转染试剂价格低廉且易于获得也是本研究方法的优势之一。
本研究采用以HEK293-M23-AQP4为底物的CBA法检测血清抗AQP4抗体,结果显示NMO患者血清抗 AQP4抗体阳性率〔83.3%(5/6)〕显著高于其他3组(6.3%、3.3%、0.0%),这与国内外研究[4,6-7]结果一致,表明抗 AQP4抗体是 NMO的重要生物学标记,有助于NMO与MS和脱髓鞘性疾病的鉴别诊断,也支持 Wingerchuk等[3]将抗AQP4抗体纳入NMO诊断标准。本研究方法检测抗AQP4抗体对诊断NMO的敏感性高于Lennon等[1]IIF的73%和基于 M1-AQP4亚型 CBA的70%[6],但低于基于 M23-AQP4亚型CBA法的97%[9],特异性高于IIF 的91%[1],出现这些差异的可能原因为:(1)IIF存在种属差异,鼠AQP4与人AQP4可能存在抗原表位差异[8],进而影响抗原抗体反应,降低了检测敏感性,本研究采用人M23-AQP4不存在种属差异的影响;(2)IIF采用鼠脑组织作为底物,由于存在组织AQP4表达量的差异以及AQP4抗原暴露程度的差异,组织的选取和处理对检测敏感性造成影响,本研究以稳定表达M23-AQP4的细胞为底物,AQP4表达量充足;(3)研究表明,主要由 M23-AQP4形成的正交阵列颗粒(OAPs)是抗AQP4抗体的主要识别靶点[6],这可能是本研究敏感性高于M1-AQP4亚型CBA(70%)的原因之一;(4)样本量小可能是造成本研究敏感性低于同样基于M23-AQP4检测方法(97%)的原因;(5)IIF由于底物组织存在 AQP4之外的其他抗原,可造成抗AQP4抗体与组织的非特异性结合,从而降低特异性,本研究采用特异性表达M23-AQP4的细胞为底物,可减少非特异性结合,提高特异性。
本研究经4%(质量分数)多聚甲醛固定HEK293-M23-AQP4的96孔细胞培养板于室温、4℃和-20℃保存4周后检测血清抗AQP4抗体,结果显示抗体阳性率和滴度与首次检测结果差异无统计学意义,表明经4%(质量分数)多聚甲醛固定HEK293-M23-AQP4稳定性好,可以保存备用,这意味着本研究方法可不需要临时培养、转染以制备AQP4抗原表达细胞,可简化实验步骤、显著缩短检测耗时、降低对检测技术的要求,为不具备细胞培养和荧光显微镜等技术设备的实验室检测血清抗AQP4抗体提供可能。此外,反复冻融3次的血清标本置于室温、4℃和-20℃保存1周后用于检测血清抗AQP4抗体,结果显示阳性率以及4℃以下保存标本的抗体滴度与首次检测结果无差异,但室温保存的标本抗体滴度显著低于首次检测(P<0.01),表明室温会加速抗AQP4抗体降解,延长保存时间可能会影响检测阳性率。反复冻融和4℃以下保存不影响检测结果,抗AQP4抗体稳定性较好,这意味着本研究方法对送检标本质量的要求较低,使得跨实验室、地区检测成为可能,为抗AQP4抗体检测的临床推广提供可能。
综上,本研究结果显示,以 HEK293-M23-AQP4为底物的CBA法检测抗AQP4抗体对诊断NMO的敏感性、特异性较高,且简便易行,有利于临床用于NMO的诊断和鉴别诊断。由于本研究样本量小,标本保存时间相对较短,今后研究将增加样本量,延长标本保存时间,探索更加合适的保存条件进一步验证,以便更好地解决临床脱髓鞘性疾病诊断和鉴别困难的难题。
[1]Lennon VA,Wingerchuk DM,Kryzer TJ,et al.A serum autoantibody marker of neuromyelitis optica:distinction from multiple sclerosis[J].Lancet,2004,364(9451):2106-2112.
[2]Lennon VA,Kryzer TJ,Pittock SJ,et al.IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4water channel[J].J Exp Med.2005,202(4):473-477.
[3]Wingerchuk D,Lennon V,Pittock S,et al.Revised diagnostic criteria for neuromyelitis optica[J].Neurology.2006,66(10):1485-1489.
[4]Jarius S,Wildemann B.Aquaporin-4antibodies(NMO-IgG)as a serological marker of neuromyelitis optica:A critical review of the literature[J].Brain Pathology.2013,23(6):661-683.
[5]Uzawa A,Mori M,Kuwabara S.Neuromyelitis optica:Concept,immunology and treatment[J].J Clin Neurosci,2014,21(1):12-21.
[6]Mader S,Lutterotti A,Di Pauli F,et al.Patterns of antibody binding to aquaporin-4isoforms in neuromyelitis optica[J].PloS one,2010,5(5):e10455.
[7]赵忙所,孔杰辰,石建雄,等.视神经脊髓炎患者血清NMOIgG检测及其诊断价值[J].中国神经免疫学和神经病学杂志,2011(01):14-16.
[8]Tani T,Sakimura K,Tsujita M,et al.Identification of binding sites for anti-aquaporin 4antibodies in patients with neuromyelitis optica[J].J Neuroimmunol,2009,211(1):110-113.
[9]刘俊秀,赖蓉,钟德霞,等.表达AQP4不同亚型的细胞系检测AQP4抗体敏感性的研究[J].中山大学学报(医学科学版),2012(05):587-591.
