陈皮石油醚相中抗苹果腐烂病菌活性物质研究
2015-08-08张相飞杜春华郝双红李凌绪
张相飞 杜春华 郝双红 李凌绪
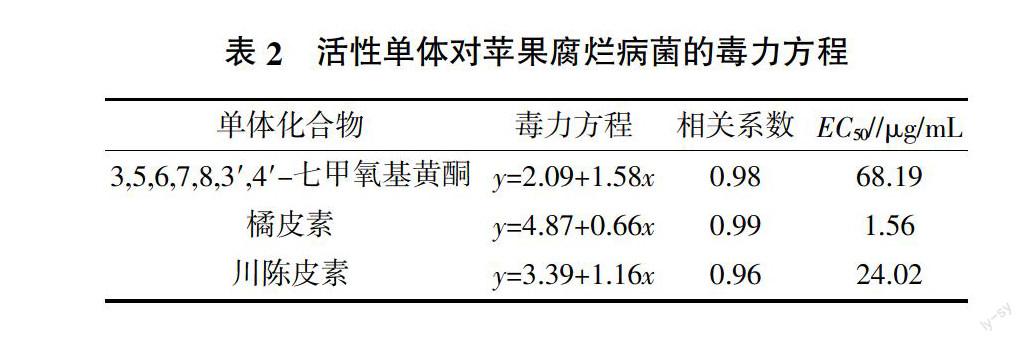
摘要:陈皮石油醚提取物中富含对苹果腐烂病菌(Valsa mali)具有抑菌活性的物质,研究通过反复硅胶柱层析、制备高效液相色谱、重结晶对馏分F15纯化获得了3个活性单体A、B、C。核磁共振数据显示A、B、C分别为3,5,6,7,8,3′,4′-七甲氧基黄酮、橘皮素和川陈皮素。采用生长速率法测定A、B、C的抑菌活性,结果表明,3个化合物对苹果腐烂病菌的EC50分别为68.19、1.56、24.02 μg/mL,其中橘皮素对苹果腐烂病菌的抑菌活性最强。
关键词:陈皮;苹果腐烂病菌(Valsa mali);多甲氧基黄酮;分离纯化;抑菌活性
中图分类号:S432.9+8;S482.2+92 文献标识码:A 文章编号:0439-8114(2015)13-3150-03
DOI:10.14088/j.cnki.issn0439-8114.2015.13.020
Research of Active Material in Petroleum Ether Extraction from Tangerine Peel
for in Vitro Control of Valsa mali
ZHANG Xiang-feia,DU Chun-huaa,HAO Shuang-honga,LI Ling-xub
(a.College of Chemistry and Pharmaceutical Science; b.College of Agronomy and Plant Protection, Qingdao Agricultural University,
Qingdao 266109, Shandong,China)
Abstract: Petroleum ether extraction from tangerine peel was rich in active ingredients against Valsa mali. Research through purification obtained three active monomers A,B,C by repeated silica gel column chromatography,the preparation of high performance liquid chromatography and recrystallization on fraction F15. Monomeric compounds A,B and C were determined as 3,5,6,7,8,3′,4′-heptamethoxyflavone, tangeretin and nobiletin,respectively. Growth rate method was used to determine the bacteriostatic activity of A,B,C. The results showed that all the three monomeric compounds were strong inhibitors against Valsa mali and the EC50 were 68.19,1.56 and 24.02 μg/mL respctively. Among them tangeretin had strongest antifungal activity against Valsa mali.
Key words: tangerine peel; Valsa mali; polymethoxyflavones; separation; antifungal activity
苹果树腐烂病是一种由苹果腐烂病菌(Valsa mali)引起的毁灭性的病害,主要为害主枝主干,在中国苹果主产区的总体发生率为52.7%,造成巨额损失[1]。化学防治是目前生产上防治苹果树腐烂病的主要手段,但现有的化学农药很难有效控制苹果树腐烂病的发生与危害,亟需开发新型的农药。天然产物因其活性高、结构新颖被视为新型农药先导化合物的重要来源。陈皮为芸香科植物橘(Citrus reticulate Blanco)及其栽培变种的干燥成熟果皮,含有挥发油、黄酮、生物碱、肌醇等活性成分,具有理气健脾、燥湿化痰的功能[2,3]。同时陈皮中也富含具有抑制霉菌作用的活性物质[4-7],本课题组的前期研究表明陈皮脂溶性成分具有强烈的抑制苹果腐烂病菌生长的活性[8,9]。本研究拟在活性追踪的指导下对陈皮提取物的石油醚相进行分离纯化,明确其中对苹果腐烂病菌具有抑菌活性的化学成分,为开发防治苹果树腐烂病的新型农药提供先导化合物。
1 材料与方法
1.1 供试材料
陈皮于2011年7月购自青岛市城阳区富康大药房,产地为浙江黄岩。陈皮在室内阴干,磨粉备用。
1.2 供试菌种
供试植物病原菌为苹果腐烂病菌,由青岛农业大学化学与药学院提供。
1.3 仪器设备
核磁共振仪为Bruker AV-500型。高效液相色谱仪为天津科器高新技术公司YZS-3型(ODS C18柱,40 mm×300 mm,10~30 μm)。柱色谱用100~200目硅胶及薄层色谱硅胶H均购自青岛海洋化工公司。
1.4 化合物的提取、分离与纯化
取陈皮粉末3 kg加入9 L的75%乙醇60 ℃提取3 h,过滤收集滤液。重复提取3次后合并滤液,减压浓缩至浸膏状,得陈皮粗提物126.37 g。粗提物经石油醚萃取,得石油醚相24.85 g。取石油醚相20 g经硅胶柱层析分离,以石油醚∶乙酸乙酯梯度(100∶0→100∶1→20∶1→10∶1→5∶1→2∶1→1∶1→1∶100)洗脱,经TLC(薄层色谱法)分析后合并相同组分,共获得15个馏分,编号为F01-F15。F15经反复硅胶柱层析分离,用石油醚∶乙酸乙酯(3∶1)洗脱获得F1501、F1502、F1503共3个组分。F1502经中压制备HPLC(高效液相色谱法)分离,流动相为乙腈,UV(紫外光)检测器,波长255 nm,流速15 mL/min,获得化合物A(保留时间26 min)32 mg和化合物B(保留时间21 min)21 mg。F1503经丙酮重结晶获得化合物C共81 mg。
1.5 抑菌活性测定方法
采用生长速率法测定15个馏分及单体化合物的抑菌活性,试验过程中所用培养基、玻璃制品等均经灭菌。称取适量馏分或单体化合物,用少量丙酮溶解,加入到已融化的60 ℃左右的PDA培养基中,摇匀,倒入直径60 mm的培养皿中,培养基冷却凝固后移入生长一致、直径为4 mm的苹果腐烂病菌菌饼。以加入等量丙酮的培养基为对照,每处理重复3次。将培养皿置于27 ℃恒温培养,至对照接近长满菌时采用十字交叉法测量菌落直径,抑菌率计算公式为:
抑菌率=(对照组菌落纯生长量—处理组菌落纯生长量)/对照组菌落纯生长量×100%
使用SPSS20.0的Probit模型进行数据处理,得出不同化合物的EC50和毒力方程。
2 结果与分析
2.1 不同馏分对苹果腐烂病菌的抑菌活性
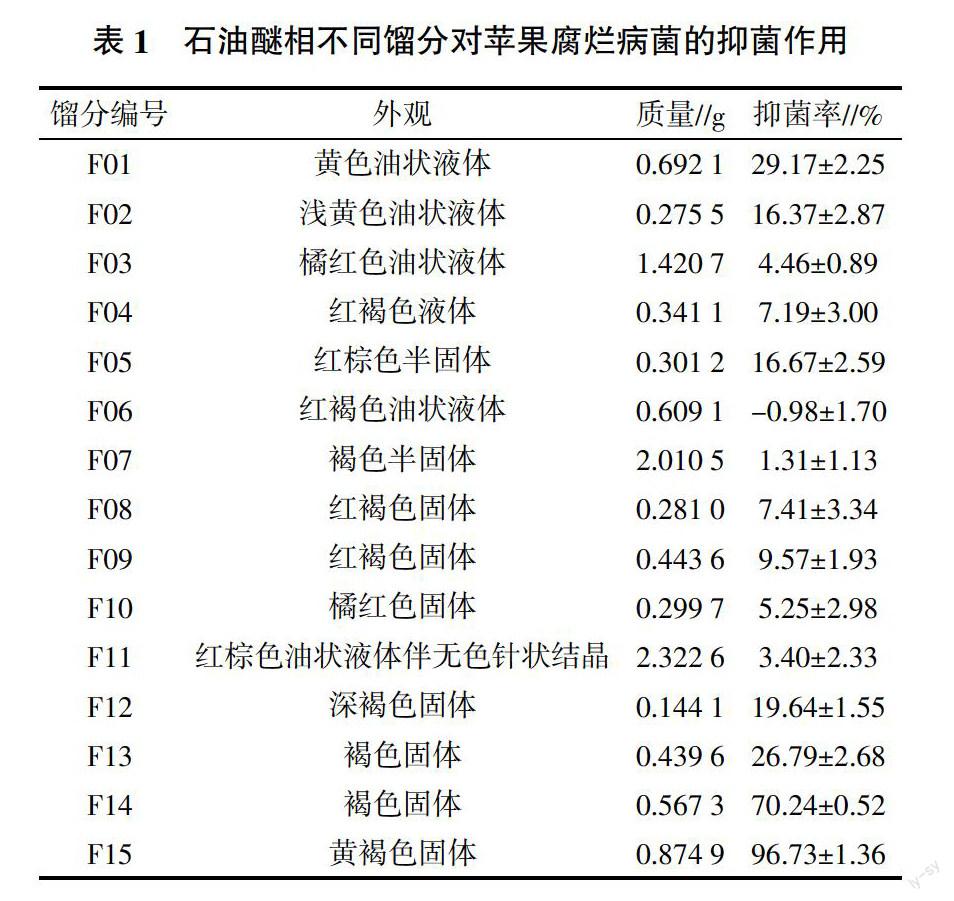
陈皮乙醇提取物的石油醚萃取相经硅胶柱层析后共获得了15个馏分,采用生长速率法测定了不同馏分对苹果腐烂病菌的抑菌作用,浓度为200 mg/mL时各馏分的抑菌作用如表1所示。由表1可知,石油醚相中的活性成分主要存在于高极性部分,其中馏分F15对苹果腐烂病菌的抑菌率最高,为(96.73±1.36)%,抑菌活性最强,因此优先对馏分F15进行了分离纯化。
2.2 化合物结构表征
化合物A为无色至黄绿色针状结晶(乙腈),熔点129~130 ℃。1H-NMR(CDCl3,500 MHz)δ:7.816(1H,s,H-2′),7.016(1H,s,J=8.5 Hz,H-5′),7.845(1H,d,J=8.5 Hz,H-6′),4.104(3H,s,OCH3),4.010(3H,s,OCH3),3.979(9H,s,3×OCH3),3.954(3H,s,OCH3),3.894(3H,s,OCH3);13C-NMR(CDCl3,125 MHz)δ:152.985(C-2),140.619(C-3),173.738(C-4),148.069(C-5),143.713(C-6),151.166(C-7),137.692(C-8),146.635(C-9),114.955(C-10),123.307(C-1′),110.839(C-2′,C-5′),150.910(C-3′),148.617(C-4′),121.792(C-6′),62.176、61.837、61.743、61.562、59.728(3-、5-、6-、7-、8-C),55.865、55.777(3′、4-C′)。其核磁共振氢谱、碳谱数据与3,5,6,7,8,3′,4′-七甲氧基黄酮一致[10,11]。故推断化合物A为3,5,6,7,8,3′,4′-七甲氧基黄酮,分子式为C22H24O9,分子量为432。
化合物B为无色针状结晶(乙腈),熔点50~51 ℃。1H-NMR(CDCl3,500 MHz) δ:6.613(1H,s,H-3),7.884(2H,d,J=7.2Hz,H-2′,H-6′),7.033(2H,d,J=6.8Hz,H-3′,H-5′),4.108(3H,s,OCH3),4.026(3H,s,OCH3),3.955(6H,s,2×OCH3),3.896(3H,s,OCH3);13C-NMR(CDCl3,125 MHz)δ:162.333(C-2),106.776(C-3),177.301(C-4),144.127(C-5),138.145(C-6),151.386(C-7),148.445(C-8),147.758(C-9),114.973(C-10),123.956(C-1′),127.734(C-2′,C-6′),114.556(C-3′,C-5′),161.183(C-4′),62.258、62.021、61.820、61.647(5-、6-、7-、8-C),55.510(4′-C)。其1H-NMR、13C-NMR数据与文献一致[12,13],故鉴定为5,6,7,8,4′-五甲氧基黄酮(橘皮素,红橘素,Tangeretin),分子式为C20H20O7,分子量为372。
化合物C为无色至黄绿色针状结晶(丙酮),熔点134~135 ℃。1H-NMR(CDCl3,500MHz) δ:6.628(1H,s,H-3),7.414(1H,s,H-2′),6.999(1H,d,J=8.2Hz,H-5′),7.575(1H,d,J=8.5Hz,H-6′),4.110(3H,OCH3),4.030(3H,OCH3),3.984(3H,OCH3),3.971(3H,OCH3),3.958(3H,2×OCH3);13C-NMR(CDCl3,125MHz)
δ:160.896(C-2),106.776(C-3),177.226(C-4),143.961(C-5),137.886(C-6),151.298(C-7),147.597(C-8),148.309(C-9),114.744(C-10),123.890(C-1′),108.387(C-2′),149.152(C-3′),151.783(C-4′),111.079(C-5′),
119.491(C-6′),62.152、61.855、61.726、61.572(5-、6-、7-、8-C),55.973、55.851(3′-、4′-C)。其核磁共振碳谱、氢谱数据与5,6,7,8,3′,4′-六甲氧基黄酮(川陈皮素,Nobiletin)一致[10,14]。
2.3 单体化合物活性测定
为了明确石油醚相中的抑菌活性成分,采用反复硅胶柱层析、重结晶、制备HPLC等方法对馏分F15进行了进一步的分离纯化,获得了3,5,6,7,8,3′,4′-七甲氧基黄酮、橘皮素、川陈皮素等3个活性单体。活性测定结果表明3,5,6,7,8,3′,4′-七甲氧基黄酮、橘皮素、川陈皮素对苹果腐烂病菌的EC50分别为68.19、1.56、24.02 μg/mL(表2),橘皮素可能是石油醚相中对苹果腐烂病菌产生抑菌活性的主要成分。
3 小结与讨论
陈皮是我国传统中药,其来源为芸香科柑橘属植物柑橘的果皮,富含黄酮等活性成分。多甲氧基黄酮(Polymethoxyflavones,PMFs)主要存在于芸香科植物中,相比黄酮苷,其分子空间构型更具平面性,极性更小,更容易穿透细胞膜进入细胞,影响细胞的生长活动。PMFs因其良好的抗肿瘤、抗动脉粥样硬化、抗氧化、抗炎等活性受到国内外学者的广泛关注[15-17]。同时PMFs也是柑橘果实贮存期重要的抗病物质,在果实采摘后可抵抗柑橘青霉菌(Penicillium digitatum)[15,18]、柑橘褐腐疫霉病菌(Phytophthora citrophthora)[19,20]等病菌的侵染,且其抗侵染能力与其含量呈正相关[21]。但PMFs对其他植物的病原菌是否有抑菌活性少有报道,Almada-Ruiz等[22]曾从柑橘的冷榨油中分离得到了4个多甲氧基黄酮类化合物,体外活性试验证实3,5,6,7,8,3′,4′-七甲氧基黄酮、橘皮素、川陈皮素等对胶孢炭疽菌(Colletotrichum gloeosporioides)都有较好的活性,其中橘皮素和川陈皮素在100 μg/mL时均可完全抑制胶孢炭疽菌的生长。本研究从陈皮乙醇提取物的石油醚相中分离得到了3,5,6,7,8,3′,4′-七甲氧基黄酮、橘皮素、川陈皮素等3个多甲氧基黄酮类化合物,活性测定发现其对苹果腐烂病菌均有很强的抑菌活性,EC50分别为68.19、1.56和24.02 μg/mL。朱蔚等[23]从柑橘皮乙醇提取物中获得了5个多甲氧基黄酮类化合物,并评价了其抑菌活性,在浓度为1 000 μg/mL时川陈皮素和橘皮素对茶树云纹叶枯病菌并没有明显的抑制生长活性(抑菌圈直径小于10 mm),这可能与川陈皮素及橘皮素的抑菌谱有关。
由苹果腐烂病菌侵染引起的苹果树腐烂病在中国分布广、危害重,是北方苹果产区的第一大病害。苹果树腐烂病防治困难,目前的药剂难以取得理想的效果。橘皮素等多甲氧基黄酮类化合物对苹果腐烂病菌有较好的抑菌活性,可作为开发高效新型药物的先导化合物。
参考文献:
[1] 雍道敬,李保华,王彩霞.苹果树腐烂病菌不同致病力菌株对苹果的诱导效应[J].植物生理学报,2014,50(6):810-816.
[2] 赵小艳,吕武清.陈皮的研究概况[J].中国药业,2006,15(15):68-70.
[3] 欧立娟,刘启德.陈皮药理作用研究进展[J].中国药房,2006, 17(10):787-789.
[4] 雷 钢,王永强,张雅军,等.柑橘皮浸膏的防霉、饲养效果研究[J].武汉工业学院学报,2001(4):51-54.
[5] 赵宝玉,李绍君,王军亮,等.桔皮提取物抑制霉菌试验[J].动物医学进展,1998,19(2):30-33.
[6] 马庆一,陈春涛,荆晓艳,等.橙皮苷等橘皮活性成分的提取和抑菌作用研究[J].食品科学,2004,25(12):112-115.
[7] 严赞开,胡春菊.橙皮甙的抑菌效果研究[J].西北农业学报,2004,13(2):87-89.
[8] 李凌绪,魏 艳,杜春华,等.橘皮提取物对7种农业植物病原真菌的抑菌活性研究[J].安徽农业科学,2008,36(30):13242-13243.
[9] 李凌绪,曲亮亮,孟昭礼.橘皮色素的抑菌活性[J].湖北农业科学,2010,49(1):80-82.
[10] HAMDAN D,EL-READI M Z,TAHANI A,et al. Chemical composition and biological activity of Citrus jambhiri Lush[J].Food Chemistry,2011,127(2):394-403.
[11] 钱士辉,陈 廉.陈皮中黄酮类成分的研究[J].中药材,1998,21(6):301-302.
[12] 杨武亮,陈海芳,余金宝,等.枳壳化学成分研究[J].中药材,2008,31(12):1812-1815.
[13] CHEN J,Antonio M. M, Wilbur W. Tow new polymethoxylated flavones,a class of compounds with potential anticancer activity,isolated from cold pressed dancy tangerine peel oil solids[J]. Journal of Agriculture and Chemistry,1997,45:364-368.
[14] 赵雪梅,叶兴乾,席屿芳,等.胡柚皮中的黄酮类化合物[J].中草药,2003,34(1):11-13.
[15] ORTU?譙O A,B?魣IDEZ A,G?魷MEZ P,et al. Citrus paradisi and Citrus sinensis flavonoids:Their influence in the defence mechanism against Penicillium digitatum[J]. Food Chemistry,2006,98(2):351-358.
[16] 车 震,康 娜,郝东宁,等.多甲氧基黄酮对人胶质母细胞瘤细胞系生物学特性的影响[J].现代生物医学进展,2013,13(33):6471-6474.
[17] 王 磊,苏学素,付陈梅,等.柑橘中多甲氧基黄酮生物活性及应用研究进展[J].食品科学,2009,30(7):285-290.
[18] ARCAS M C,BOT?魱A J M,ORTU?譙O A M,et al. UV irradiation alters the levels of flavonoids involved in the defence mechanism of Citrus aurantium fruits against Penicillium digitatum[J]. European Journal of Plant Pathology,2000,106(7):617-622.
[19] DEL R?魱O J A,G?魷MEZ P,BAIDEZ A G,et al. Changes in the levels of polymethoxyflavones and flavanones as part of the defense mechanism of Citrus sinensis(cv.Valencia Late)fruits against Phytophthora citrophthora[J].Journal of Agricultural and Food Chemistry,2004,52(7):1913-1917.
[20] DEL R?魱O J A,ARCAS M C, BENAVENTE-GARC?魱A O,et al. Citrus polymethoxylated flavones can confer resistance against Phytophthora citrophthora,Penicillium digitatum, and Geotrichum species[J]. Journal of Agricultural and Food Chemistry,1998,46(10):4423-4428.
[21] ORTU?譙O A,ARCAS M C,BOT?魱A J M,et al. Increasing resistance against Phytophthora citrophthora in tangelo Nova fruits by modulating polymethoxyflavones levels[J]. Journal of Agricultural and Food Chemistry,2002,50(10):2836-2839.
[22] ALMADA-RUIZ E,MART?魱NEZ-T?魪LLEZ M ?魣,HERN?魣NDEZ-?魣LAMOS M M,et al. Fungicidal potential of methoxylated flavones from citrus for in vitro control of Colletotrichum gloeosporioides,causal agent of anthracnose disease in tropical fruits[J].Pest Management Science,2003,59(11):1245-1249.
[23] 朱 蔚,高旭辉,秦金花,等.柑橘皮乙醇提取物中抑菌成分的分离与鉴定[J].植物保护,2013,39(4):61-64.
收稿日期:2014-11-15
基金项目:山东省自然科学基金项目(ZR2010CQ026)
作者简介:张相飞(1981-),男,山东莱阳人,实验师,硕士,主要从事农药学研究,(电话)15953259290(电子信箱)88121029@qq.com;
通信作者,李凌绪,(电话)13455276690(电子信箱)lingxulipvi@126.com。
