miR-126在人结肠癌细胞中的表达及其对结肠癌细胞生物学行为的影响
2015-08-03宋军民夏坤锟王朝杰郑州大学第一附属医院肛肠外科河南郑州450050
宋军民 杨 超 常 远 夏坤锟 王朝杰 (郑州大学第一附属医院肛肠外科,河南 郑州 450050)
结肠癌是常见的发生于结肠部位的消化道恶性肿瘤〔1〕,但是关于结肠癌迁移与侵袭的机制目前认识尚有限。近来,越来越多的研究支持miRNAs与肿瘤相关〔2,3〕。有研究发现 micro(miR)-126在不同结肠癌细胞株中转染前后表达水平不同,提示miR-126有可能与结肠癌有一定关系。本文通过稳定表达miR-126的结肠癌细胞系了解miR-126的表达及其对结肠癌细胞生物学行为的影响。
1 材料与方法
1.1 一般资料 收集2013年1月至2014年1月在我院肿瘤科确诊为结肠癌并且行手术治疗的患者80例,每例患者术前均未进行放化疗。男46例,女34例,年龄38~55〔平均(47.0±2.5)〕岁;高分化14例,中分化51例,低分化15例;Dukes分期:A期12例,B期22例,C期31例,D期15例;有淋巴结转移38例,无淋巴结转移42例。所有组织于离体15 min内置于液氮罐中保存。
1.2 细胞系、载体及试剂 人结肠癌细胞系SW480、人胚肾细胞株(HEK293T)。慢病毒表达载体pGIPZ、慢病毒包装质粒pCD/NL-BHDDD、慢病毒膜蛋白表达质粒 pLTRG。Lipofectamine2000,快速限制性内切酶 CLai、MLui、T4DNA 连接酶,八肽胆囊收缩术(CCK-8)试剂盒、DMEM培养液、hsa-miR-126原位杂交探针。胎牛血清,总RNA提取液,胰岛素受体底物(IRS)-1兔单克隆抗体。
1.3 方法
1.3.1 细胞培养 将SW480结肠癌细胞株在含有10%进口胎牛血清的RPMI1640培养基中37℃、5%CO2饱和湿度贴壁传代培养,在细胞生长状态良好时(取对数生长期)用于实验。
1.3.2 RT-PCR检测 利用总RNA提取液,严格按照提取液操作说明书提取结肠癌组织和癌旁组织中总RNA,cDNA的制备按照 All-in-one miRNA qRT-PCR Detectionkits,反应体系:RNA 2 μg,poly A polymerase(2.5 U/μl,1 μl),RTase Mix 1 μl,5×反应缓冲液 5 μl,加 H2O至终体积 25 ml。反应条件:37.5℃ 90 min,80℃ 5 min,25℃保存。实施定量PCR的反应体系同样按照All-in-one miRNA qRT-PCR Detectionkits说明书进行,反应条件:预期变性90℃ 10 min,90℃ 10 s,退火60℃ 30s。
1.3.3 miR-126慢病毒表达载体构建 利用Primes软件设计引物,同时引入CLai、MLui酶切位点及引物的序列及末端的保护碱基。引物序列正义:5'-CGACGCGTCGGGTTTACAGAACACCCATCA-3',反义:5'-CCATGGGGCCACAGCAACAAAAGACT-3',扩增的片段长度为357 bp。以正常黏膜组织基因组DNA为模板,PCR扩增miR-126。PCR成功扩增出包含miR-126前体及侧翼序列的DNA片段,将扩增后片段利用2%琼脂糖进行凝胶电泳直至没有出现杂质带,然后对PCR产物纯化回收。由CLai、MLui酶切的PCR产物与pGIPZ载体连接,然后再经过转化,于无菌操作台中挑选单个克隆放入培养基中并摇菌过夜,对目的片段经PCR鉴定正确的菌液进行质粒提取制备小量质粒,鉴定出的阳性质粒经过DNA测序后得到pGIPZ-miR-126重组质粒。
1.3.4 细胞转染 严格按照Lipofectamine2000试剂说明书操作,采用阳离子脂质体法进行病毒包装。转染前24 h,将处于对数生长期的HEK293T接种于6孔培养板中,每孔2×105个细胞。使用含10%进口胎牛血清的高糖型DMEM细胞培养基在37℃、5%CO2条件下培养24 h,待细胞融合度到70%~90%后进行病毒包装,分为 pGIPZ-miR-126转染组、空白对照组(pGIPZ)。将两组病毒上清分别感染SW480细胞,感染72 h后,荧光显微镜下观察到感染成功的细胞中绿色荧光蛋白(GFP)发绿色荧光,成功转染细胞后利用流式细胞仪分选GFP阳性的SW480细胞。分选的细胞纯度达95%以上,然后置于37℃ 5%CO2的培养箱中培养。
1.3.5 CCK-8检测结肠癌细胞的增殖能力 在96孔板中按每孔2×103细胞配制100 ml的细胞悬液,每组设3个复孔,在37℃ 5%CO2的条件下将培养板在培养箱预培养24 h;向培养板各加入10 ml转染组与对照组细胞;将培养板在培养箱孵育一段适当的时间后,向每孔加入10 ml CCK-8溶液,将培养板在培养箱内继续孵育2 h;取细胞转染后12 h、24 h、48 h三个时间点进行CCK-8检测,使用酶联免疫检测仪在450 nm波长处测定其吸光度,重复3次。
1.3.6 划痕实验观察细胞迁移能力 将两组细胞分别接种于6孔板,放入37℃ 5%CO2培养箱中孵育。待长至临近饱和时,用10 μl微量移液头消毒后在细胞板上垂直划痕,用磷酸盐缓冲液(PBS)洗涤细胞3次,去除划下的细胞,加入无血清培养基。倒置显微镜下每隔24 h观察各组细胞的迁移情况并拍照。
1.3.7 Transwell实验观察细胞侵袭能力 小室接种细胞前2 h将基质胶Matrigel用无血清的RPMI1640培养基稀释成浓度为1∶5,每个小室加50 μl,放入37℃ 5%CO2培养箱中孵育2 h;接种200 μl无血清培养基细胞(5×105/ml),下室加入600 μl含10%胎牛血清的RPMI 1640培养液。37℃ 5%CO2条件下培养24~48 h后,取出Transwell小室,弃去孔中培养液,用PBS洗涤2次,4%多聚甲醛固定下室面,结晶紫染色,用棉签轻轻擦掉上层未迁移细胞,用PBS洗涤。显微镜下随机选取4个高倍视野计数穿过膜的细胞数,并计算平均值。实验重复3次。
1.4 统计学方法 利用SPSS16.0软件进行χ2及t检验。
2 结果
2.1 荧光定量PCR检测miR-126在结肠癌组织中表达 结肠癌组织中miR-126表达阳性率显著低于癌旁正常黏膜组织(P<0.05)。见表1。并且,miR-126的表达与年龄、性别及分化程度无明显相关性(P>0.05),与结肠癌临床分期、有无淋巴结转移显著相关(P<0.05)。见表2。

表1 miR-126在结肠癌和癌旁正常黏膜中的表达〔n(%)〕

表2 miR-126表达与结肠癌患者临床特征的相关性分析(n)
2.2 miR-126表达对结肠癌细胞生物学行为的影响
2.2.1 miR-126表达对SW480细胞生长的影响 随培养时间的延长,转染组细胞增殖能力明显低于空白对照组。见表3。
表3 miR-126对SW480细胞增殖的影响〔±s,n=3,L/(g·cm)〕
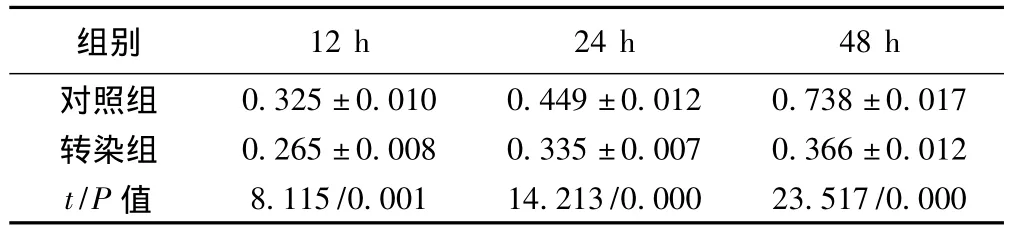
表3 miR-126对SW480细胞增殖的影响〔±s,n=3,L/(g·cm)〕
12 h 24 h 48 h对照组组别0.325±0.010 0.449±0.012 0.738±0.017转染组 0.265±0.008 0.335±0.007 0.366±0.012 t/P值8.115/0.001 14.213/0.000 23.517/0.000
2.2.2 miR-126表达对SW480细胞迁移能力的影响 对SW480两组细胞划痕处理后,间隔24 h连续观察细胞的迁移情况,可见空白对照组划痕72 h后,细胞已基本完全覆盖划痕区域,而转染组则未完全覆盖。表明miR-126具有抑制结肠癌细胞迁移的能力。
2.2.3 miR-126表达对SW480细胞侵袭能力的影响 铺有基质胶的细胞培养36 h后,转染组及空白对照组细胞迁移至下室的细胞个数分别为(10±4.81)个和(262±31.26)个;无基质胶的细胞在培养36 h后计数迁移至下室的细胞数目,转染组和空白对照组分别为(81±14.27)个和(341±24.23)个,差异均具有统计学意义(P<0.05)。
3 讨论
结肠癌是临床上最常见的恶性肿瘤之一,严重威胁着人类的生命和健康,发生侵袭转移为其主要死因。MicroRNA(miRNA)是一类由内源基因编码的长度约为22个核苷酸的非编码小分子单链RNA,它们在动植物中参与转录后基因表达调控,导致靶基因在 mRNA水平降解或引起蛋白翻译抑制〔4~6〕。miRNAs在细胞增殖、迁移、侵袭、基因调控及肿瘤的转移等多种生物过程中起着十分重要的作用〔7,8〕。在分析这些miRNA分子的生物学功能时,发现miR-126与多种肿瘤的发生发展密切相关,并有研究报道其在结肠癌组织中表达下调〔9〕。前期研究发现,miR-126具有抑制结肠癌细胞增殖、迁移及侵袭的能力,可见在结肠癌发生侵袭转移的过程中miR-126发挥举足轻重的作用〔10,11〕。本实验结果说明miR-126可以明显抑制细胞增殖,发挥抑制肿瘤生长的作用。同时,miR-126可抑制结肠癌细胞迁移能力及侵袭能力,发挥抑制结肠癌侵袭转移的功能。综上所述,在结肠癌中存在miR-126表达下调,其下调与结肠癌是否发生侵袭转移密切相关。体外实验也证实miR-126可通过抑制结肠癌细胞增殖、转移与侵袭而发挥抑瘤作用,为结肠癌转移抑制性miRNA。
1 于 洋.结肠癌围手术期的护理体会〔J〕.辽宁医学院学报,2013;34(4):89-90.
2 邓振宇,冯字鹏,何小科.miR-183作用于Ezrin抑制结肠癌细胞侵袭和迁移的研究〔J〕.中国现代普通外科进展,2014;17(3):169-72.
3 陈 芳,周 畅,陆艳霞,等.Hsa-miR-186在结肠癌细胞中的表达及作用〔J〕.南方医科大学学报,2013;33(5):654-60.
4 蒋 波,关 旭,蒋耀昌,等.23例左半结肠癌、直肠癌并肠梗阻患者术中结肠灌洗分析〔J〕.宁夏医科大学学报,2011;33(11):1095-6.
5 吴春蓉,李生陆,罗治彬.微小RNA-451对结肠癌细胞侵袭能力的影响〔J〕.重庆医学,2010;39(14):1813-5.
6 孟庆友,王文斌,蔡志新,等.miR-126对内皮祖细胞增殖和迁移的影响以及靶基因的检测〔J〕.中华普通外科杂志,2013;28(8):611-4.
7 Manikandan J,Aarthi JJ,Kumar SD,et al.Oncomirs:the potential role of non-coding microRNAs in understanding cancer〔J〕.Bioinformation,2008;2(8):330-4.
8 Pichler M,Winter E,Stotz M,et al.Down-regulation of KRAs-in-teracting miRNA-143 predicts poor prognosis but not response to EGFR-targeted agents in colorectal cancer〔J〕.Br J Cancer,2012;106(11):1826-32.
9 李 楠,李夏雨,黄 铄,等.miR-126靶向调控IRSI,SLC7A5及TOMI基因抑制结肠癌的增殖及侵袭转移〔J〕.中南大学学报(医学版),2013;38(8):809-17.
10 林孟波,王金泗,薛芳沁,等.miR-126在人结肠癌细胞中的表达及其对结肠癌细胞生物学行为的影响〔J〕.疑难病杂志,2014;13(4):395-8.
11 杨爱萍,姜 藻,陈 静.Musashi-1、Ki-67的表达与食管鳞癌的临床意义[J].中国现代医生,2009;47(32):58-60.
