阿魏酸改性明胶的性质变化研究
2015-08-02姚力赟陈广荣刘海英
姚力赟,陈广荣,王 荣,刘海英,*
(1.江南大学食品学院,江苏无锡 214122;2.泰兴市江泰水产专业合作社,江苏泰兴 225400)
阿魏酸改性明胶的性质变化研究
姚力赟1,陈广荣1,王 荣2,刘海英1,*
(1.江南大学食品学院,江苏无锡 214122;2.泰兴市江泰水产专业合作社,江苏泰兴 225400)
本文将不同浓度的阿魏酸用于明胶改性,用以研究其对明胶凝胶强度、流变性等主要性质的影响。利用凝胶强度检测、流变学分析、红外分析、X-射线衍射和扫描电镜分析法对明胶改性前后的性质做了分析比较。结果表明,阿魏酸可以提高明胶的凝胶强度和熔点。当阿魏酸总浓度为2.00 g/L时,明胶的凝胶强度得到明显提高。通过红外光谱的分析和X-射线衍射分析可以证实阿魏酸分子与不同的肽链交联,拉近了肽链之间的距离,使肽链间连接更紧密,而交联作用的主要作用力是氢键。本文研究表明,阿魏酸在特定浓度下可作为明胶良好的改性剂。
阿魏酸,明胶,改性,凝胶强度
明胶是从动物结缔或表皮组织中胶原部分水解得到的蛋白质[1],具有很多优良的性质,如胶体保护性、表面活性、浸润性、可逆性等,因此在食品、医药、照明、印染、皮革、造纸等方面也有重要的应用。但是由于明胶热稳定性差和机械强度差,给其应用带来了不便。应用化学处理,通过侧链交联反应可以改变明胶中蛋白的网状结构,改善明胶的物化特性和生物活性[2-3],扩大明胶应用范围。阿魏酸(Ferulic Acid)的化学名称为4-羟基3-甲氧基肉桂酸,是桂皮酸的衍生物之一,是一种广泛存在于植物中的酚酸,在当归、川芎、咖啡、谷壳、麦麸、米糠等原料中有较高含量[4]。阿魏酸及衍生物的药理作用和生物活性。促进血小板的解聚,解除血管平滑肌痉挛[5],抗氧化和自由基作用。阿魏酸分子中的酚羟基和羧基作为活性基团,能与明胶的侧链形成氢键,从而促进明胶有效的交联,改善明胶的理化性质,从而使其在食品和医药行业应用更为广泛。根据分子结构分析,阿魏酸理论上可以成为明胶的改性剂,但是还未见单独利用阿魏酸改性明胶的报道。
本研究的目的在于尝试利用具备一定生物活性的阿魏酸改性明胶,研究其改性效果及合适浓度,为明胶改性找到新的方法。
1 材料与方法
1.1 材料与仪器
明胶与阿魏酸 均为化学纯,购自国药集团化学试剂有限公司。
TA-XT2质构测试仪 英国Godalming公司;AR1000型流变仪 英国TA公司;MlocroMoDuLYo-230型真空冷冻干燥机 美国Thermo Savant公司;NEXUS470型傅立叶变换红外光谱仪 美国NICOLET公司;D8 Advance型X-射线衍射仪 德国Bruker AXS公司。
1.2 实验方法
1.2.1 明胶凝胶强度的测定 不同浓度阿魏酸改性明胶制备:通过预实验确定阿魏酸的浓度范围,将阿魏酸配制成浓度分别为0、1.11、2.22、3.33、4.44 g/L的溶液,分别加入一定浓度的50 ℃明胶溶液,制成阿魏酸最终浓度为0、0.67、1.33、2.00、2.67 g/L的明胶溶液,明胶溶液最终浓度为66.7 g/L。以上溶液搅拌均匀后,在振荡器中继续50 ℃保温30 min,装入标准冻力瓶,于室温冷却成胶,之后置于10 ℃恒温箱中保温17 h[6]。
本实验采用TA-XT2质构测试仪测定,测定条件为:柱塞P 0.5~12.67 mm;下压 4 mm,Force 5 g,压入后速度1 mm/s。测定步骤:将样品在质构仪圆台上放平,柱塞对准胶面中心后下压,记录最大力[5]。
1.2.2 明胶流变性的测定 制备1.2.1中不同浓度阿魏酸改性明胶溶液,分别取1 mL倒入培养皿中,厚度大约为1 mm。于室温冷却成胶,之后置于10 ℃恒温箱中保温17 h[6]。
采用流变仪测定样品流变性能[6]:平行板60 mm,磨具锥角为2,夹缝为0.500 mm;扫描频率为1 Hz,蠕变应力为3.0 Pa。测定方式为温度扫描。明胶样品4 ℃保温,至于流变仪上平衡至5 ℃,然后升温至40 ℃,升温速率为1 ℃/min;在40 ℃保温5 min后,降温至5 ℃,降温速率为1 ℃/min,在升温和降温过程中分别测量弹性模量(G′)、粘性模量(G″)和相角(δ)。
1.2.3 明胶红外性质的测定 阿魏酸改性明胶,冷冻干燥。测定条件:全反射法,扫描范围:4000~400 cm-1[7]。
1.2.4 明胶微观结构的观测 制备1.2.1中不同浓度阿魏酸改性明胶溶液,分别取10 mL倒入培养皿中,厚度大约为1 mm。于室温冷却成胶,之后置于10 ℃恒温箱中保温17 h,使其成为的凝胶态明胶膜,在常温下放置,自然风干。
电镜测试方法:将制备好的膜固定在样品台上,在真空状态下离子镀膜机表面喷金20~30 min,厚度约10 μm。将样品放入扫描电子显微镜中抽真空20 min,观察膜的表面结构。电子束的加速电压为20 kV。
1.2.5 明胶的X-射线衍射测试 按照1.2.4中方法制备风干明胶样品。
X-射线衍射分析的条件:采用铜靶Cu Kα(λ=0.15406 nm),功率为1600 W(40 kV×40 mA),采用NaI晶体闪烁计数器(scintillation counter)测量X-射线的强度,扫描范围为3°~90°,扫描速度4 °/min,步长0.02°。DS-SS-RS设置分别为1 mm-1 mm-0.1 mm[发散狭缝(简称DS)、防散射狭缝(简称SS)、接受狭缝(简称RS)]。
1.3 数据统计分析
实验数据采用EXCEL软件进行处理分析。
2 结果与分析
2.1 改性明胶凝冻强度的测定
凝冻强度是决定商品明胶价值的最重要的物理性能,勃卢姆凝胶强度法是测定明胶凝胶强度的通用方法[8]。
阿魏酸分子中有酚羟基和羧基,可以与明胶分子的肽基,羟基和氨基形成氢键,使明胶各分子连接更加紧密,如图1所示,当阿魏酸浓度逐渐增加到1.33 g/L时,明胶的凝胶强度无明显变化。而当阿魏酸的浓度为2 g/L时,明胶的凝胶强度急剧升高将近30%。而当阿魏酸浓度继续增加至2.67 g/L时,明胶的凝胶强度略有减小。通过将阿魏酸改性明胶的凝胶强度分别与空白明胶的凝冻强度进行显著性分析(t-检验)可以发现,浓度为2、2.67 g/L 阿魏酸改性明胶的凝胶强度与空白明胶的凝胶强度差异及其显著。阿魏酸的浓度继续增加时,凝胶内可见微小固体颗粒。应该是过量的阿魏酸所携带的酚羟基造成明胶肽链的凝聚,从而产生颗粒,降低了凝胶内部的交联度[9]。

图1 不同浓度的阿魏酸改性明胶的凝胶强度Fig.1 Gel strength values of gelatin hydrogels treatedwith and without ferulic acid注:样本值(n=5)=平均值±标准差。
2.2 改性明胶的胶凝温度与熔化温度
明胶的水溶液在一定条件下可以凝聚为凝胶,而氢键在明胶的凝胶化中起着主导作用。氢键的生成和破坏与温度有着重要关系。明胶属于大分子聚合物,其热力学性质可利用流变学方法分析。相角在大分子的流变学中具有重要意义,它是指高聚物在交变应力场作用下,由于其分子链段在运动时受到内摩擦力的作用,使形变落后于应力变化,其落后的一个角频率δ就叫相位差,即相角。在动态粘弹性分析中,一般以tanδ=1作为明胶胶凝和融化的转折点,即其对应的温度分别为胶凝温度和熔化温度[10]。
明胶溶液黏度随温度的升高而减小,因为升高温度加速了分子的热运动,使缠结的分子链向疏散运动。所以,温度对明胶的流变行为影响显著[11]。如图2所示,温度升高时,凝胶内部的氢键逐步断裂,分子间的结合也慢慢松散,最后明胶由凝胶逐渐变为液态。温度降低时,如图3所示溶液中松散的肽链通过氢键重新交联到一起,形成紧密的网络结构,明胶从液态转化为凝胶态。对于具体的明胶来讲,其凝胶温度和熔化温度是确定的。

图2 升温过程中改性明胶相角的变化Fig.2 Evolution of the phase angle(rad)during heatingprogram of ferulic acid-gelatin solutions
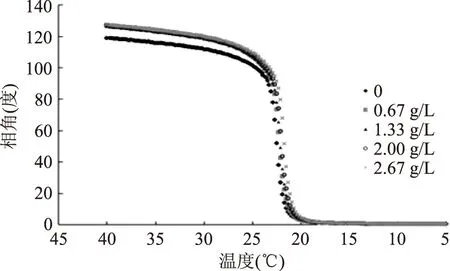
图3 降温过程中改性明胶相角的变化Fig.3 Evolution of the phase angle(rad)during coolingprogram of ferulic acid-gelatin solutions
由表1可知,低浓度的阿魏酸可以提高明胶的熔化温度。这是因为低浓度阿魏酸与明胶的肽链接触后,其分子的酚羟基和羧基与肽链上的肽基,羟基和氨基等基团生成氢键,使明胶的氢键数量增加,明胶凝胶需要更高的温度才能熔化[9]。阿魏酸浓度高于2.67 g/L时,明胶的熔化温度和凝胶温度会下降,这主要因为高浓度的阿魏酸提高了明胶溶液的离子强度,过量的阿魏酸所携带的酚羟基造成明胶肽链的凝聚,从而产生颗粒,降低了凝胶内部的交联度[9]。

表1 不同浓度阿魏酸改性明胶熔化温度和胶凝温度变化
2.3 明胶红外性质的测定
明胶的酰胺A带在出3300 cm-1左右出峰,对应于胶原中-NH和-OH的振动,其吸收峰位置与吸收强度与氢键缔合程度及三螺旋结构有序程度密切相关。位于2930 cm-1左右处的弱吸收是由酰胺B带的C-N伸缩振动产生。酰胺I带在1660 cm-1处出峰,是C=O和schiff碱(C=N)的伸缩振动的特征谱带[12-14]。酰胺II带位于1540 cm-1附近,主要为蛋白C-N伸缩振动与N-H弯曲振动的反映,其峰强度可以反映蛋白质二级结构中α螺旋相对含量的大小。酰胺III带位于1230 cm-1附近,主要为蛋白C-N伸缩振动与N-H弯曲振动。酰胺I带、II带和III带可以直接映蛋白多肽链的构象[15-16],它们的位置变化反映了氢键的变化情况。当新的氢键形成时,谱带将向低波数移动,一般氢键越强,变化越明显。

图4 明胶的红外光谱图Fig.4 Fourier transform infrared spectrum ofgelatin xerogels treated with and without ferulic acid注:各图对应的阿魏酸浓度为a:0 g/L;b:0.67 g/L;c:1.33 g/L;d:2.00 g/L;e:2.67 g/L。
表2中可见,阿魏酸浓度为0.67 g/L改性明胶的谱带向高波数移动不明显。阿魏酸的浓度分别为1.33、2.00、2.67 g/L时,改性明胶的酰胺A带移动明显,分别向低波数移动26.20、93.91、79.85 cm-1,说明明胶与阿魏酸交联后形成大量氢键。阿魏酸的浓度为2.00 g/L时,酰胺A带蓝移最为明显,表明其氢键结合数量最多。在酰胺Ⅱ带的出峰处,改性明胶的谱带发生明显的漂移,向低波数移动。阿魏酸的浓度为2.00 g/L时,酰胺Ⅱ带蓝移最为明显,其能量增强,氢键结合数量最多。红外的结果与明胶凝胶强度结果的趋势相一致,即相比空白样品,阿魏酸的浓度为2.00 g/L时,改性明胶也获得了最大的凝胶强度。改性后明胶凝胶的酰胺I带向高波长漂移不明显,说明明胶分子之间距离并未明显缩短,只是分子之间的氢键作用加强[6]。

表2 空白明胶和改性明胶在红外图谱中的特征峰的出峰处
2.4 微观结构的观测
明胶膜在常温下自然风干后,改性与未改性的明胶膜表面状态没有明显差异。由于干燥时水分逐渐散失,明胶分子与水交联生成的氢键断裂,并逐步向内部聚拢取代水分子原来的空间位置,与其它分子形成新的氢键,各分子间距离缩小,连接紧密。明胶的网络结构经过阿魏酸交联后,内部分子结合方式会发生一定变化,但这种变化不明显,明胶膜的表面仍然平滑。

图5 电镜观测到的各明胶样品表面图Fig.5 SEM surface images of gelatin xerogel treatedwith and without ferulic acid注:各图对应的阿魏酸浓度为a:0 g/L;b:0.67 g/L;c:1.33 g/L;d:2.00 g/L;e:2.67 g/L。

图6 空白明胶和阿魏酸改性明胶X-射线衍射图谱Fig.6 X-ray diffraction diagrams ofgelatin xerogels treated with and without ferulic acid注:图谱自上而下,对应的阿魏酸浓度(g/L)分别为:0,0.67,1.33,2.00,2.67。
2.5 明胶X-射线衍射分析
明胶X-射线衍射图谱会出现两个特征峰(图6)。左侧第一个峰(C峰)表示肽链间的距离,距离越小,肽链结合越紧密[17],而第二个峰(A峰)与漫散射有关。肽链间的距离可用d值来表征,即蛋白质间结晶面的距离[18]。d值变小,说明肽链距离缩短,分子结合更加紧密。本次实验测定的空白明胶和改性明胶的衍射图谱出峰处与d值如表3所示,加入阿魏酸后明胶C峰的d值均有所减小,可能是加入阿魏酸后,阿魏酸分子与不同的明胶肽链生成氢键,拉近了肽链之间的距离。但加入不同浓度的阿魏酸时,对d值的影响不大。这与红外分析结果相一致,说明明胶分子之间的氢键虽然加强,但是分子间距离并未明显减小。

表3 明胶改性前后X-射线衍射图谱出峰处和d值
3 结论与讨论
本研究分析了阿魏酸改性明胶前后的性质变化。结果发现阿魏酸可以提高明胶的凝胶强度,其中当阿魏酸的浓度为2.00 g/L时,达到最大值。阿魏酸可以提高明胶的凝胶强度和熔点,但作用不明显。通过红外光谱的分析,发现改性明胶的酰胺A带和酰胺Ⅱ带的吸收峰较向低波数明显漂移,这个现象表明有氢键产生。通过X-射线衍射分析证实,阿魏酸分子与不同的肽链交联,拉近了肽链之间的距离,使肽链间连接更紧密。
由上述结论可以推出,阿魏酸可以用于改性明胶,其机理是阿魏酸分子的酚羟基和羧基与明胶的肽链生成氢键。本文的研究结果表明,适当添加阿魏酸可以改善明胶的凝胶强度。阿魏酸改性明胶的生物学性质有待进一步研究。
[1](英)沃德(Ward,A.G.),(英)考茨(Courts,A.)主编;李文渊译.明胶的科学与工艺学[M].北京:轻工业出版社,1982.
[2]邵士凤,赵新淮,孙红梅.植物单宁酸交联明胶的条件优化及其性质分析[J].农业工程学报,2009,25(Supp.1):241-245.
[3]黄壁成,李承献. 提高鱼明胶凝冻强度的研究进展[J].明胶科学与技术,2013,33(3):139-142.
[4]方文贤主编. 医用中药药理学[M].北京:人民卫生出版社,1998.
[5]胡益勇,徐晓玉.阿魏酸的化学和药理研究进展[J].中成药,2006,8(2):253-555.
[6]陈颖佳,李文丽,刘海英.改性后明胶的性质变化研究[J].食品与发酵工业,2009,35(10):40-43.
[7]王毅虎,王颖,张兵. 傅里叶变换红外光谱在区分牛明胶和猪明胶方面的潜在应用[J].明胶科学与技术,2011,31(3):140-144.
[8]郭明勋,陈伯录,黄思华. 明胶凝胶强度测试的讨论[J]. 明胶科学与技术,1993,4:202-204.
[9]G. Strauss,S.M. Gibson. Plant phenolics as cross-linkers of gelatin gels and gelatin-based coacervates for use as foodingredients[J]. Food Hydrocolloids,2004,18:81-89.
[10]陈克复,卢晓江,金醇哲,等.食品流变学及其测量[M]. 北京:中国轻工业出版社,1989.
[11]黄哲,王锐. 明胶水溶液流变学行为的研究[J].明胶科学与技术,2012,32(2):64-69.
[12]刑本刚,梁宏. FT-IR在蛋白质二级结构研究中应用进展[J].广西大学学报:自然科学版,1997,15(3):45-49.
[13]翁武银,吴菲菲,大迫一史,等. 蛋白浓度对罗非鱼皮明胶高温干燥成膜的影响[J]. 农业机械学报,45(7):209-215.
[14]涂宗财,黄涛,王辉,等.3 种淡水鱼鳞明胶成膜性的比较[J]. 食品与发酵工业,2014,40(2):151-154.
[15]Krimm S,Bandekar J.Vibrational analysis of peptides,polypeptides and proteins.V.Normal vibrations of β-turns[J]. Bioplymers,1980,19(1):1-29.
[16]李季衡,李洋,李国英.戊二醛对胶原溶液热稳定性的影响[J]. 皮革科学与工程,2009,19(1):14-17.
[17](美)舍伍德(Sherwood,D.)著;范世藩译.晶体、X射线和蛋白质[M].北京:科学出版社,1985.
[18]夏雨,焦志华,刘海英. 茶多酚对明胶的改性作用[J]. 食品与发酵工业,2011,37(10):36-40.
Effect of ferulic acid on the properties of gelatin
YAO Li-yun1,CHEN Guang-rong1,WANG Rong2,LIU Hai-ying1,*
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Taixing Jiangtai Aquatic Professional Cooperatives,Taixing 225400,China)
Ferulic acid was added to gelatin,and the changes in the gelatin were characterized to determine the effect of ferulic acid modification. The microstructural changes in the samples were analyzed using Fourier transform infrared spectroscopy(FTIR),X-ray diffraction(XRD),and scanning electron microscopy(SEM). The results indicated that the gel strength and thermal stability of gelatin could be improved by appropriate ferulic acid addition. The gel strength of gelatin was obviously improved when the concentration of ferulic acid was 2.00 g/L. The result was also verified hydrogen bonds were the main molecular interactions observed in the ferulic acid-gelatin samples using FTIR and XRD. The study showed that certain concentration of ferulic acid could be a good modifier of gelatin.
ferulic acid;gelatin;modification;gel strength
2014-09-09
姚力赟(1993-),男,本科,研究方向:食品资源综合利用,E-mail:weijingren22@sina.com。
*通讯作者:刘海英(1973-),男,博士,副教授,研究方向:胶原蛋白、水产品加工及贮藏工程,E-mail:liuhaiying@jiangnan.edu.cn。
中央高校基本科研业务费专项资金资助(JUSRP21010)。
TS254.9
A
1002-0306(2015)15-0083-05
10.13386/j.issn1002-0306.2015.15.009
