新等温扩增技术检测小肠结肠炎耶尔森氏菌
2015-07-25张霞温华蔚倪松王禹王淞高琳刘掘茫郑文杰天津出入境检验检疫局天津300461
张霞,温华蔚,倪松,王禹,王淞,高琳,刘掘茫,郑文杰(天津出入境检验检疫局,天津300461)
新等温扩增技术检测小肠结肠炎耶尔森氏菌
张霞,温华蔚,倪松,王禹,王淞,高琳,刘掘茫,郑文杰*
(天津出入境检验检疫局,天津300461)
摘要:应用新型等温扩增检测技术——交叉引物等温扩增结合免疫金标试纸条建立检测小肠结肠炎耶尔森氏菌的方法。针对小肠结肠耶尔森氏菌16-23S rDNA间区序列设计特异性引物及探针,用54株小肠结肠炎耶尔森氏菌及相近株细菌进行特异性试验;通过纯菌液计数、样品中添菌检测进行灵敏度验证;对677份食品用传统生化国标法进行比较检测试验。建立方法具有较好特异性;增菌液检测灵敏度为101cfu/mL,当每25 g样品中有100cfu菌时经增菌步骤后即可检出,样品检测同传统检测结果比较大致相符,没有漏检,假阳性率较低。建立的新型恒温检测方法可用于食品中小肠结肠炎耶尔森氏菌初筛检测。
关键词:交叉引物等温扩增技术;小肠结肠炎耶尔森氏菌;食品安全检测
小肠结肠炎耶尔森氏菌是肠杆菌科、耶尔森菌属的一个种,1974年被Bergey的细菌学鉴定手册“第八版”列入肠杆菌科耶尔森氏菌属[1]。小肠结肠炎耶尔森氏菌具有致病性强、致病范围广、容易传播等特点。本菌所致疾病涉及临床各科,按其病型可分为胃肠炎型和肠道外感染两种,可导致严重的并发症,如心肌炎、亚急性肝炎、结膜炎、眼炎、关节炎、急性肾小球肾炎、胆囊炎、尿道炎、脑膜炎,甚至可以引起败血病,其死亡率可达34%~50%[2]。同时,由于该菌的生存条件极广,生长温度0℃~44℃,甚至报道在-2℃仍可生存,适应中强酸碱。因此,小肠结肠炎耶尔森氏菌是对人类身体健康具有极大威胁的一种细菌。
由于经典检验方法耗时长、操作繁杂,为防控该菌的危害,保障人民的健康和生命安全,快速、特异性强的分子生物学诊断技术研究广泛进行。目前针对小肠结肠炎耶尔森氏菌PCR方法[3-5]、实时荧光PCR技术[6]、芯片杂交技术[7]及环介导[8]、滚环恒温扩增方法[9]等均有报道,成为日常规检测的工具。
本研究旨在应用新型交叉引物等温扩增技术[10]建立检测方法,其结合免疫金试纸条检测方法,避免LAMP方法结果检测需要电泳使用EB危害、PCR产物污染等问题,将分子生物学检测进一步推广。
1 材料与仪器
1.1主要材料与试剂
Bst DNA polymerase large fragment:New England Biolabs;10×Bst buffer:New England Biolabs;dNTPs:Fermentas;MgSO4:Sigma;betaine:Sigma;核酸快速检测试纸条:优思达公司。
菌株采用4株ATCC和23株CMCC小肠结肠炎耶尔森氏菌标准菌株(涉及27个血清型),9株其它ATCC耶尔森氏菌属标准菌和其它近缘菌属18株ATCC标准菌株,详见表1。
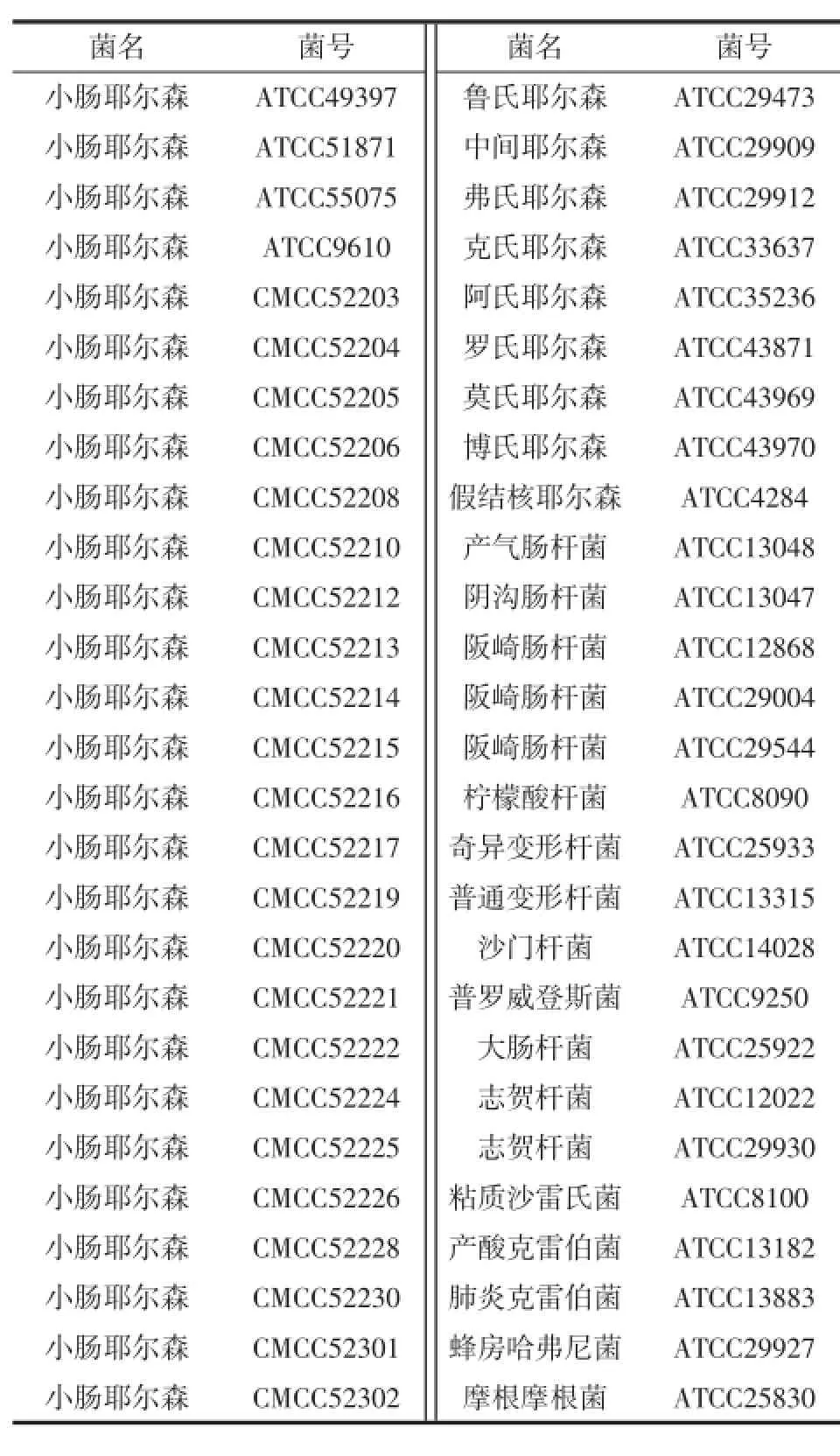
表1 试验菌株Table 1 Bacterial strains for detection
1.2主要仪器与设备
PCR仪(Bio-rad,C1000 Touch)、离心机(Eppendorf,5417R)。
1.3方法
1.3.1引物及探针的设计
利用细菌16 s-23 s rDNA间区序列[11-12](GenBank Accession No.AM286415)设计特异性引物见表2。

表2 检测引物序列Table 2 Primers sequence for the detection
1.3.2反应体系和反应条件
各试剂浓度为:CR/CF引物各0.4μmol/L,DR/DF引物各0.8μmol/L,DF/DP各0.1 μmol/L,0.5 mmol/L dNTPs,Bst DNA酶6个单位,2 μL 10×Bst buffer,0.5 mol/L betaine,4 mmol/L MgSO4,1 μL DNA模板。
反应条件:63℃反应60 min。
1.3.3特异性试验
对表1中菌株核酸样本进行试验,以证明交叉引物等温扩增检测方法是否具有通用性及特异性。
1.3.4灵敏度试验
以小肠结肠炎耶尔森氏菌ATCC49397为试验菌株,37℃培养16 h,取1 mL进行纯菌液计数后10倍稀释,按照CPA反应体系进行试验。
1.3.5样品添菌检测
取经证实不含目标菌的奶粉样品A、B在增菌前分别添加101、100cfu/25 g小肠结肠炎耶尔森氏菌ATCC49397菌液1mL,混匀1min,加入增菌液225mL,37℃培养12 h,取1 mL样品增菌液按照本研究方法进行检测,未添加菌的样品A、B作为空白对照,同时做细菌计数。
1.3.6实际样品检测
应用建立的CPA检测方法,在出入境食品的日常检测工作中和国家标准GB/T 4789.8-2008《食品卫生微生物学检验小肠结肠炎耶尔森氏菌检验》进行比较试验,共进行677份5类不同样品检测工作。
2 结果与分析
2.1特异性试验
54株实验菌株进行特异性实验,其中27株小肠结肠炎耶尔森氏菌(4株ATCC、23株CMCC标准菌株),检测结果全部为阳性见图1。

图1 小肠结肠炎耶尔森氏菌交叉引物等温扩增检测Fig.1 CPA amplification for Y.enterocolitica strains
其显示了部分阳性菌株检测结果;另外27株阴性对照菌,包括9株ATCC耶尔森氏菌属标准菌和其它近缘菌属18株ATCC标准菌株,结果全部为阴性见图2。

图2 阴性对照菌检测结果Fig.2 CPA amplification for non-Y.enterocolitica strains
表明近缘菌株都无假阳性出现,说明交叉引物等温扩增结合免疫金标试纸条检测方法特异性良好,而且对小肠结肠炎耶尔森氏菌全血清型具有很好的通用性。
2.2检测灵敏度
2.2.1纯菌液检测
试验菌株ATCC49397过夜培养后菌液浓度为8.6×108cfu/mL,用PBS对菌液进行10倍梯度稀释至100cfu/mL数量级,各取1 mL提取DNA做实验模板,进行灵敏度检测,检测结果见图3。

图3 小肠结肠炎耶尔森氏菌交叉引物等温扩增纯菌液灵敏度检测Fig.3 Sensitivity of CPA detection for Y.enterocolitica pure culture
108cfu/mL~101cfu/mL菌液浓度时全部为阳性,100cfu/mL时,检测结果为阴性。
2.2.2样品添菌实验
对准备添菌的空白样品细菌计数,本底杂菌数为3.4×102cfu/g,向样品中添菌8.6及86 cfu/25 g,经12 h增菌后,取1 mL增菌液做CPA检测,结果为阳性,说明在有其他干扰菌的情况下,样品有目标菌100cfu/25 g时,经增菌后可以检出。
2.3实际样品检测
对本实验室日常检测的5类不同种类的677份食品样品分别用传统生化国标法与CPA两种方法进行比较检测试验,结果见表3。

表3 实际样品检测结果Table 3 The detection result of samples
CPA阳性检出高于国家标准方法。以国标法为基准方法进行CPA方法性能指标的评价,结果见表4。
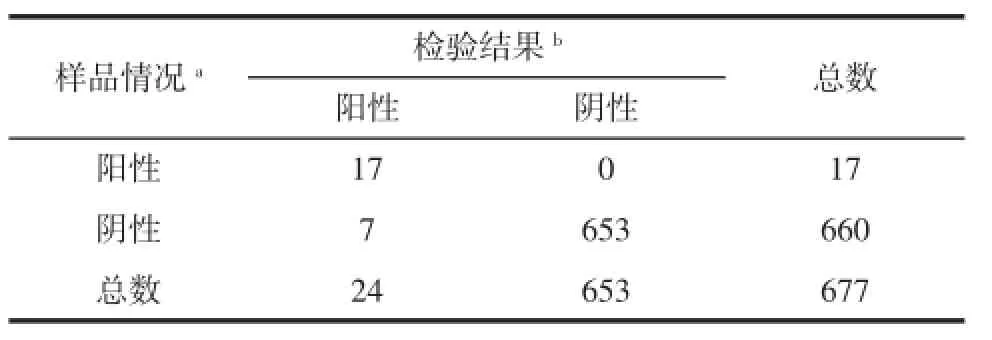
表4CPA检测性能指标评价结果Table 4 The reslut of CPA performance
CPA方法的假阴性率=0/17=0、假阳性率=7/653= 1.07%。
通过表4数据及该方法的假阴性率为0、假阳性率为1.07%,可以看出,同传统的检测结果大致相符,没有漏检情况,有可能出现假阳性,但发生率较低,说明CPA方法,对食品中小肠结肠炎耶尔森氏菌的检测结果达到准确、可靠。
3 结论
目前国内针对食品中小肠结肠炎耶尔森氏菌检测方法主要以国家标准为依据,该标准方法依赖于传统的分离培养、镜检观察、生化鉴定、血清学分型等实验,一般的检测周期在5 d~7 d左右,存在着检验周期长,工作量大等缺点,不再适用于日益增长的进出口食品贸易。随着现代科学技术的不断发展,特别是分子生物学的不断发展,人们已创建了不少快速、特异、敏感的快速检测方法,如荧光PCR法、基因芯片检测方法等,但全部以大型的仪器设备和熟练的专业技能为前提,不适合于在基层及偏远经济不发达地区应用,而目前食品安全的现状是亟待提高基层及经济不发达地区的检测实力。
等温扩增检测方法应运而生,为快速基因检测提供了新的技术途径,相较上述方法更具推广性。通过本研究团队建立致病菌CPA检测体系发现,由于引物设计原理的不同,CPA法实际检测灵敏度要略高于环介导等温扩增方法[14-16],但是由于样品增菌后目标菌浓度一般可达到104cfu/mL左右,二者添菌试验检测灵敏度一致,均可应用于基层实验室检测以及样品的快速筛选检测。但是本研究检测方法是结合免疫金标试纸条的方法,避免了环介导等温扩增方法使用电泳时PCR产物的二次污染和EB对人体的危害,或是使用观察沉淀、颜色变化造成的不客观性,在结果观察方面CPA明显优于环介导等温扩增方法,所以比较易于在实际检测工作中推广使用。
参考文献:
[1] 于恩庶.中国小肠结肠炎耶尔森氏菌病研究进展[J].中华流行病学杂志,2002,21(6):453-455
[2]Fredriksson-Ahomaa M,Korkeala H.Low occurrence of pathogenic Yersinia enterocolitica in clinical,food,and environmental samples: a methodological problem[J].Clinical microbiology reviews,2003, 16(2):220-229
[3]Ibrahim A,Liesack W,Griffiths M W,et al.Development of a highly specific assay for rapid identification of pathogenic strains of Yersinia enterocolitica based on PCR amplification of the Yersinia heat-stable enterotoxin gene(yst)[J].Journal of clinical microbiology,1997,35(6):1636-1638
[4]Thoerner P,Kingombe C I B,Bögli-Stuber K,et al.PCR detection of virulence genes in Yersinia enterocolitica and Yersinia pseudotuberculosis and investigation of virulence gene distribution[J].Applied and environmental microbiology,2003,69(3):1810-1816
[5]Weynants V,Jadot V,Denoel P A,et al.Detection of Yersinia enterocolitica serogroup O:3 by a PCR method[J].Journal of clinical microbiology,1996,34(5):1224-1227
[6]温和心,蒋荣华,王杰,等.猴小肠结肠炎耶尔森氏菌实时荧光PCR快速检测方法的建立[J].实验动物与比较医学,2011,31(2):92-95
[7]Siddique N,Sharma D,Al-Khaldi S F.Detection of Yersinia enterocolitica in alfalfa,mung bean,cilantro,and mamey sapote(Pouteria sapota)food matrices using DNA microarray chip hybridization[J]. Current microbiology,2009,59(3):233-239
[8]Zhang H,Feng J,Xue R,et al.Loop-Mediated Isothermal Amplification Assays for Detecting Yersinia pseudotuberculosis in Milk Powders[J].Journal of food science,2014,79(5):967-971
[9]姜英辉,张健,雷质文,等.小肠结肠炎耶尔森氏菌滚环扩增检测方法的建立[J].食品研究与开发,2013,31(22):61-63
[10]Fang R,Li X,Hu L,et al.Cross-priming amplification for rapid detection of Mycobacterium tuberculosis in sputum specimens[J]. Journal of clinical microbiology,2009,47(3):845-847
[11]Simon Lee.Analysis of the 16s-23s rDNA intergenic spacers of marine vibrios for species-specific signature DNA sequences[J].Marine Pollution Bulletin,2002,44(5):412-420
[12]Liao D.Gene conversion drives within genic sequences:concerted evolution of ribosomal RNA genes in bacteria and archaea[J].Journal of Molecular Evolution,2000,51(4):305-317
[13]张霞,吴冬雪,曲鹏,等.一种新的等温扩增技术检测阪崎肠杆菌[J].食品科学,2013,34(2):187-190
[14]刘旸,张海英,刘国红,等.单增李斯特氏菌快速检测方法的建立[J].食品研究与开发,2012,33(9):134-136
[15]祁军,张霞,蒋刚强,等.交叉引物等温扩增技术检测志贺氏菌[J].食品研究与开发,2013,34(11):65-68
[16]Liu C,Zheng W,Zhang H,et al.Sensitive and rapid detection of enterobacter sakazakii in infant formula by loop-mediated isothermal amplification method[J].Journal of Food Safety,2009,29(1):83-94
DOI:10.3969/j.issn.1005-6521.2015.23.030
收稿日期:2015-09-01
基金项目:质检总局科研《生态港外来有害动植物疫病及食源性致病菌风险控制措施研究》资助(2014IK222)
作者简介:张霞(1975—),女(汉),高级工程师,硕士研究生,研究方向:食品安全检测。
*通信作者:郑文杰(1969—),女,博士,研究员,研究方向:食品安全检测。
Detection of Yersinia enterocolitica by a New Isothermal Amplification
ZHANG Xia,WEN Hua-wei,NI Song,WANG Yu,WANG Song,GAO Lin,LIU Jue-mang,ZHENG Wen-jie*
(Tianjin Entry-Exit Inspection and Quarantine Bureau,Tianjin 300461,China)
Abstract:To develop a cross-priming amplification(CPA)combined with immunoblotting analysis method for the detection of Yersinia enterocolitica on food.Specific primers and probe were designed on the basis of six specific sequences in Y.enterocolitica 16S-23S rDNA internal transcribed spacer.The specificity of the method was evaluated by 54 different bacterial strains.The sensitivity of the method was evaluated by pure bacteria counted and the sample of adding Y.enterocolitica.To detect 677 samples comparing with the biochemical and culture-based assays.All of the Y.enterocolitica strains showed positive results,and the other bacteria gave negative results.The limit of detection of the CPA method was 101cfu/mL for bacteria in pure culture,and 100cfu per 25 g of sample with pre-enrichment.The result of sample detection was broadly consistent with the traditional detection,no omission,low false positive rate.This CPA method can be used for the rapid preliminary screening of Y.enterocolitica.
Key words:cross prime isothermal amplification;Y.enterocolitica;detection of food safety
