连翘叶多糖对小鼠免疫功能影响的研究
2015-07-25张岫秀蔡盈吴中梅高勇徐州市儿童医院江苏徐州22006徐州市医学科学研究所江苏徐州22006
张岫秀,蔡盈,吴中梅,高勇(.徐州市儿童医院,江苏徐州22006;2.徐州市医学科学研究所,江苏徐州22006)
连翘叶多糖对小鼠免疫功能影响的研究
张岫秀1,蔡盈1,吴中梅1,高勇2,*
(1.徐州市儿童医院,江苏徐州221006;2.徐州市医学科学研究所,江苏徐州221006)
摘要:研究连翘叶多糖对环磷酰胺(CTX)所致免疫低下模型小鼠的免疫调节功能。采用腹腔注射环磷酰胺制造免疫抑制小鼠模型,考察不同剂量连翘叶多糖对免疫抑制小鼠脏器指数、巨噬细胞吞噬功能、淋巴细胞增殖活性、血清IL-2和IL-4水平、溶血素水平和溶血空斑形成数量的影响。连翘叶多糖能明显提高环磷酰胺所致免疫抑制小鼠的胸腺指数、脾脏指数、巨噬细胞吞噬能力、脾淋巴细胞的增殖能力、血清中IL-2和IL-4水平、溶血素含量和溶血空斑形成数量。连翘叶多糖具有良好的免疫增强活性,在药品与功能食品的开发中具有较高的应用价值。
关键词:连翘叶;多糖;免疫功能
连翘(Forsythia suspense)为木犀科植物,是我国一种传统的中药材,广泛分布在河北省太行山地区,主要含有连翘酚、连翘苷、连翘苷元、齐墩果酸、甾醇化合物、醛酮类、醇酯醚类挥发性成分[1],具有抗菌消炎、清热解毒、消肿散结、疏散风热等功效。连翘果实为连翘的主要入药部位,而大量的连翘叶却未得到充分利用,大部分被直接废弃,造成资源浪费。近年来,已有学者对连翘叶片黄酮类、皂苷类等成分进行了研究[2],而关于连翘叶片多糖类物质的研究却鲜见报道。多糖一般是由10个及以上单糖以α-糖苷键或β-糖苷键以不同的方式连接而成的极性大分子化合物,因其具有抗氧化、抗病毒、抗肿瘤、降血压、降血脂、免疫调节活性[3-5]而得到广泛关注和研究。本研究以连翘叶为原料,采用水提醇沉方法制备得到连翘叶粗多糖,研究了该多糖对小鼠免疫功能的影响。
1 试验材料
环磷酰胺(批号:H14023686):山西普德药业股份有限公司;RPMI-1640培养基:上海浩然生物技术有限公司;刀豆素A(ConA):北京中生瑞泰科技有限公司;噻唑蓝(MTT):北京索莱宝科技有限公司;二甲基亚砜(DMSO):北京索莱宝科技有限公司;白细胞介素-4(IL-4)试剂盒:美国BD公司;白细胞介素-2(IL-2)试剂盒:美国BD公司;DEAE-Cellulose52:上海纯优生物科技有限公司;其余试剂均为分析纯。
RE52CS-1旋转蒸发仪:上海亚荣生化仪器厂;FD-1B-50冷冻干燥机:北京博医康实验仪器有限公司;752PC型紫外可见分光光度计:上海光谱仪器有限公司;MK3型酶标仪:Thermo Fisher。
连翘叶:购于安徽亳州;鸡:健康家鸡;豚鼠:健康豚鼠。
2 方法
2.1连翘叶多糖制备与含量测定
水提醇沉法制备连翘叶粗多糖[6],粗多糖经Sevag法脱除蛋白,采用DEAE-Cellulose52柱层析分离获得高纯度连翘叶多糖。制备连翘叶片干粉,超声提取两次,过滤并合并滤液,浓缩,加入4倍体积的无水乙醇,静置过夜,离心取沉淀,真空干燥,得到连翘叶片粗多糖。粗多糖首先经Sevag法脱除蛋白3次,然后采用DEAE-Cellulose52柱层析分离,分别采用蒸馏水和0.5 mol/L NaCl洗脱,合并洗脱液,浓缩干燥,获得高纯度连翘叶多糖。采用苯酚-硫酸法[7]测定连翘叶片多糖含量。
2.2连翘叶多糖免疫活性测定
2.2.1小鼠造模、分组与给药
小白鼠(昆明种)购于河北医科大学动物室,雌雄各半,体重18 g~22 g,正常饲养适应一周,将小鼠随机分成5组,即正常组、模型组和给药组(连翘叶多糖高、中、低剂量组),每组10只,雌雄各半,各组体质量无统计学差异。正常组每天灌胃生理盐水0.3 mL和腹腔注射生理盐水0.3 mL,模型组每天灌胃生理盐水0.3 mL和腹腔注射CTX 20 mg/kg。3个给药组每天分别灌胃0.3 mL不同浓度的连翘叶多糖(高、中、低剂量分别为300、150、75 mg/kg)溶液,同时腹腔注射CTX 20 mg/kg。
2.2.2免疫器官脏器指数的测定[8]
按“2.2.1”方法进行小鼠分组、造模和给药处理。给药一周后将小鼠脱颈椎处死,于无菌条件下剥取脾脏、胸腺器官称重,计算脏器指数,脏器指数按式(1)计算。
脏器指数/(mg/g)=器官质量/体质量(1)
2.2.3腹腔巨噬细胞吞噬功能的测定[9]
按“2.2.1”方法进行小鼠分组、造模和给药处理。给药一周后腹腔注射5%的鸡红细胞0.5 mL进行免疫,10 h后处死,剪开腹部皮肤并用2 mL生理盐水冲洗腹腔,吸取冲洗液滴于载玻片上,37℃孵育30 min,用生理盐水漂洗,干燥后用丙酮和甲醇等比例混合溶液固定6 min~10 min,瑞氏染液染色,然后油镜下观察并计数,计算巨噬细胞吞噬率及吞噬指数,吞噬率及吞噬指数分别按式(2)和式(3)计算。


2.2.4脾淋巴细胞增殖活性的测定[10]
取“2.2.2”方法所得小鼠脾脏,常规制备脾细胞,用RPMI-1640培养液稀释至细胞浓度为2×106个/mL,各取400 μL至96孔培养板中,加入200 mg/L ConA溶液10 μL,培养基代替ConA溶液做对照,于37℃、5% CO2培养箱中培养72 h。培养结束前4 h各取上清液200 μL,加入已除菌的5 mg/mL MTT溶液40 μL,继续培养至结束。离心保留沉淀,各加入37℃DMSO300μL,振荡10 min,酶标仪测定570 nm处吸光值,计算淋巴细胞增殖指数,淋巴细胞增殖指数按式(4)计算。
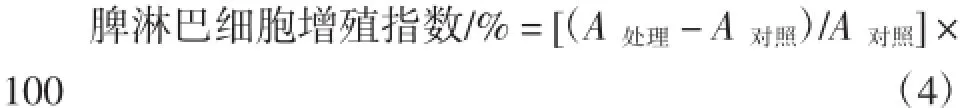
式中:A处理为加ConA孔吸光值;A对照为空白孔吸光值。
2.2.5血清中IL-2、IL-4的测定
按“2.2.1”方法进行小鼠分组、造模和给药处理。给药一周后各组小鼠摘眼球取血,3 000 r/min离心15 min,取血清,按试剂盒的说明操作,检测各组小鼠血清中IL-2和IL-4水平。
2.2.6溶血素及溶血空斑形成测定[11]
按“2.2.1”方法进行小鼠分组、造模和给药处理。给药第一天,小鼠腹腔注射5%的鸡红细胞0.3 mL进行免疫,末次给药1 h后摘取眼球取血,离心,取血清用生理盐水稀释100倍,取稀释血清2mL、5%鸡红细胞1 mL和10%新鲜豚鼠血清1 mL,混匀,以生理盐水代替豚鼠血清做空白对照,37℃保温30 min,4℃离心,取上清液,于540 nm处测定吸光值,检测溶血素水平。
小鼠取血致死后,取脾脏并匀浆,用都氏液稀释至细胞个数为5×109个/mL。取相同体积的脾细胞混悬液、0.2%鸡红细胞和10%新鲜豚鼠血清混匀。以生理盐水代替豚鼠血清做空白对照,37℃保温1 h,3 000 r/min离心15 min,取上清液,于413 nm处测定吸光值,检测溶血空斑数量。
2.3数据处理
数据采用SAS9.1软件进行统计分析,以平均值±标准差(±SD)表示数值,差异显著性分析采用单因素方差分析。
3 结果与分析
3.1连翘叶多糖含量测定
多糖含量测定标准曲线:Y=0.006 2x+0.053 7,R2= 0.995。连翘叶片纯化多糖的得率为4.12%,多糖含量为90.74%。
3.2连翘叶多糖对免疫抑制小鼠免疫器官指数的影响
不同剂量连翘叶多糖对免疫抑制小鼠胸腺和脏器指数的影响见表1。
由表1可以看出,与正常组相比,模型组小鼠脏器指数均显著降低(P<0.01),免疫抑制模型造模成功。与模型组相比,中、高剂量组连翘叶多糖可以显著增加胸腺重量(P<0.01),高剂量组多糖可以显著增加脾脏重量(P<0.01)。
3.3连翘叶多糖对免疫抑制小鼠腹腔巨噬细胞吞噬功能的影响
不同剂量连翘叶多糖对免疫抑制小鼠腹腔巨噬细胞吞噬能力的影响见表2。
表2 连翘叶多糖对免疫抑制小鼠腹腔巨噬细胞吞噬功能的影响(±SD)Table 2 Effect of FLP on abdominal cavity macrophage function in immunosuppressive mice(±SD)
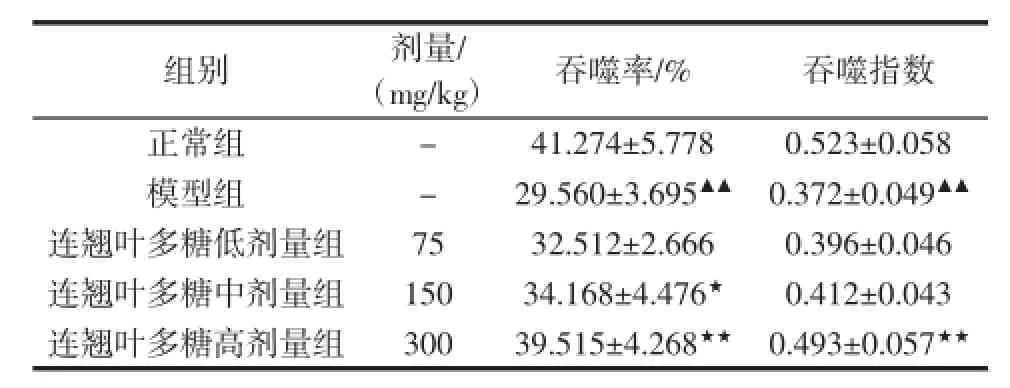
表2 连翘叶多糖对免疫抑制小鼠腹腔巨噬细胞吞噬功能的影响(±SD)Table 2 Effect of FLP on abdominal cavity macrophage function in immunosuppressive mice(±SD)
注:▲▲与正常组比较P<0.01;★与模型组比较P<0.05;★★与模型组比较P<0.01;-表示未测定。
组别 剂量/ (mg/kg) 吞噬率/% 吞噬指数正常组 - 41.274±5.778 0.523±0.058模型组 - 29.560±3.695▲▲ 0.372±0.049▲▲连翘叶多糖低剂量组 75 32.512±2.666 0.396±0.046连翘叶多糖中剂量组 150 34.168±4.476★ 0.412±0.043连翘叶多糖高剂量组 300 39.515±4.268★★ 0.493±0.057★★
由表2可以看出,与正常组相比,模型组小鼠巨噬细胞的吞噬功能显著降低(P<0.01),免疫抑制模型造模成功。中、高剂量组连翘叶多糖可显著提高巨噬细胞的吞噬功能,与模型组相比统计学差异明显(P< 0.05,P<0.01),高剂量组多糖可显著提高吞噬指数(P< 0.01),表明连翘叶多糖对免疫抑制小鼠巨噬细胞的吞噬功能具有促进作用。
3. 4连翘叶多糖对免疫抑制小鼠脾淋巴细胞增殖活性的影响
不同剂量连翘叶多糖对免疫抑制小鼠脾淋巴细胞增殖活性的影响见表3。
表3 连翘叶多糖对免疫抑制小鼠脾淋巴细胞增殖活性的影响(±SD)Table 3 Effect of of FLP on lymphocyte proliferation in immunosuppressive mice

表3 连翘叶多糖对免疫抑制小鼠脾淋巴细胞增殖活性的影响(±SD)Table 3 Effect of of FLP on lymphocyte proliferation in immunosuppressive mice
注:▲▲与正常组比较P<0.01;★与模型组比较P<0.05;-表示未测定。
组别 剂量/(mg/kg) 脾淋巴细胞增殖指数正常组 - 87.240±8.201模型组 - 67.347±8.351▲▲连翘叶多糖低剂量组 75 69.672±7.664连翘叶多糖中剂量组 150 72.274±7.011连翘叶多糖高剂量组 300 74.620±6.343★
由表3可以看出,与正常组相比,模型组小鼠脾淋巴细胞的增殖能力显著降低(P<0.01),免疫抑制模型造模成功。与模型组相比,高剂量组连翘叶多糖可以显著增强免疫抑制小鼠脾淋巴细胞的增殖能力(P< 0.05)。
3.5连翘叶多糖对免疫抑制小鼠血清中IL-2、IL-4含量的影响
不同剂量连翘叶多糖对免疫抑制小鼠血清中IL-2、IL-4含量的影响见表4。
表4 连翘叶多糖对免疫抑制小鼠血清中IL-2、IL-4含量的影响(±SD)Table 4 Effect of FLP on the the leval of IL-2 and IL-4 in immunosuppressive mice(±SD)

表4 连翘叶多糖对免疫抑制小鼠血清中IL-2、IL-4含量的影响(±SD)Table 4 Effect of FLP on the the leval of IL-2 and IL-4 in immunosuppressive mice(±SD)
注:▲▲与正常组比较P<0.01;★★与模型组比较P<0.01;-表示未测定。
组别 剂量/ (mg/kg) IL-2(pg/mL) IL-4(pg/mL)正常组 - 31.388±2.731 35.693±3.819模型组 - 13.045±1.426▲▲ 21.937±2.654▲▲连翘叶多糖低剂量组 75 14.859±2.360 23.746±2.018连翘叶多糖中剂量组 150 17.912±2.418★★ 26.524±2.097★★连翘叶多糖高剂量组 300 22.358±3.130★★ 33.231±3.560★★
由4可以看出,模型组小鼠血清中IL-2和IL-4含量显著降低(P<0.01),免疫抑制模型造模成功。与模型组相比,中、高剂量组连翘叶多糖可显著提高免疫抑制小鼠血清中IL-2和IL-4水平(P<0.01)。
3. 6连翘叶多糖对免疫抑制小鼠溶血素及溶血空斑形成的影响
不同剂量连翘叶多糖对免疫抑制小鼠溶血素及溶血空斑形成的影响见表5。
表5 连翘叶多糖对免疫抑制小鼠溶血素及溶血空斑形成的影响(±SD)Table 5 Effect of FLP on the formation of hemolysin and hemolytic plaque in immunosuppressive mice(±SD)
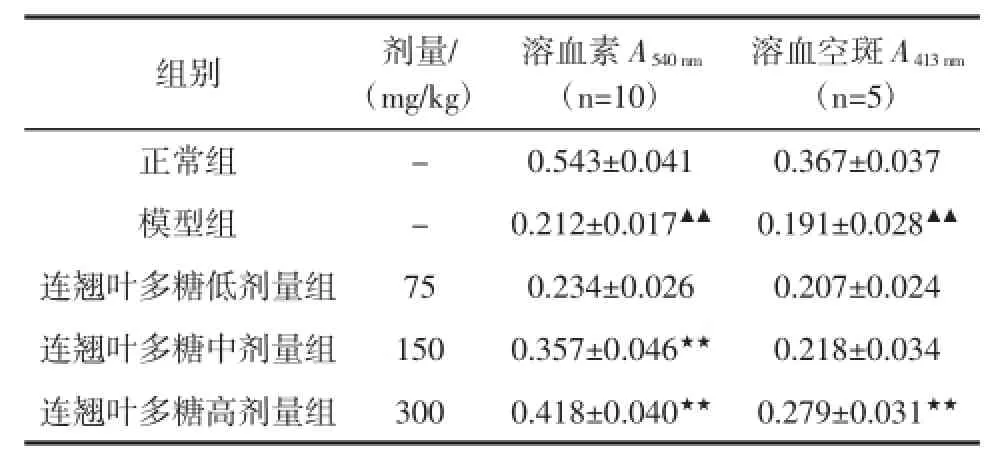
表5 连翘叶多糖对免疫抑制小鼠溶血素及溶血空斑形成的影响(±SD)Table 5 Effect of FLP on the formation of hemolysin and hemolytic plaque in immunosuppressive mice(±SD)
注:▲▲与正常组比较P<0.01;★★与模型组比较P<0.01;-表示未测定。
溶血空斑A413 nm(n=5)正常组 - 0.543±0.041 0.367±0.037模型组 - 0.212±0.017▲▲ 0.191±0.028▲▲连翘叶多糖低剂量组 75 0.234±0.026 0.207±0.024连翘叶多糖中剂量组 150 0.357±0.046★★ 0.218±0.034连翘叶多糖高剂量组 300 0.418±0.040★★ 0.279±0.031★★组别 剂量/ (mg/kg)溶血素A540 nm(n=10)
由表5可以看出,与正常组相比,模型组小鼠溶血素水平和溶血空斑形成数量显著下降(P<0.01),免疫抑制模型造模成功。与模型组相比,中、高剂量连翘叶多糖能够明显促进免疫抑制小鼠溶血素值升高(P< 0.01),高剂量连翘叶多糖能够明显增加溶血空斑数量(P<0.01),表明连翘叶多糖对提高免疫抑制小鼠体液免疫功能有一定作用。
4 讨论
环磷酰胺是临床抗肿瘤的基础药物,在取得较好疗效的同时对机体免疫系统有较大的损伤[13]。本文考察了不同剂量的连翘叶多糖对环磷酰胺导致的免疫功能低下小鼠免疫系统的修复能力。
机体免疫细胞大多分布于主要免疫器官胸腺和脾脏,两者的重量在一定程度上可反映免疫器官内淋巴细胞的数量,从而反映机体免疫能力的强弱;巨噬细胞是机体非特异性免疫系统的主要组成部分,可吞噬异体抗原,吞噬细胞数量的增加和吞噬能力的增强反映了机体非特异性免疫功能的增强。淋巴细胞增殖实验常用于评价动物免疫能力的强弱,其增殖率的高低可直接反应机体的T淋巴细胞或B淋巴细胞的免疫水平;IL-2和IL-4是由辅助性淋巴细胞分泌的细胞因子,能促进T、B淋巴细胞增殖、分化和抗体的产生,对机体的细胞免疫和体液免疫功能均有重要的促进作用;溶血素是小鼠血清抗体水平的指标,溶血空斑是抗体形成细胞的检测指标,血清溶血素含量高低和溶血空斑形成数量,可反映机体体液免疫功能的强弱。
本研究表明适宜剂量的连翘叶多糖能明显提高环磷酰胺所致免疫抑制小鼠的胸腺指数、脾脏指数、脾淋巴细胞的增殖能力、血清中IL-2和IL-4水平、溶血素水平和溶血空斑形成数量,表明连翘叶多糖具有良好的免疫增强活性,但其免疫调节机制尚不清楚。因此进一步纯化连翘叶多糖、研究各组分的免疫活性、各组分的相互作用对免疫活性的影响以及从细胞、分子等层面探讨多糖作用机制的工作有待于进一步展开。
参考文献:
[1]王曙宾,郑亚杰.连翘提取物和连翘酯苷A原料中连翘酯苷A的稳定性研究[J].中草药,2010,41(6):909-911
[2]王燕,王儒彬,孙磊,等.不同采摘期连翘叶中总黄酮、总酚酸含量与DPPH自由基清除能力的相关性[J].中国实验方剂学杂志,2011, 17(16):109-112
[3]JIAO J,GAI Q,LUO M,et al.Comparison of mainbioactive compounds in tea infusions with different seasonal Forsythiasuspensa leaves by liquid chromatography-tandem mass spectrometryand evaluationofantioxidantactivity[J].FoodResearchInternational,2013, 53(2):857-863
[4]Yuan J F,Liu X Q,Yang J X,et al.Forsythia Suspense Leaves,A Plant: Extraction,Purifcation and Antioxidant Activity of Main Active Compounds[J].European Food Research and Technology,2014,238(4): 527-533
[5]谢明勇,聂少平.天然产物活性多糖结构与功能研究进展[J].中国食品学报,2010,10(2):1-8
[6]吕建平.连翘叶片多糖的提取、分离纯化及抗氧化性研究[D].临汾:山西师范大学,2014:13-14
[7]张金生,杨宏娟,李丽华,等.超声波法提取益母草中多糖方法的研究[J].食品研究与开发,2012,33(11):103-106
[8]张永娟,吕学军,张大勇,等.缢蛏多肽对免疫抑制小鼠免疫功能的影响[J].食品研究与开发,2010,31(11):48-50
[9]甘露.玉屏风散多糖对小鼠免疫功能的影响[J].免疫学杂志,2013, 29(2):182-184
[10]王凌,孙利琴,周妍.小球藻多糖体外免疫调节活性研究[J].食品研究与开发,2013,34(7):30-32
[11]邱妍.四种中药多糖增强免疫和抗病毒作用及机理研究[D].南京:南京农业大学,2007:63-67
[12]陈美珍,余杰,杨拉维.龙须菜多糖硫酸化对免疫活性的影响[J].食品科学,2010,31(15):278-282
[13]李朝霞,张秋霞,赵晖,等.乳铁蛋白对环磷酰胺所致小鼠免疫失衡的保护作用[J].食品研究与开发,2013,34(13):114-116
DOI:10.3969/j.issn.1005-6521.2015.23.007
收稿日期:2015-10-22
基金项目:徐州市卫生科技资源现状调查与分析(xkqz030)
作者简介:张岫秀(1964—),女(汉),副主任护师,学士,主要从事儿科护理与临床研究。
*通信作者:高勇(1967—),主任技师。
Investigation on the Influence of Polysaccharide from Forsythia suspensa Leaves on Immunological Function of Mice
ZHANG Xiu-xiu1,CAI Ying1,WU Zhong-mei1,GAO Yong2,*
(1.Xuzhou Children's Hospital,Xuzhou 221006,Jiangsu,China;2.Xuzhou Institute of Medical Science,Xuzhou 221006,Jiangsu,China)
Abstract:To investigate the modulation of Forsythia suspensa polysaccharide(FLP)on immunosuppressive mice induced by cyclophosphamide(CTX),mice were injected with CTX to establish the immunosuppressive model.The effects of different doses of FLP on the index of thymus and spleen,peritoneal macrophage activity and the levels of blood serum hemolysin and hemolytic plaque in mice were detected.FLP was effective in improving the immune function of immunosuppressive mice,improved the index of thymus and spleen,increased the phagocytic activity of peritoneal macrophage,proliferation activity of splenic lymphocytes,the level of IL-2 and IL-4 and improved the formation of hemolysin and hemolytic plaque in immunosuppressive mice.FLP could enhance the immunological activity,has a higher application value in the development of immunomodulator and functional foods.
Key words:Forsythia suspensa leaves;polysaccharide;immunological function
