前列地尔对慢性心力衰竭患者心室重构时血清超敏C 反应蛋白和胱抑素C 表达的影响
2015-07-24周汉义
刘 静,李 宾,周汉义,黄 俊,葛 雄,郑 曦⋆
(1.咸宁市中心医院 检验科,湖北咸宁 437100;2.咸宁市中心医院 心内科,湖北咸宁 437100)
慢性心力衰竭(chronic heart failure,CHF)是由众多复杂因素介导的心肌细胞损伤, 从而导致机体外周血流分布异常以及心肌收缩与舒张功能障碍为主的临床综合征, 是各种心血管疾病的最终归结[1,2]。 研究表明,神经内分泌系统的过度激活及炎症介质的分泌构成了相互调节的网络,共同促进慢性心衰的发生发展, 以心室重构(ventricular remodeling,VR)及心肌纤维化为主要病理生理学表现[3]。 超敏C 反应蛋白(high sensitivity reactive protein,hs-CRP)是一种急性期反应蛋白,作为炎症反应标志物, 其水平变化与慢性心衰心室重构密切相关[4,5]。另外,相关研究表明胱抑素C(cystatin-C,CysC)高水平表达可加重左心室壁厚度从而降低心室顺应性, 从而促进心室重构的发生发展[6]。近年来,关于CHF 的治疗已取得突破性进展,但其效果及预后仍是医学界的棘手难题。前列地尔作为前列腺素E1(prostaglandin E1,PGE1)的外源性存在形式,具有多种生物学功能,并且对组织器官重构及纤维化有一定的防治作用[7]。 本研究通过观察前列地尔对慢性心衰患者血清hs-CRP 和CysC 表达的影响, 探讨其改善心室重构可能的机制。
1 资料与方法
1.1 实验试剂及仪器
前列地尔注射液(商品名凯时,北京泰德制药股份有限公司产);CysC 检测试剂盒(重庆中元生物技术有限公司);hs-CRP 检测试剂盒(日本电化生研株式会社);NT-proBNP 试剂盒(Abbott Laboratories,美国);全自动生化分析仪(日本Olympus AU2700);AIA-2000 化学发光仪 (日本东曹公司);彩色超声多普勒仪(日本Philips iu22)。
1.2 实验对象及分组
连续选择2012 年9 月~2013 年9 月于我院心血管内科住院并诊断为CHF 患者49 例 (诊断依据参照Framingham 标准)为心衰组,其中男27例、女22 例;年龄48~83 岁,平均61.35±6.12 岁。心力衰竭主要病因为:缺血性心肌病、非缺血性心肌病等。 心功能分级依据美国心脏病协会 (NYHA)公布标准执行: 其中NYHA 心功能Ⅱ级12例、Ⅲ级22 例、Ⅳ级15 例。按照实验方案,心衰组随机分为常规药物治疗组(常规治疗组)24 例,男13 例、女11 例;平均60.18±6.09 岁;常规药物加前列地尔治疗组(简称前列地尔组)25 例,其中男14 例、女11 例,平均62.49±5.92 岁。 同时选取健康体检者20 例(既往无冠心病、高血压等心脏疾病史以及家族史, 心电图和彩色超声心动图结果均正常)作为正常对照组,其中男11 例、女9 例;年龄50~78 岁,平均60.22±5.04 岁。 排除标准:心源性休克、急性心肌梗死、肥厚或限制性心肌病、房颤、心肌炎等;急或慢性心脑血管疾病;肺心病;严重肝、肾功能不全;结缔组织病;自身免疫性疾病等。 实验由医院伦理委员会准许, 所有参与对象均签署知情同意书。
1.3 实验方法及检测指标
所有受试对象均详细询问吸烟史等资料。 常规治疗组患者给予休息、低盐饮食、吸氧、强心剂、利尿剂、ACEI 等抗心衰药物治疗。 前列地尔组患者在常规药物治疗基础上加用前列地尔10μg 静脉滴注,1 次/d,连用14d。
正常对照组于体检时、 常规治疗组及前列地尔组于治疗前及治疗后14d 空腹≥8h 于次日清晨抽取肘正中静脉血3ml(促凝管1 支),送本院检验科做生化及免疫项目检测, 包括hs-CRP、血脂(TC、TG)、血糖(GLU)、肝功能、肾功能(CysC)以及NTpro-BNP 等指标。
CysC 采用乳胶金颗粒免疫比浊法检测;hs-CRP 采用免疫比浊法检测;NTpro-BNP 采用化学发光微粒子免疫法检测; 彩色超声心动图探测以下指标:左心室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、 左室舒张末期容积(left ventricular end diastolic volume,LVEDV)及收缩末期容积 (left ventricular end systolic volume,LVESV)、 左心室后壁厚度 (left ventricular posterior wall thickness,LVPWT)、室间隔厚度(interventricular septal thickness,IVST)、左室射血分数, 重复描记3 个心动周期并计算其均值。 依据Devereux 校正公式计算LVMI。
1.4 统计学方法
采用SPSS13.0 统计学软件分析处理数据,各组计量资料组间比较采用t检验。 计数资料比较采用卡方检验。
2 结果
2.1 常规组和前列地尔组基线资料比较
表1 示,2 个治疗组患者的基线资料: 性别、年龄、吸烟史、血糖、血脂等方面均无显著性差异(均P>0.05),具有可比性。
2.2 常规治疗组与前列地尔组治疗前后比较
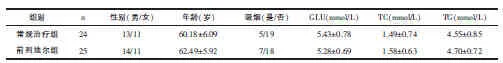
表1 常规治疗组与前列地尔组的一般资料比较

表2 常规组与前列地尔组治疗前后各指标比较
表2 示,2 个治疗组在治疗前与正常对照组比较,血清hs-CRP、CysC、NTpro-BNP 水平及LVMI 显著升高,LVEF 显著降低(均P<0.01)。 常规组治疗后与治疗前比较,血清hs-CRP、CysC、NTpro-BNP 水平及LVMI 均显著下降 (P<0.05,P<0.01),而LVEF 虽有升高趋势,但差异尚无统计学意义 (P>0.05); 前列地尔组治疗后血清hs-CRP、CysC、NTpro-BNP 表达及LVMI 显著降低,LVEF 显著升高(P<0.05,P<0.01)。 治疗后前列地尔组血清hs-CRP、CysC、NTpro-BNP 水平及LVMI 均显著低于常规组,LVEF 显著高于常规组
(P<0.05,P<0.01)。
3 讨论
国内外研究发现, 机体免疫系统过度激活导致的炎症反应是CHF 及其心室重构的一个重要的发病机制, 是机体炎症与抗炎症系统之间的平衡被打破的结果。 而炎症系统中相关介质之间相互作用导致的正反馈,进一步加重了心肌损伤。相关研究表明,hs-CRP 等炎症标志物与CHF 发病机制关系密切,主要通过下调NO 释放,上调内皮素-1(ET-1)产生,诱导血管黏附分子的过度表达直接损伤血管内皮细胞及激活血小板, 继而加重心肌细胞肥大、纤维化,甚至凋亡,从而引起心功能不全,因此可用来监测心衰的治疗效果[4]。 CysC是一种碱性蛋白质, 以往研究认为是肾功能不全的敏感性指标。 近年相关研究表明,CysC 与心血管系统疾病密切相关。 血清CysC 高水平表达,可降低半胱氨酸蛋白酶的活性,从而减少胶原水解,而使之生成相对增多, 最终导致细胞外基质的增多积聚,促成心肌纤维化,诱发心室重构[8,9],是慢性心衰心室重构另一个重要的发病机制。 本实验及前期的研究发现,CHF 患者血清hs-CRP 和CysC 呈显著高表达,并且这种高表达与NYHA 心功能分级有依赖性,即随着分级递增、LVEF 递减及心衰标志物NT-proBNP 水平递增,其表达水平明显升高,并与LVMI 存在相关性,这也提示了血清hs-CRP 和CysC 水平的高表达与心衰的发病机制、心衰的严重程度及心室重构密切相关。
近年来,关于CHF 的治疗最核心的进展是拮抗神经-体液的药物应用于临床, 针对心室重构的发生机制,阻止和减缓其发生发展,从而降低心衰的病死率和住院率[10]。 前列地尔是一种天然的PGE1 类代谢物质, 可激活血小板的腺苷酸环化酶(cAMP)。 激活的cAMP,一方面减少了血小板之间相互聚集及血栓素生成, 从而使血栓形成的机率降低;另一方面可通过抑制氧自由基产生,保护血管内皮功能,从而对心衰患者血流动力学、神经内分泌系统有显著的改善作用, 对心肌细胞的重构亦有明显改善[11]。 本研究通过选择CHF 患者49 例,随机分为常规药物治疗组24 例,常规药物加前列地尔治疗组25 例, 观察前列地尔对CHF患者hs-CRP 和CysC 表达及LVMI 值的变化。 结果表明,常规药物治疗患者血清hs-CRP 和CysC表达水平及LVMI 指标较治疗前降低,LVEF 有升高趋势,心功能较正常对照组改善。加用前列地尔药物治疗的患者血清hs-CRP 和CysC 表达水平及LVMI 指标明显减低,而LVEF 指标升高,心功能明显改善。以上研究表明,前列地尔可明显降低血清hs-CRP 和CysC 表达水平,提高患者LVEF,降低LVMI 值。提示,前列地尔可显著改善患者心功能,减轻心室重构,降低血清hs-CRP 和CysC表达水平, 进一步减轻上述因子对心肌组织的损伤。
综上所述, 抗心衰药物治疗的前提下如果加用前列地尔,可进一步上调心衰患者心肌顺应性,提高LVEF,改善心室重构。 提示前列地尔可能具有多环节、多途径、多靶点的治疗优势,但具体机制有待进一步研究。
[1] Shah AM,Mann DL.In search of new therapeutic targets and strategies for heart failure:recent advances in basic science[J].Lancet,2011,378(9792):704-712.
[2] 秦晓毅.2010 年NICE 慢性心力衰竭诊治指南更新的解读[J].心血管病学进展,2011,32(4):490-492.
[3] Tham YK,Bernardo BC,Ooi JY,et al.Pathophysiology of cardiac hypertrophy and heart failure:signaling pathways and novel therapeutic targets [J].Arch Toxicol,2015,89(9):1401-1438.
[4] Huynh K,Van Tassell B,Chow SL.Predicting therapeutic response in patients with heart failure:the story of C-reactive protein[J].Expert Rev Cardiovasc Ther,2015,13(2):153-161.
[5] Schulz R,Heusch G.C-reactive protein:just a biomarker of inflammation or a pathophysiological player in myocardial function and morphology[J].Hypertension,2011,57(2):151-153.
[6] Patel PC,Ayers CR,Murphy SA,et al.Association of cystatin C with left ventricular structure and function:the Dallas Heart Study[J].Circ Heart Fail,2009,2(2):98-104.
[7] 张风林,安玉瑛,角灿武.前列腺素E1 的药理作用和临床应用研究概述[J].中国药师,2011,14(4):559-561.
[8] Arimoto T,Takeishi Y,Niizeki T,et al.Cystatin C,a novel messure of renal function,is an independent predictor of cardiac events in patients with heart failure [J].J Cardiac Fail,2005,11(8):595-601.
[9] Djoussé L,Kurth T,Gaziano JM.Cystatin C and risk of heart failure in the Physicians’Health Study(PHS)[J].AM Heart J,2008,155(1):82-86.
[10] 马虹,汪海宁.慢性心力衰竭治疗进展[J].岭南心血管病杂志,2012,18(2):101-111.
[11] 白丽娜,周旻,李月红.前列地尔脂微球载体制剂的药理作用机制的研究进展[J].中日友好医院学报,2008,22(1):47-50.
