牛肠道病毒2型单克隆抗体的制备及其应用研究
2015-07-21郭金玉张鹤晓高志强张乐萃
郭金玉,张鹤晓,吴 丹,高志强,张 冉,张乐萃*
(1.青岛农业大学动物科技学院,青岛 266109;2.北京出入境检验检疫局,北京 100026;3.北京森康生物技术开发有限公司,北京 101400)
牛肠道病毒2型(bovine enterovirus type 2, BEV-2)是小RNA病毒科、肠道病毒属成员[1],通常引起轻度腹泻或隐性感染,在一定条件下可引发显著症状,影响奶牛的生产性能。BEV-2基因组为单股正链RNA,长为7430bp,仅有一个开放阅读框(ORF),即RNA 5′末端只含有一个翻译起始点,编码2166个氨基酸,经降解产生4种结构蛋白(VP1~VP4)和7种非结构蛋白(2A、2B、2C、3A、3B、3C和3D)[2]。其中 VP1蛋白能诱导机体产生特异性的中和抗体。
单克隆抗体(McAb)是由一个淋巴细胞分泌的、针对同一抗原决定簇的抗体,它以高度特异性和敏感性在蛋白质的结构与功能研究中发挥着重要作用[3]。
作者利用表达的牛肠道病毒2型VP1+蛋白(包含整个VP1蛋白基因片段)为免疫原接种小鼠,通过筛选,制备了抗BEV-2的单克隆抗体,建立了BEV-2双抗体夹心ELISA检测方法,为ELISA试剂盒的开发奠定基础。
1 材料与方法
1.1 材料
BALB/c小鼠购于北京维通利华实验动物技术有限公司;新泽西型水泡性口炎病毒(VSV-NJ)由美国NVSL提供;牛肠道病毒2型(BEV-2病毒,毒株BJ001)、牛病毒性腹泻病毒(BVDV)和牛白血病病毒(BLV)、SP2/0骨髓瘤细胞均由北京检验检疫局检验检疫技术中心提供;PEG4000购自北京天来生物医学科技有限公司;HAT、HT培养基添加剂、Mouse Monoclonal Antibody Isotyping Reagents亚型试剂盒购自SIGMA公司;牛肠道病毒2型阳性血清是用病毒免疫阴性牛制备(中和效价为1∶128);新泽西型水泡性口炎病毒截短的G蛋白(VSV-NJ-G)、羊抗牛IgG-HRP、弗氏不完全佐剂(FIA)、弗氏完全佐剂(FCA)均由动物疫病诊断联合实验室制备。
1.2 免疫原的制备
将原核表达的重组蛋白质BEV-2VP1+纯化复性后分装,于-80℃保存,备用。
1.3 小鼠免疫程序及血清抗体效价的测定
选取6~8周龄健康雌性BALB/c小鼠4只,剪耳做标记。制定小鼠免疫程序,首免用抗原加FCA(1∶1)充分乳化,颈背部皮下注射,抗原含量50 μg;14d后进行二免,用抗原加FIA(1∶1)充分乳化,颈背部皮下注射,抗原含量50μg;间隔2周进行三免(同二免)。2周后,断尾采血并分离血清,用间接ELISA检测小鼠血清效价,血清效价在1/104以上即可融合,融合前3d小鼠腹腔注射加强免疫。
1.4 细胞融合及培养
取免疫小鼠的脾细胞与SP2/0细胞按5∶1的比例用PEG4000进行融合,用HAT选择性培养基轻轻悬浮后混匀,铺于准备好的饲养细胞上[4]。置于37℃、5%CO2条件下培养。
1.5 阳性杂交瘤细胞的筛选及亚克隆
用重组蛋白质BEV-2VP1+包被酶标板后,再用已经建立好的检测BEV-2抗体的间接ELISA方法[5]筛选阳性杂交瘤细胞,待融合细胞覆盖1/3孔底时,检测细胞培养上清,筛选出的阳性孔再用BEV-2进行2次筛选,最终选出分泌BEV-2抗体的阳性细胞孔。
将筛选为阳性的杂交瘤细胞原始孔采用有限稀释法进行亚克隆。克隆3~5轮,直至细胞100%检测阳性,将其扩大培养并冻存。
1.6 腹水的制备
选取4只12周龄的小鼠,预先腹腔注射灭菌石蜡油500μL·只-1,7d后,注射密度约2×106mL-1的阳性杂交瘤细胞。待小鼠腹部膨胀,收集腹水,8000r·min-1离心5min,置于-20℃保存。
1.7 单抗的间接ELISA效价
将收集的杂交瘤细胞上清和小鼠腹水以1/10的比例进行倍比稀释,并设立阴性对照,结果以阳性/阴性OD450nm(P/N)>2.0时的最高稀释度确定为单克隆抗体的效价。
1.8 杂交瘤细胞分泌抗体的稳定性和亲和力测定
将杂交瘤细胞反复冻存复苏3次,并连续传代培养至第6代,检测冻存前、复苏后及传至第6代的杂交瘤细胞分泌McAb的稳定性。
利用亚型试剂盒测定两株单抗的亚型,参考亲和力测定文献[6],测定其亲和力。
1.9 病毒与腹水反应
将粗纯的BEV-2病毒在56℃灭活30min。用pH 9.6碳酸盐缓冲液将病毒(BEV-2)1∶100倍稀释,同时设BVDV(1∶100倍稀释)做阴性对照,包被至反应板,经封闭、洗涤后,加入1∶(103~107)稀释的腹水,用羊抗鼠IgG-HRP检测反应结果。
1.10 单抗特异性
将灭活后的病毒(BEV-2、VSV、BVDV 和BLV)用碳酸盐缓冲液1∶100倍稀释,分别包被酶标板,收集腹水进行ELISA测定。
1.11 免疫印迹分析
取纯化的重组蛋白质VSV-NJ-G、BEV-2 VP1+进行SDS-PAGE电泳分离,转印至PVDF,封闭后加入一抗(腹水1∶100倍稀释)4℃孵育过夜,洗涤后加羊抗鼠IgG-HRP(1∶8000倍稀释),最后洗涤3次,避光显色1min,与底片一起置于暗盒中,曝光1~5min。
1.12 双抗体夹心ELISA方法的建立
1.12.1 单抗和酶标抗体稀释度的确定 将制备的单克隆抗体做1∶1000、1∶2000、1∶4000、1∶8000稀释后加入酶标板,放置37℃孵育1h,4℃包被过夜;封闭后加入1∶100稀释病毒抗原37℃孵育1h;再加入1∶100稀释的BEV-2阳性血清;将羊抗牛IgG-HRP做1∶500、1∶1000、1∶2000稀释。测定OD450nm值,选择阳性值接近1.0时对应的单抗和酶标抗体稀释度。
1.12.2 封闭液的确定 单抗最佳包被条件确定后,分别用1%明胶的PBST、1%卵清蛋白的PBST进行封闭,比较封闭效果。
1.12.3 酶标抗体和底物显色时间的优化 将羊抗牛IgG-HRP按最佳稀释度稀释,分别作用0.5、1、2h;加入底物后分别在黑暗中显色10、15、30 min,测其OD450nm。
1.12.4 临界值的确定 用优化的双抗体夹心ELISA方法检测40份病毒分离均为阴性的正常牛肠道拭子,采集的肠道拭子样品加入到1mL PBS缓冲液中,充分混匀,离心,取上清。计算临界值。
1.12.5 双抗体夹心ELISA特异性试验 用优化的双抗体夹心ELISA方法,检测BVDV、IBRV、BLV、BEV-2,验证双抗体夹心ELISA方法的特异性。
1.12.6 双抗体夹心ELISA敏感性试验 采集30份牛肠道拭子,用细胞培养法分离病毒并与双抗体夹心ELISA方法比较。
用BEV-2毒株感染MDBK细胞,进行3次病毒细胞半数感染量(TCID50)测定,以平均值作为该病毒的含量[7],按病毒含量将病毒稀释为0.01、0.1、1、10、100、1000TCID50·0.1mL-1,用双抗体夹心ELISA确定BEV-2的最小检测量,与荧光定量RT-PCR检测结果比较。
1.12.7 双抗体夹心ELISA重复性试验 根据测定的病毒TCID50,将BEV-2细胞培养物做十倍比稀释:10-1、10-2、10-3、10-4,并用正常细胞培养液做阴性对照。在同一酶标板重复三次,计算板内变异系数(CV);在三个批次的酶标板(板1、板2、板3)重复,计算板间变异系数(CV)。
1.12.8 临床样品的检测 采集牛肠道拭子、口腔拭子及粪便分泌物共236份临床样品,用双抗体夹心ELISA方法检测。从中选取25份阳性、20份阴性样品用病毒分离鉴定方法复检,并与双抗体夹心ELISA方法的结果比较。
2 结 果
2.1 小鼠血清抗体效价的测定
结果显示(表1),BALB/c小鼠的血清抗体效价均在1/104以上,4#号免疫效果最好,用于细胞融合。
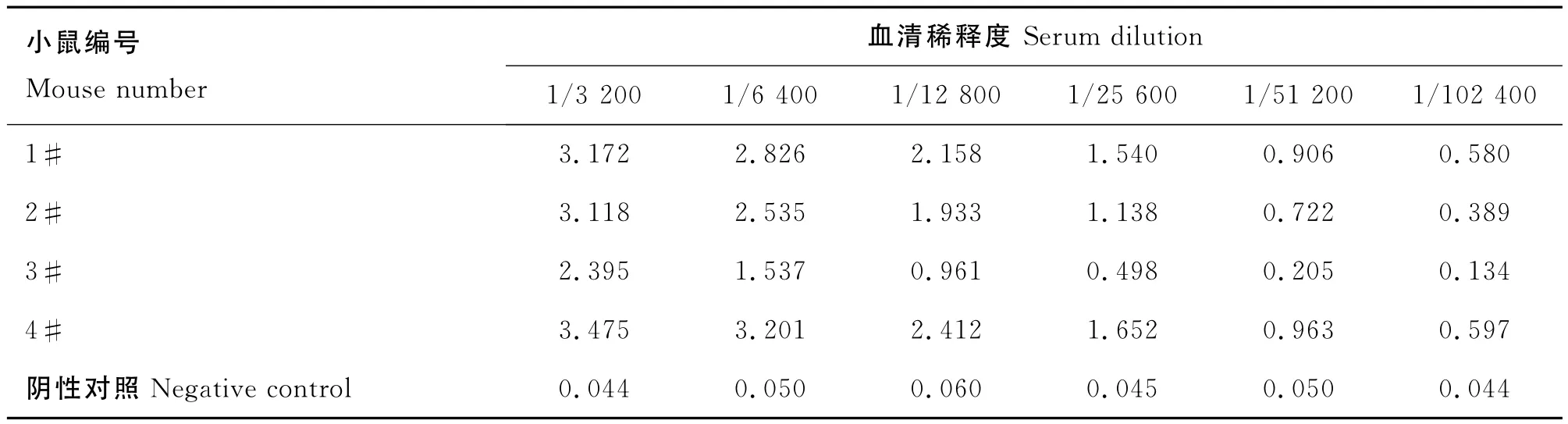
表1 小鼠血清抗体效价检测Table 1 The antibodies level of serums of mices
2.2 阳性杂交瘤细胞株的筛选与建立
通过对杂交瘤细胞培养上清检测,最终获得2株分泌抗BEV-2VP1+蛋白 McAb的杂交瘤细胞株:1G1、5G6。经3次有限稀释法亚克隆后,杂交瘤细胞阳性率达100%。
2.3 单抗的间接ELISA效价
经检测,1G1、5G6两株杂交瘤细胞上清产生的抗体效价为1/104、1/106。2株单抗的小鼠腹水效价比杂交瘤细胞上清效价高,1G1株单抗的效价为1/105,5G6株单抗的效价可达1/107(表2)。
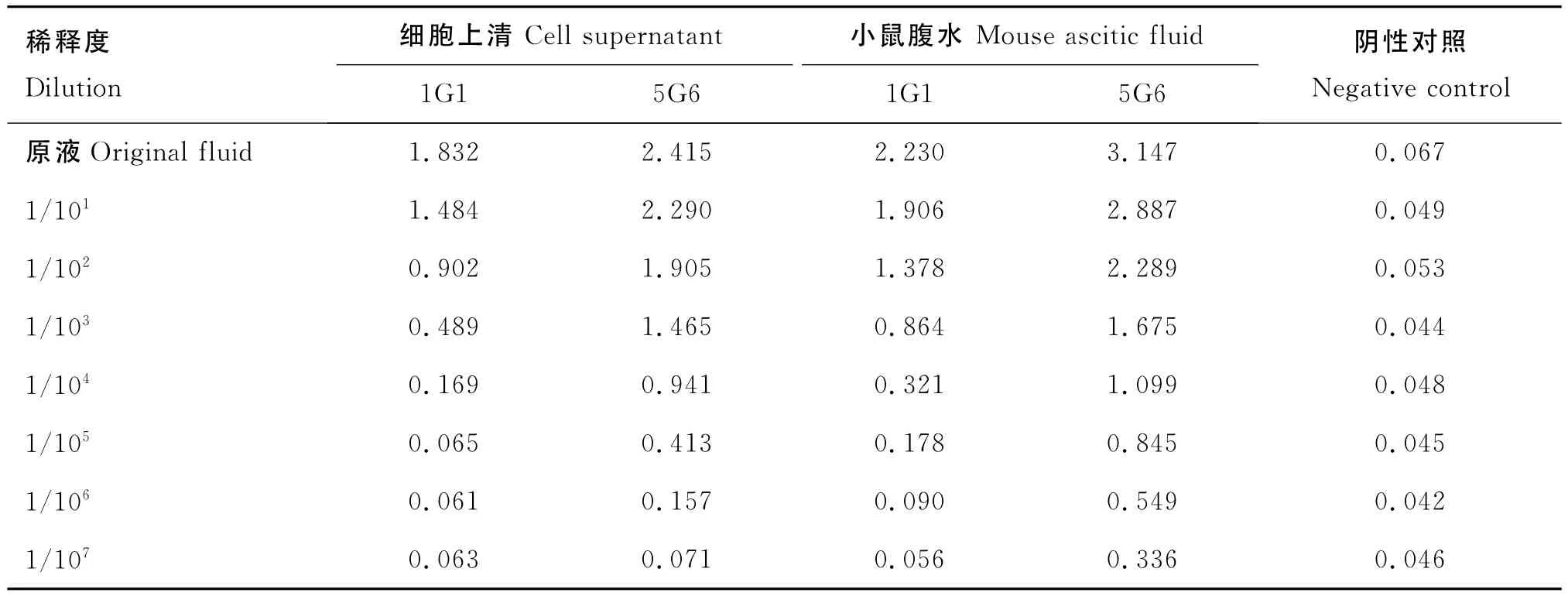
表2 间接ELISA中2株单抗细胞上清及腹水效价Table 2 Supernatant and ascitic fluid titers of two McAbs in indirect ELISA
2.4 杂交瘤细胞分泌McAb的稳定性和亲和力测定
两株杂交瘤细胞上清在冻存前、复苏后、传代后的OD450nm无明显变化,能稳定地分泌抗BEV-2的McAb(图1)。
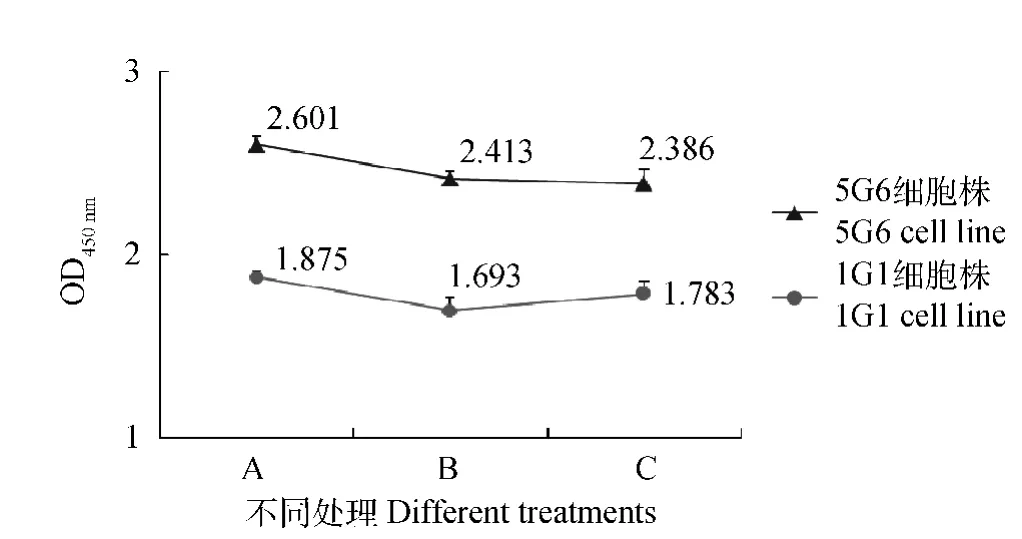
图1 杂交瘤细胞分泌抗体稳定性测定Fig.1 The ability to secretory antibody of the hybridoma cell
利用亚型试剂盒测定1G1、5G6的亚型分别为IgG1及IgG2b,根据亲和力测定文献测定其亲和力分别为6.5×109、2.0×1010,两者都属于高亲和力抗体。选择5G6做进一步试验。
2.5 病毒与腹水5G6反应
检测结果(表3)显示,BEV-2与腹水5G6反应良好,效价可达1/105。
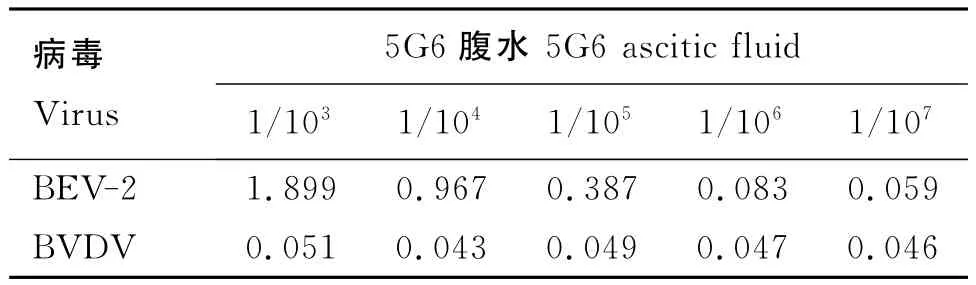
表3 病毒与腹水反应结果Table 3 Results of virus and ascitic fluid titers
2.6 单抗5G6的特异性
特异性试验结果显示(结果未展示),5G6细胞株小鼠腹水仅与BEV-2反应呈阳性,与其他病毒反应为阴性,具有良好的特异性。
2.7 单抗5G6的免疫印迹分析
Western blot鉴定结果表明,5G6株单克隆抗体能与大肠杆菌表达的BEV-2VP1+重组蛋白质发生特异性反应(图2)。
2.8 单抗5G6双抗体夹心ELISA方法建立
2.8.1 包被单抗浓度和酶标抗体浓度的确定经测定,确定单抗5G6最佳稀释度为1∶4000,羊抗牛IgG-HRP稀释度为1∶1000(表4)。
2.8.2 封闭液的确定 试验结果证明,用1%卵清蛋白的PBST封闭时P/N最大,所以最终选择1%卵清蛋白的PBST作为封闭液。

图2 单克隆抗体的免疫印迹分析Fig.2 Analysis of monoclonal antibodies by Western blotting
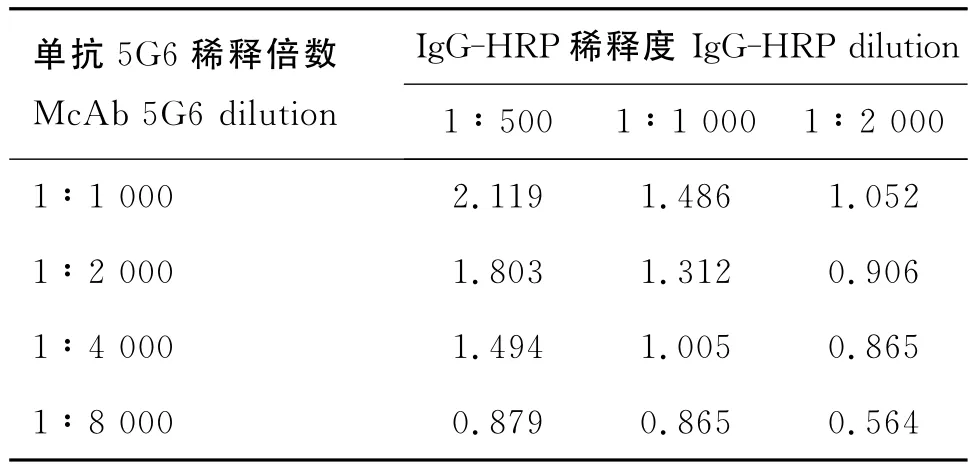
表4 5G6包被浓度和酶标抗体稀释度的确定Table 4 Confirmation of 5G6coating concentration and IgGHRP using concentration
2.8.3 酶标抗体和底物显色时间的优化 酶标抗体和底物反应时间的选择试验结果显示,羊抗牛IgG-HRP反应时间为0.5h时;底物作用时间为15min。
2.8.4 临界值的确定 通过计算,得出40份牛肠道拭子的平均值为0.1496,标准差为0.0541。因此,确定该方法的临界值为0.31。
2.8.5 双抗体夹心ELISA特异性试验 用双抗体夹心ELISA方法检测BVDV、IBRV、BLV均无交叉反应,显示了双抗体夹心ELISA方法特异性较好。
2.8.6 双抗体夹心ELISA敏感性试验 通过表5结果计算,双抗体夹心ELISA方法与病毒分离鉴定方法的阳性符合率为90%,阴性符合率为100%,总符合率为93.3%。
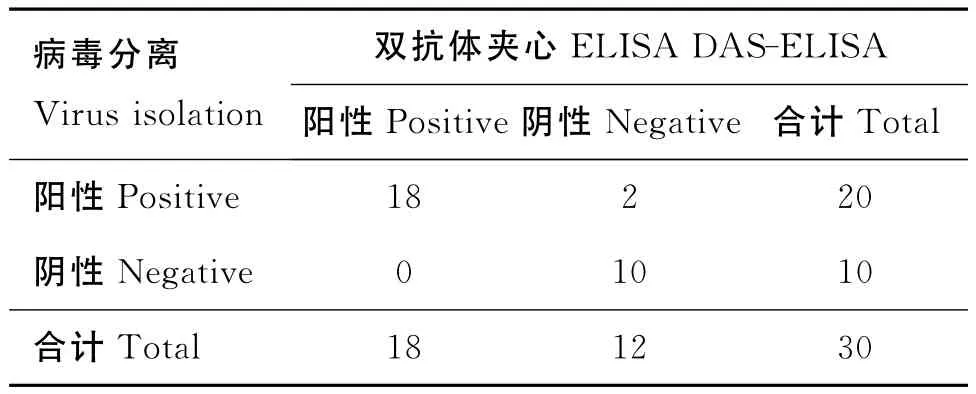
表5 病毒分离与双抗体夹心ELISA比较试验结果Table 5 Results of viral isolation compared with DAS-ELISA
经3次BEV-2病毒含量测定,确定其平均值为10-6.48TCID50·0.1mL-1。双抗体夹心ELISA检测结果表明:当BEV-2含量低于10TCID50·0.1mL-1的时,检测结果阴性;当含量≥100TCID50·0.1 mL-1时为阳性。该方法对BEV-2的检测极限为100TCID50·0.1mL-1。而荧光定量RT-PCR检测方法的检测极限为0.1TCID50·0.1mL-1,比双抗体夹心ELISA的敏感性高(表6)。

表6 敏感性试验结果(x-±s)Table 6 Results of the sensitivity tests(x-±s)
2.8.7 双抗体夹心ELISA重复性试验 重复性试验结果显示,检测的BEV-2细胞培养物变异系数(CV)均小于3%,表明该方法在板内、板间有良好的重复性。
2.8.8 临床样品的检测 双抗体夹心ELISA方法检测236份临床样品,结果58份为BEV-2阳性,阳性率为24.6%。从中选取的45份样品(25份阳性、20份阴性)进行细胞培养分离病毒(表7),两者结果的总符合率为91.1%。
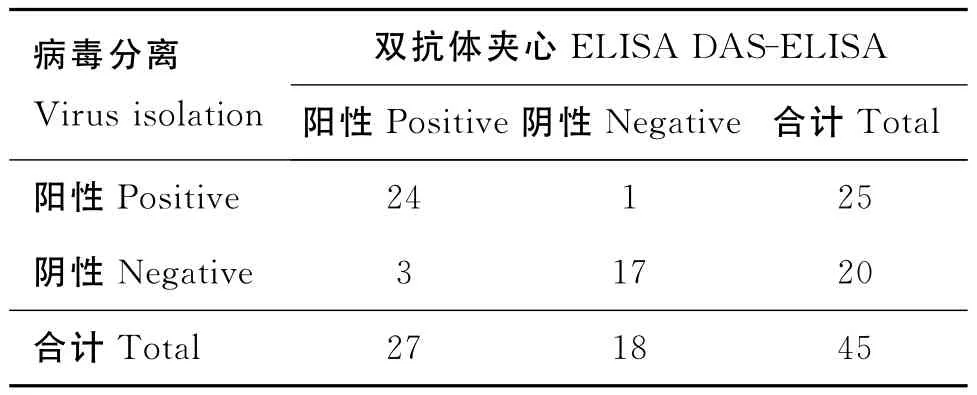
表7 病毒分离与双抗体夹心ELISA符合率试验结果Table 7 Results of the coincidence test between virus isolation and the DAS-ELISA
3 讨 论
本研究以纯化的重组蛋白质BEV-2VP1+作为抗原,对BALB/c小鼠进行常规免疫,通过2次细胞融合,接种768孔,用间接ELISA方法筛选后进行了3次亚克隆,最终获得2株能够稳定分泌抗BEV-2McAb的杂交瘤细胞株。经检测,5G6株单克隆抗体具有良好的特异性。在国内,本试验首次制备了BEV-2的单克隆抗体。用制备的5G6株单克隆抗体包被酶标板,通过一系列的优化,建立了BEV-2双抗体夹心ELISA检测方法。
制备单克隆抗体的关键环节是细胞融合。骨髓瘤细胞形态不饱满、折光性较差,容易导致融合失败,细胞死亡。因此,细胞生长状态对融合起决定性作用,一定要保证骨髓瘤细胞的活力。除此之外,脾细胞的生长状态、融合比例及方法、试验过程中的操作都会影响细胞融合及杂交瘤细胞生长状况。
在国外牛群中,BEV阳性率高达17.6%~80%。BEV通过粪便或经口传播,传染源主要为病牛和无症状的病毒携带者[8]。吴丹等也曾报道过北京部分地区牛群存在牛肠道病毒感染,她建立的TaqMan荧光定量RT-PCR检测方法的敏感性为0.1TCID50·0.1mL-1。2014年侯佩莉等[9]报道山东也存在牛肠道病毒感染,并建立了RT-PCR检测方法,其检出敏感度也是10-1TCID50·0.1 mL-1。本试验建立的双抗体夹心ELISA方法敏感性没有荧光 RT-PCR 高,为100TCID50·0.1 mL-1,但是该方法与BVDV、IBRV、BLV均无交叉反应,具有良好的特异性,而且双抗体夹心ELISA方法检测的是抗原,无需病毒RNA提取、反转录、扩增及电泳检测等过程,使用常规仪器即可操作。与其他检测方法相比操作简便、成本低。
双抗体夹心ELISA方法和病毒分离的符合率试验显示两种方法符合率很高,总符合率达91.1%。病毒分离作为一种传统的金标检测方法,建立病原检测方法时都与其进行比较。本研究建立的双抗体夹心ELISA方法虽然存在一定的假阴性、假阳性,但较病毒分离相比,更适用于大批量样品的初筛。这种方便快捷的检测方法是生产实际中迫切需要的,适用于临床检测。
4 结 论
本研究在国内首次制备了2株抗BEV-2的单克隆抗体,首次建立了检测BEV-2抗原的ELISA方法。该方法特异性强、敏感性高、重复性好,适用于大批量样品的初筛,为我国出入境BEV的检验检疫和国内外牛肠道病毒ELISA试剂盒的开发奠定了良好的基础。
(References):
[1]SMYTH M S,MARTIN J H.Structural,biochemical and electrostatic basis of serotype specificity in bovine enteroviruses[J].Arch Virol,2001,146(2):347-355.
[2]MCCARTHY F M,SMITH G A,MATTICK J S.Molecular characterisation of Australian bovine enteroviruses[J].Vet Microbiol,1999,68(1-2):71-81.
[3]侯 强,彭伍平,孙 元,等.猪瘟病毒E2蛋白主要抗原区编码基因的原核表达及其单克隆抗体的制备[J].中国兽医科学,2008,38(1):1-5.HOU Q,PENG W P,SUN Y,et al.Expression of the truncated E2protein-encoding gene of classical swine fever virus in Escherichia coli and preparation of a monoclonal antibody against E2protein[J].Chinese Veterinary Science,2008,38(1):1-5.(in Chinese)
[4]KÖHLER G,MILSTEIN C.Continuous cultures of fused cells secreting antibody of predefined specificity[J].Nature,1975,256(5517):495-497.
[5]郭金玉,高志强,张鹤晓,等.牛肠道病毒2型VP1+表达和间接ELISA方法的建立与应用[J].中国兽医杂志,2014,50(11):40-43.GUO J Y,GAO Z Q,ZHANG H X,et al.Development and application of indirect ELISA for the detection of antibodies against bovine enterovirus type 2 based on VP1+protein expression[J].Chinese Journal of Veterinary Medicine,2014,50(11):40-43.(in Chinese)
[6]张小兵,吴 萌,闫静辉.ELISA法快速测定 McAb培养上清中鼠源IgG质量浓度[J].河北省科学院学报,2008,25(2):49-52,76.ZHANG X B,WU M,YAN J H.Rapid measurement of the mouse IgG concentration by a sandwich ELISA[J].Journal of the Hebei Academy of Sciences,2008,25(2):49-52,76.(in Chinese)
[7]吴 丹,吴 涛,张鹤晓,等.牛肠道病毒TaqMan荧光定量RT-PCR检测方法的建立[J].中国预防兽医学报,2012,34(11):903-906.WU D,WU T,ZHANG H X,et al.Establishment of real-time RT-PCR method for detection of bovine enterovirus[J].Chinese Journal of Preventive Veteri-nary Medicine,2014,34(11):903-906.(in Chinese)
[8]BLAS-MACHADO U,SALIKI J T,SÁNCHEZ S,et al.Pathogenesis of a bovine enterovirus-1isolate in experimentally infected calves[J].Vet Pathol,2011,48(6):1075-1084.
[9]侯佩莉,程洪兵,刘 晓,等.牛肠道病毒RT-PCR检测方法的建立及初步应用[J].山东农业科学,2014,46(2):13-16.HOU P L,CHENG H B,LIU X,et al.Establishment and application of RT-PCR for detection of bovine enterovirus[J].Shandong Agricultural Sciences,2014,46(2):13-16.(in Chinese)
