大比表面积TiO2纳米球的合成及其可见光降解Cr(VI)和双酚A的协同作用机理
2015-07-19阮仲英王宇佳程伶俐
阮仲英,王宇佳,王 彬,程伶俐,丁 楠,焦 正
(上海大学环境与化学工程学院,上海 200444)
大比表面积TiO2纳米球的合成及其可见光降解Cr(VI)和双酚A的协同作用机理
阮仲英,王宇佳,王 彬,程伶俐,丁 楠,焦 正
(上海大学环境与化学工程学院,上海 200444)
以钛酸四正丁酯作为钛源,十八烷基胺为模板剂,采用溶胶凝胶法结合水热反应法合成了TiO2纳米球,并考察了煅烧温度对TiO2纳米球形貌的影响.结果表明,当煅烧温度为350◦C时,所制备的TiO2纳米球具有最佳形貌,且其比表面积可达159.878 m2/g,约为目前商用TiO2P25(54.041 m2/g)的3倍.另外,通过Cr(VI)和双酚A(bisphenol A,BPA)的可见光降解实验,对所制备的TiO2纳米球的光催化性能进行了测试.结果表明,TiO2纳米球在可见光条件下可有效降解水体中的Cr(VI)和BPA;此两种污染物的降解呈现协同效应,且TiO2纳米球的比表面积决定了其光催化性能,在350◦C煅烧条件下制备的TiO2纳米球具有最优的光催化性能.
TiO2;双酚A;可见光催化
TiO2是当前应用前景极为广阔的一种特种材料,具有湿敏、气敏、光催化和优良的介电性等多种特性,因此在功能陶瓷、光催化反应、太阳能电池和吸附材料等方面具有广阔的应用前景[1-7].20多年来,物理、化学工作者围绕多相光催化机理及提高TiO2的光催化效率进行了大量的研究工作,其中大部分涉及新能源的开发和储能[3,5,8],以及多相光催化技术在环境保护[8-11]、气相和水中的有机污染物净化等方面的应用.但是半导体TiO2还存在能隙较宽(3.0~3.2 eV)、光响应范围较窄、光催化效率不高等不足.影响TiO2光催化性能的因素很多,例如TiO2粒子的晶型、粒径、表面态等[12-14].为了改善TiO2的光催化性能,有关TiO2微粒的制备方法[15-18]、掺杂金属离子[19-21]、掺杂有机染料[22-23]、催化剂载体、担载贵金属[24-25],以及不同气氛处理等一直是TiO2光催化剂的研究热点.
已有研究发现,某些无色有机物可与TiO2形成具有可见光响应的电荷转移络合物(charge-transfer-complex,CTC),拓宽TiO2的光响应范围[26-27],其原理在于CTC被可见光激发后会产生电子从无色有机配体向TiO2导带转移(类似于染料敏化途径),从而使无色有机污染物在可见光下催化降解.Kim等[27]研究发现,CTC可以诱导纳米TiO2在可见光下降解苯酚,且其降解性能与催化剂的比表面积有关.Wang等[14,28-29]在可见光条件下,利用纳米TiO2同时降解有机酸和Cr(VI).结果表明,Cr(VI)和有机污染物在降解过程中存在明显的协同效应.
本研究以钛酸四正丁酯为钛源,十八烷基胺作为模板剂,采用溶胶凝胶法结合水热反应法合成了TiO2纳米球,并考察了煅烧温度对TiO2纳米球形貌的影响.另外,通过Cr(VI)和双酚A(bisphenol A,BPA)的可见光降解实验,对TiO2纳米球的光催化性能进行了测试,并与商用纳米TiO2P25进行了对比分析.
1 实验部分
1.1 仪器与试剂
透射电子显微镜(transmission electron microscope,TEM,JSM-2010F)、扫描电子显微镜(scanning electron microscope,SEM,JSM-6700F)、X射线衍射(X-ray di ff raction,XRD, Rigaku D/max-2550),购自日本JEOL公司;拉曼(Raman)光谱(Invia),购自英国Renishaw公司;比表面积测试仪(Brunauer-Emmett-Teller,BET,Quadrasorb-SI),购自美国康塔公司.
钛酸四正丁酯(化学纯)、无水乙醇(EtOH,分析纯)、BPA(分析纯)、重铬酸钾(分析纯),购自国药集团化学试剂有限公司;十八烷基胺(R-NH2,分析纯),购自美国Sigma公司;甲醇(HPLC级),购自上海安普公司.
1.2 TiO2的制备
将0.8 g R-NH2加入到100 mL EtOH中,然后加入0.8 mL去离子水,在室温条件下搅拌30 min得到溶液A.将1.25 mL钛酸四正丁酯加入到3 mL EtOH中,超声分散1 min得到溶液B.将溶液B加入溶液A中,搅拌30 min得到白色悬浮液.将此溶液转移至100 mL水热反应釜中,放入烘箱,于170◦C下水热反应20 h.反应完毕后,将反应釜取出,自然冷却至室温.反应后产物通过离心分离,并利用EtOH和去离子水反复洗涤4~5次,于60◦C下干燥8 h,然后在350◦C条件下煅烧3 h,即得到TiO2纳米球.制备流程如图1所示.
1.3 光催化性能测定
将0.05 g TiO2纳米球加入到50 mL BPA(0.1 mmol/L)和Cr(VI)(0.1 mmol/L)的混合溶液中,用稀硫酸调节pH至3.0,然后超声分散,所得悬浮液避光搅拌15 min,使TiO2纳米球达到吸附平衡.取出4 mL悬浮液置于离心管中,将剩余悬浮液置于SGY-IB型光催化反应仪中,向溶液中不断通入空气使催化剂分散于整个催化体系中.利用350 W氙灯作为光源,并采用滤光片滤去波长小于400 nm的光.在光催化反应过程中,每隔10 min取出4 mL悬浮液置于5 mL离心管中,总反应时间为90 min.反应结束后将各个时间段的降解液经0.22µm滤膜过滤,取清液分析各个降解时间段内Cr(VI)及BPA的浓度,以此来计算样品对Cr(VI)和BPA的降解效果,其中Cr(VI)的浓度采用GB/T 19940—2005中的二苯碳酰二肼分光光度法进行测定,BPA的浓度采用反相高效液相色谱法进行测定.高效液相色谱法的测定条件如下:紫外检测器(UV-2075,JASCO)的检测波长为224 nm,C18 ODS色谱柱(4.6×150 nm,Waters Xterra)的流动相为甲醇和水(体积比为75∶25),流速为0.7 mL/min,进样量为10µL,柱温为30◦C.在对比实验中,将催化剂替换为0.05 g商用TiO2P25,其他实验步骤不变.
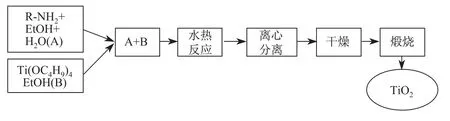
图1 TiO2纳米球的合成示意图Fig.1 Schematic illustration for the synthesis of TiO2nanospheres
2 结果与讨论
2.1 XRD分析
煅烧温度是影响TiO2纳米球产品性能的一个关键因素.煅烧过程不仅可以去除模板剂,同时还能使无定形TiO2得到晶化.不同煅烧温度下制备的TiO2纳米球的XRD结果如图2所示.可以看出,当煅烧温度从350◦C升高至600◦C时,样品的衍射峰与标准锐钛矿TiO2(JCPDS NO:21-1272)的完全一致.衍射峰强度随着煅烧温度的升高(350~600◦C)而增强,这主要是由于煅烧温度升高导致样品的结晶度增强所致.随着煅烧温度的升高,衍射峰越来越增强,衍射峰宽变窄,说明样品结晶度变高.但当煅烧温度为700◦C时,样品的衍射峰值变为金红石相,说明煅烧温度的提高使TiO2纳米球的晶相由锐钛矿型向金红石型转变.
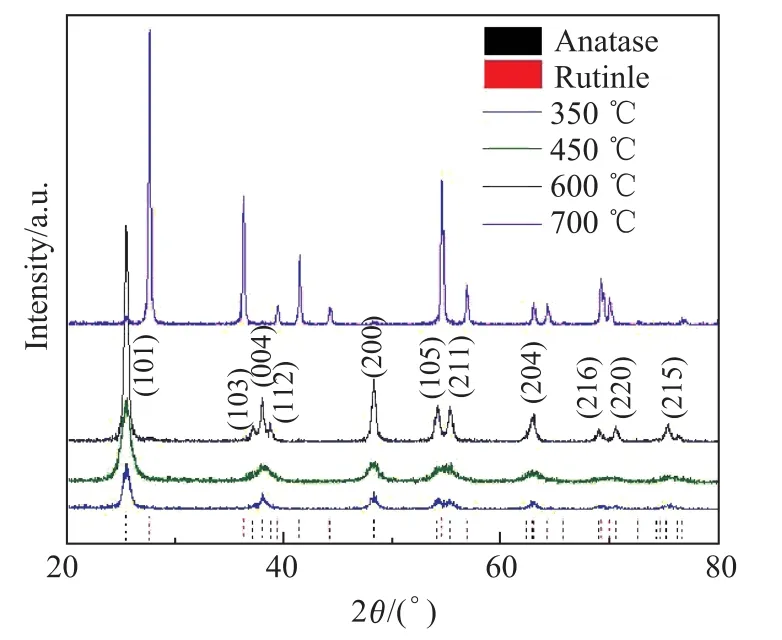
图2 不同煅烧温度下制备的TiO2纳米球的XRD图Fig.2 XRD patterns of TiO2nanospheres prepared by di ff erent calcinations temperatures
2.2 电镜表征
图3是不同煅烧温度下制备的TiO2纳米球的TEM图.可以看出,当煅烧温度为350和450◦C时,样品直径约为400 nm,呈球状结构,颗粒分散均匀,其表面为粗糙的毛刺状.这主要是由沉积在表面上的TiO2纳米颗粒引起的(见图3(a)和(b)).当煅烧温度升高至600和700◦C时,样品的球状结构被破坏,其表面上沉积的TiO2纳米颗粒也随之消失(见图3(c)和(d)).这说明煅烧温度对于样品形貌结构具有较大影响.

图3 不同煅烧温度下制备的TiO2纳米球的TEM图Fig.3 TEM images of TiO2nanospheres prepared by di ff erent calcinations temperatures
2.3 比表面积分析
为了进一步表征TiO2纳米球的物理特性,本研究进行了N2吸附-脱附等温线的表征.图4(a)为350◦C煅烧后样品的N2吸附-脱附等温曲线.可以看出,当P/P0值在0.1~1.0之间时,吸附曲线和脱附曲线之间形成了一个滞后环,属于IV型TiO2吸附-脱附等温线.350◦C煅烧后样品的比表面积为159.878 m2/g,为商业TiO2P25(54.041 m2/g)的3倍.图4(b)为350◦C煅烧后样品的孔径分布曲线,可见在2.5 nm处出现了孔径分布的峰值.更多的结构特征如比表面积、孔径和孔容积等的实验结果如表1所示,其中比表面积、孔容积和孔径均由氮气吸附法测得,比表面积测定时的吸附数据在压力比值(P/P0)为0.05~0.30的条件下进行实验,后二者在压力比值(P/P0)为0.945的条件下测得,晶格间距根据X射线衍射数据通过Scherrer公式计算得到.
2.4 光催化性能测试
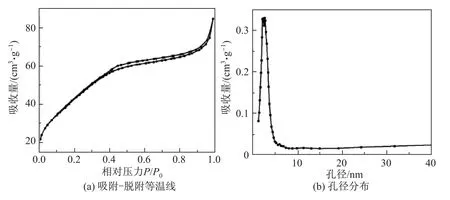
图4 TiO2纳米球的N2吸附-脱附等温线及相应的孔经分布Fig.4 N2asdorption-desorption isotherm of TiO2nanospheres and corresponding pore size distribution
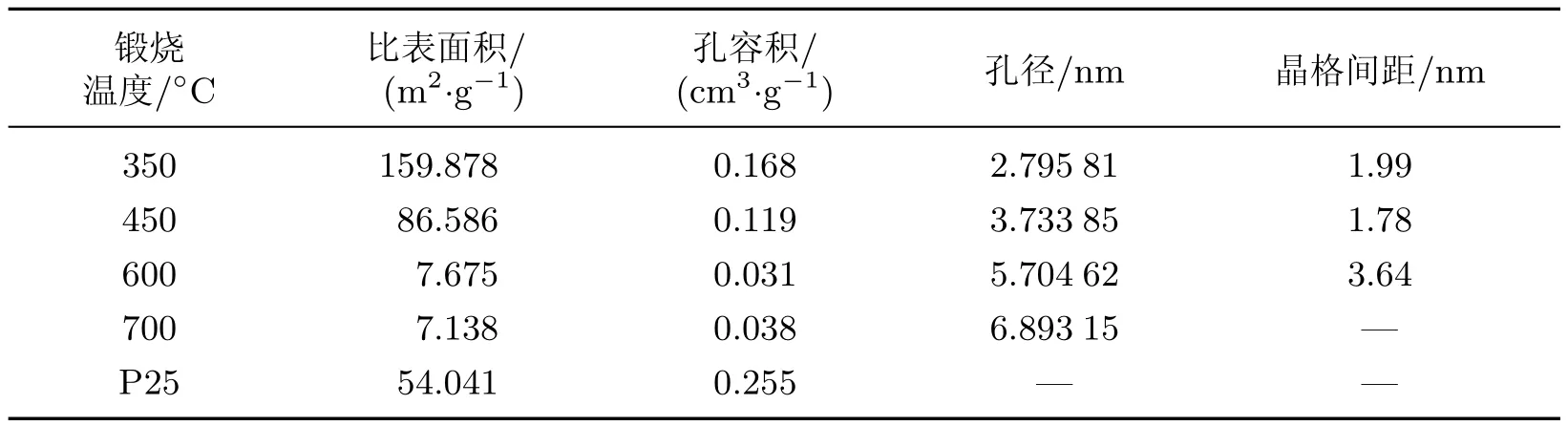
表1 煅烧温度对TiO2纳米球样品结构特性的影响Table 1 E ff ects of calcination temperatures on the textural properties of the TiO2nanospheres samples
利用Cr(VI)和BPA的可见光降解实验来表征TiO2纳米球样品的光催化性能.作为对照,商业P25也在相同的条件下进行平行实验.在Cr(VI)/BPA体系中,不同煅烧温度下制备的TiO2纳米球对Cr(VI)的降解效果如图5所示.在此体系中,随着可见光照射时间的延长, Cr(VI)在540 nm处的吸收峰迅速下降,说明溶液中Cr(VI)的浓度逐渐降低.图6为可见光条件下,不同煅烧温度下制备的TiO2纳米球催化降解Cr(VI)/BPA过程中Cr(VI)的浓度变化-时间曲线图,其中C和C0分别为吸附平衡后的初始浓度和反应浓度.由图可知,350◦C煅烧温度下得到的TiO2纳米球样品具有最佳的光催化性能,其在10 min内降解了约32%的Cr(VI);当光照时间为50 min时,Cr(VI)的降解率达到了100%;而商业P25在相同条件下,降解100%的Cr(VI)需要90 min.结合BET结果可以推测,较大的表面积和较小的晶粒尺寸可产生较高的光催化性能.这与Peng等[12],Kim等[13]和Wang等[14]的报道一致.因此,本工作采用350◦C煅烧温度下得到的TiO2纳米球样品进行深入研究.
为了进一步研究BPA和Cr(VI)的可见光协同降解机理,本工作利用350◦C煅烧温度下得到的TiO2纳米球在不同条件下进行可见光催化性能研究.图7是不同条件下,Cr(VI)在不同降解时间下的紫外-可见吸收光谱,与之对应的是光催化降解Cr(VI)的浓度变化-时间曲线(见图8).由图8可知,当无TiO2存在时,在单独的Cr(VI)或者BPA和Cr(VI)同时存在条件下,均不发生降解;在TiO2/Cr(VI)体系中,当光照时间为90 min时,Cr(VI)的降解率可达65%;在TiO2/BPA/Cr(VI)体系中,当光照时间为50 min时,Cr(VI)的降解率就已达到100%.作为对比,在P25/Cr(VI)体系中,当光照时间为90 min时,Cr(VI)的降解率仅为25%;而在P25/BPA/Cr(VI)体系中,当光照时间为90 min时,Cr(VI)的降解率才可达到100%.因此,在TiO2/BPA/Cr(VI)体系的可见光降解过程中,BPA起到了重要的作用.

图5 在不同煅烧温度下制备的TiO2纳米球在Cr(VI)/BPA体系中可见光降解Cr(VI)的紫外-可见吸收光谱Fig.5 UV-visible absorption spectra of Cr(VI)photocatalytic degradation in the Cr(VI)/BPA system with TiO2nanospheres obtained from di ff erent calcination temperatures
为了进一步了解BPA在TiO2/BPA/Cr(VI)体系的可见光降解过程中的作用,对上述不同条件下,BPA的降解率进行了分析.图9为BPA的标准色谱峰.图10为降解时间不同时,BPA的高效液相色谱(high performance liquid chromatography,HPLC)图.可见,随着降解的进行,BPA的色谱峰(保留时间为3.29 min)逐渐下降.图11是在BPA/Cr(VI)体系下,350◦C煅烧温度下制备的TiO2纳米球的可见光降解BPA的浓度变化-时间曲线图.由图可知:在TiO2/BPA体系中,当光照时间为90 min时,BPA的降解率可达87%;而在TiO2/BPA/Cr(VI)体系中,当光照时间为20 min时,BPA的降解率就可达到100%.作为对比,在P25/BPA体系中,当光照时间为90 min时,BPA的降解率仅为70%;而在P25/BPA/Cr(VI)体系中,当光照时间为30 min时,BPA的降解率才可达到100%.因此,在TiO2/BPA/Cr(VI)降解体系中,BPA与Cr(VI)起到了相互促进的协同降解作用.
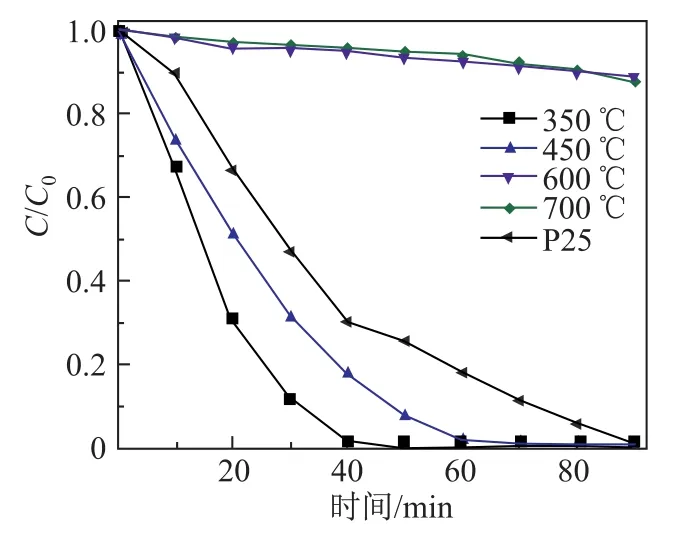
图6 不同煅烧温度下制备的TiO2纳米球在Cr(VI)/BPA体系中可见光降解Cr(VI)的浓度变化-时间曲线图Fig.6 Visible-light photocatalytic degradation of Cr(VI)concentration in the Cr(VI)/BPA system with TiO2nanospheres obtained from di ff erent calcination temperatures
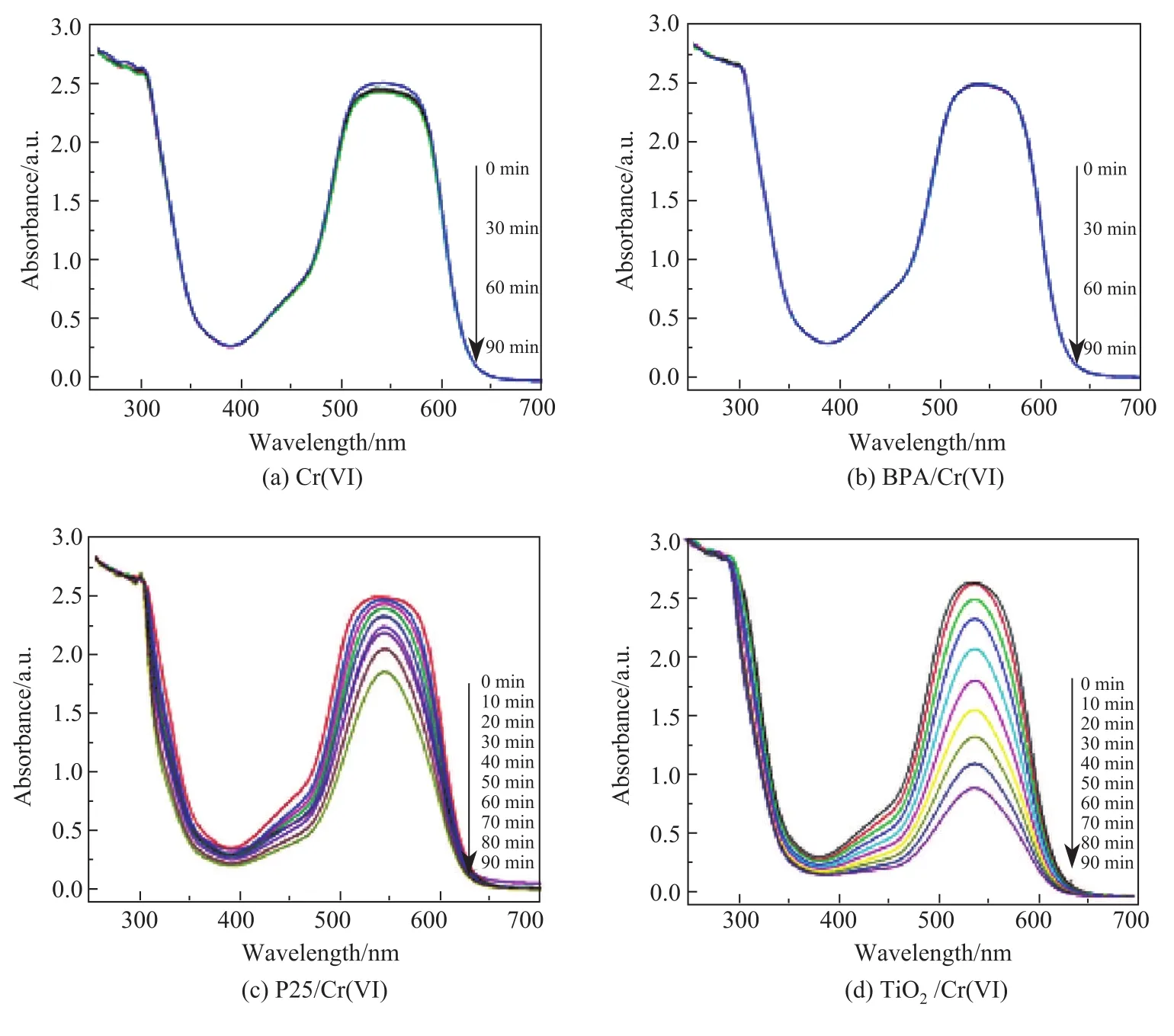

图7 Cr(VI)在不同体系中的紫外-可见吸收光谱Fig.7 UV-visible absorption spectra of Cr(VI)photocatalytic degradation
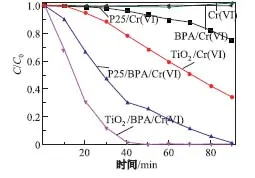
图8 在不同体系中可见光催化降解Cr(VI)的浓度变化-时间曲线Fig.8 Visible-light photocatalytic degradation of Cr(VI)concerntration in the di ff erent systems
图9 BPA的标准高效液相色谱图Fig.9 Standard HPLC image of BPA
2.5 可见光协同降解BPA和Cr(VI)的机理分析
采用固体紫外的吸收光谱(HITACH,U-3010)对BPA和大比表面积TiO2纳米球之间的相互作用进行了表征.图12是吸附了BPA和Cr(VI)的大比表面积TiO2纳米球粉末的固体紫外吸收光谱.可以看出,大比表面积TiO2纳米球的禁带宽度决定了其只能在波长小于400 nm的紫外区域具有光催化活性.然而,当BPA和Cr(VI)吸附在大比表面积TiO2纳米球表面时,此体系的吸收带边向可见光区域发生红移.由于BPA和Cr(VI)自身并不具备可见吸收,因此可以认为其与大比表面积TiO2纳米球形成了电荷转移络合物(CTC),电子由CTC分子内的配体轨道向金属中心Ti跃迁,使得其在可见光区域具有吸收.在可见光照射下,CTC被可见光激发,电子就会由BPA的最高占据分子轨道向金属中心即TiO2导带跃迁,继而被TiO2表面的吸附O2捕获,使得BPA失去电子被氧化成R+·,而O2接受电子被还原成O-·2; R+·随后历经一系列电子转移、O2加成和O-·2氧化,最终导致BPA的氧化降解.

图10 BPA在可见光下降解的HPLC图Fig.10 HPLC images of BPA under visible-light irradiation
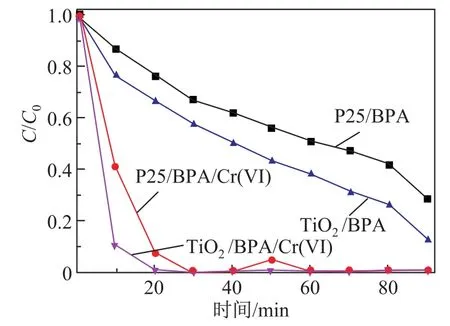
图11 350◦C煅烧温度下制备的TiO2纳米球在BPA/Cr(VI)体系中可见光降解BPA的浓度变化-时间曲线图Fig.11 Visible-light photocatalytic degradation of BPA concerntration in the Cr(VI)/BPA system with TiO2nanospheres obtained from calcined 350◦C
由图12还可以看出,Cr(VI)的存在极大地增强了大比表面积TiO2纳米球和BPA体系在可见光区域的吸收.这是由于吸收在催化剂表面上的Cr(VI)本身具有较强的可见光吸收.若扣除Cr(VI)自身的背景吸收,Cr(VI)对BPA-Cr(VI)-TiO2体系吸收能力的增强效果明显低于其对BPA降解的加速程度.这表明Cr(VI)促进CTC诱导TiO2可见光降解BPA的主要原因不在于增强了三元体系的可见光吸收能力,而是由于Cr(VI)作为合适的电子受体,抑制了已注入TiO2导带的电子和R+·的再复合.
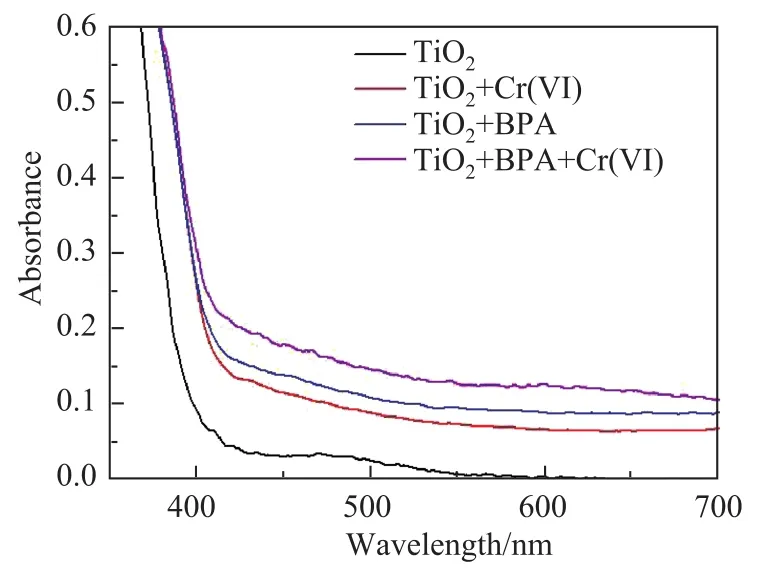
图12 吸附了BPA和Cr(VI)的大比表面积TiO2纳米球粉末的固体紫外吸收光谱Fig.12 UV-visible of BPA and Cr(VI)adsorbed large surface area TiO2nanospheres powder
上述实验结果表明,BPA可缓慢地发生CTC诱导反应.同时,添加Cr(VI)离子可极大地加速BPA的降解和矿化速率,其反应机理如图13所示.首先,BPA吸附在TiO2纳米球表面,形成了具可见光吸收的CTC;然后,在可见光照射下,CTC被光激发,引起电子由BPA分子向TiO2纳米球导带跃迁.在通常情况下,已注入TiO2纳米球导带的电子会被催化剂表面的吸附O2捕获,相继产生O-·2和氧化物种.此CTC诱导反应的主要步骤是在催化剂表面进行的.由于O2主要吸附在TiO2纳米球表面的缺陷位点上,致使O2的吸附扩散过程缓慢,阻碍了其快速捕获电子的能力.因此,O2作为电子受体,不能有效抑制TiO2导带的电子和R+·的复合,使得有机物的降解速率缓慢,矿化程度很低.
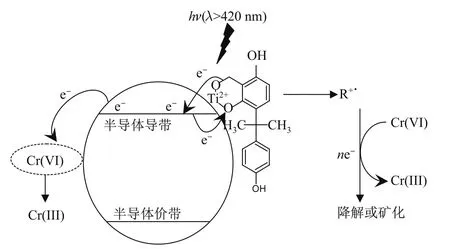
图13 在TiO2/Cr(VI)/BPA体系下,TiO2纳米球的可见光催化降解过程Fig.13 Schematic illustrations of the degradation of Cr(VI)and BPA in the TiO2/Cr(VI)/BPA system under visible-light irradiation on the TiO2nanospheres
若向TiO2纳米球悬浮液中加入合适的电子受体Cr(VI)离子,则其很容易通过静电引力或络合作用吸附在催化剂表面,从而有效捕获TiO2导带的电子,抑制其与R+·的复合,加速BPA的氧化降解.此外,由于这些电子受体具有比R+·更正的氧化还原电势,电子从R+·向电子捕获剂传递在热力学上是允许的,这会进一步促使R+·的氧化.因此,Cr(VI)离子的加入极大地促进了BPA的降解,同时提高了其矿化程度.
3 结束语
本研究以钛酸四正丁酯为钛源,十八烷基胺为模板剂,利用溶胶凝胶法结合水热反应法制备了TiO2纳米球,并考察了煅烧温度对其形貌和物性的影响.结果表明,当煅烧温度为350◦C时,制备的样品具有较好形貌,且其比表面积高达159.878 m2/g,为商用二氧化钛P25(54.041 m2/g)的3倍.该样品在可见光催化条件下,对水体中的Cr(VI)和BPA具有极佳地降解效果,且在同时降解这两种污染物时,其降解呈现协同作用效果.协同降解的作用机理在于BPA可与大比表面积TiO2纳米球形成CTC.此CTC可被可见光激发,引起电子由BPA分子向TiO2纳米球导带跃迁,从而产生光生电子.此光生电子又可与吸附在TiO2纳米球表面的Cr(VI)发生还原反应,从而避免了光生电子与空穴的再结合,大大提高了TiO2的光催化效率.
[1]YU J G,WEN L,YU H G.A one-pot approach to hierarchically nanoporous titania hollow microspheres with high photocatalytic activity[J].Crystal Growth&Design,2008,8:930-934.
[2]GARAdKAR K M,SHIRKE B S,HANKARE P P.Low cost nanostructured anatase TiO2as a H2S gas sensor synthesized by microwave assisted technique[J].Sensor Letters,2011,9(2):526-532.
[3]FUjISHIMA A,RAO T N,TRYK D A.Titanium dioxide photocatalysis[J].Journal of Photochemistry and Photobiology C:Photochemistry Reviews,2000,1(1):1-21.
[4]FUjISHIMA A,HASHIMOTO K,IYOdA T,et al.Titanium dioxide photocatalyst:US,6939611[P]. 2002-05-04.
[5]FUjISHIMA A,ZHANG X.Titanium dioxide photocatalysis:present situation and future approaches[J].Comptes Rendus Chimie,2006,9(5/6):750-760.
[6]WANG H E,ZHENG L X,LIU C P,et al.Rapid microwave synthesis of porous TiO2spheres and their applications in dye-sensitized solar cells[J].The Journal of Physical Chemistry C,2011, 115(21):10419-10425.
[7]王艳丽,谈顺,吴秋霞,等,二氧化钛纳米管作为肿瘤药物载体系统的体外负载及释放[J].上海大学学报:自然科学版,2010,16(6):582-586.
[8]KUMAR S G,DEVI L G.Review on modi fi ed TiO2photocatalysis under UV/visible light: selected results and related mechanisms on interfacial charge carrier transfer dynamics[J].J Phys Chem A,2011,115(46):13211-13241.
[9]YAMAZAKI S,MORI T,KATOU T,et al.Photocatalytic degradation of 4-tert-octylphenol in water and the e ff ect of peroxydisulfate as additives[J].Journal of Photochemistry and Photobiology A:Chemistry,2008,199(2/3):330-335.
[10]SHANG J,ZHAO F W,ZHU T,et al.Photocatalytic degradation of rhodamine B by dye-sensitized TiO2under visible-light irradiation[J].Science China Chemistry,2011,54(1):167-172.
[11]PELAEZ M,NICHOLAS T N,SURESH C P,et al.A review on the visible light active titanium dioxide photocatalysts for environmental applications[J].Applied Catalysis B:Environmental, 2012,125:331-349.
[12]PENG T,ZHAO D,DAI K,et al.Synthesis of titanium dioxide nanoparticles with mesoporous anatase wall and high photocatalytic activity[J].J Phys Chem B,2005,109(11):4947-4952.
[13]KIM D S,HAN S J,KWAK S Y.Synthesis and photocatalytic activity of mesoporous TiO2with the surface area,crystallite size,and pore size[J].J Colloid Interface Sci,2007,316(1):85-91.
[14]WANG L,WANG N,ZHU L,et al.Photocatalytic reduction of Cr(VI)over di ff erent TiO2photocatalysts and the e ff ects of dissolved organic species[J].J Hazard Mater,2008,152(1):93-99.
[15]CHEN Y,STATHATOS E,DIONYSIOU D D.Microstructure characterization and photocatalytic activity of mesoporous TiO2fi lms with ultra fi ne anatase nanocrystallites[J].Surface and Coatings Technology,2008,202(10):1944-1950.
[16]TANG J,YIN P,LU X H,et al.Development of mesoporous TiO2microspheres with high speci fi c surface area for selective enrichment of phosphopeptides by mass spectrometric analysis[J].J Chromatogr A,2010,1217(15):2197-205.
[17]BAE S T,SHIN H,JUNG H S,et al.Synthesis of titanium carbide nanoparticles with a high speci fi c surface area from a TiO2core-sucrose shell precursor[J].Journal of the American Ceramic Society,2009,92(11):2512-2516.
[18]ERMOKHINA N I,NEVINSKIY V A,MANORIK P A,et al.Synthesis of large-pore mesoporous nanocrystalline TiO2microspheres[J].Materials Letters,2012,75:68-70.
[19]ZHOU M,YU J,CHENG B.E ff ects of Fe-doping on the photocatalytic activity of mesoporous TiO2powders prepared by an ultrasonic method[J].J Hazard Mater,2006,137(3):1838-1847.
[20]LI G,DIMITRIjEVIC N M,CHEN L,et al.Role of surface/interfacial Cu2+sites in the photocatalytic activity of coupled CuO-TiO2nanocomposites[J].The Journal of Physical Chemistry C,2008,112(48):19040-19044.
[21]沈嘉年,刘东,方斌,等.过渡金属掺杂的多孔二氧化钛薄膜电极光催化氧化技术[J].上海大学学报:自然科学版,2008,14(5):475-480.
[22]LIU G M,LI X Z,ZHAO J C.Photooxidation pathway of sulforhodamine-B dependence on the adsorption mode on TiO2exposed to visible light radiation[J].Environmental Science& Technology,2000,34(18):3982-3990.
[23]CHEN C C,LI X H,MA W H,et al.E ff ect of transition metal ions on the TiO2-assisted photodegradation of dyes under visible irradiation:a probe for the interfacial electron transfer process and reaction mechanism[J].The Journal of Physical Chemistry B,2002,106(2):318-324.
[24]LI X Z,LI F B.Study of Au/Au3+-TiO2photocatalysts toward visible photooxidation for water and wastewater treatment[J].Environmental Science&Technology,2001,35(11):2381-2387.
[25]KIM S,CHOI W Y.Dual photocatalytic pathways of trichloroacetate degradation on TiO2: e ff ects of nanosized platinum deposits on kinetics and mechanism[J].The Journal of Physical Chemistry B,2002,106(51):13311-13317.
[26]PAUL T,MILLER P L,STRATHMANN T J.Visible-light-mediated TiO2photocatalysis of fl uoroquinolone antibacterial agents[J].Environmental Science&Technology,2007,41(13):4720-4727.
[27]KIM S,CHOI W.Visible-light-induced photocatalytic degradation of 4-chlorophenol and phenolic compounds in aqueous suspension of pure titania:demonstrating the existence of a surfacecomplex-mediated path[J].The Journal of Physical Chemistry B,2005,109(11):5143-5149.
[28]WANG N,ZHU L H,HUANG Y P,et al.Drastically enhanced visible-light photocatalytic degradation of colorless aromatic pollutants over TiO2via a charge-transfer-complex path:a correlation between chemical structure and degradation rate of the pollutants[J].Journal of Catalysis,2009, 266(2):199-206.
[29]WANG N,ZHU L H,DENG K J,et al.Visible light photocatalytic reduction of Cr(VI)on TiO2in situ modi fi ed with small molecular weight organic acids[J].Applied Catalysis B: Environmental,2010,95(3/4):400-407.
本文彩色版可登陆本刊网站查询:http://www.journal.shu.edu.cn
Synthesis of TiO2nanospheres with large surface area for visible light synergistic catalytic degradation of Cr(VI)and bisphenol A
TRONGANH Nguyen,WANG Yu-jia,WANG Bin,CHENG Ling-li, DING Nan,JIAO Zheng
(School of Environmental and Chemical Engineering,Shanghai University,Shanghai 200444,China)
Titanium dioxide(TiO2)nanospheres were successfully synthesized by sol-gel combination with hydrothermal treatment using octadecylamine template and tetrabutyl titanate precursor,and the e ff ects of calcination temperature on the morphology of titanium dioxide.The results show that at the calcination temperature of 350◦C,the prepared TiO2nanospheres get the best morphology and their speci fi c surface area can reach 159.878 m2/g, three time higher than that of Degussa P25(54.041 m2/g).Moreover,photocatalytic properties of the TiO2nanospheres were tested through degradation of Cr(VI)and bisphenol A(BPA)under visible light.The results show that the TiO2nanospheres can e ff ectively degrade Cr(VI)and BPA in water,and the two pollutants’degradation has synergistic effect.In addition,TiO2nanospheres surface area determines its photocatalytic properties, and TiO2nanospheres prepared under 350◦C calcination conditions have optimal photocatalytic.
TiO2;bisphenol A(BPA);visible light photocatalysis
O 613
A
1007-2861(2015)04-0490-13
10.3969/j.issn.1007-2861.2014.03.008
2014-04-30
国家自然科学基金资助项目(61174011)
焦 正(1972—),男,教授,博士生导师,博士,研究方向为环境功能材料.E-mail:zjiao@shu.edu.cn
