肝细胞特异性MRI对比剂钆塞酸二钠评估肝脏储备功能的研究进展
2015-07-18兰莲君邱琳舒
兰莲君邱 琳舒 健
肝细胞特异性MRI对比剂钆塞酸二钠评估肝脏储备功能的研究进展
兰莲君1邱 琳2舒 健1
肝疾病;磁共振成像;造影剂;肝功能;综述
肝脏疾病特别是慢性肝炎、肝硬化的发病率极高,准确评估肝脏储备功能对外科手术风险、耐受程度、肝脏慢性病变的检测、疗效评估及制订治疗计划等尤为重要[1]。目前评价肝功能的方法很多,但均各有其局限性,而影像学方法评估肝功能具有无创、方便、可以重复多次等优点,并且有望实现节段性肝功能评估。其中肝细胞特异性MRI对比剂钆塞酸二钠(Gd-EOB-DTPA)因具有肝细胞特异性吸收的特征,在肝功能评估方面具有独到的优势,也是近年研究的热点。本文就Gd-EOB-DTPA MRI增强扫描在肝功能评估方面的运用进行综述。
1 评估肝功能的常用方法
1.1 肝功能定量实验 肝功能定量实验包括吲哚氰绿(indocyanine green,ICG)排泄试验、利多卡因试验、胰高血糖素负荷试验[1]和半乳糖清除试验等,这些试验药物几乎均由肝脏代谢。但是上述试验仅考虑肝细胞对药物摄取及代谢功能,未考虑对肝脏血流量及肝细胞物质交换功能的影响,导致实验指标正常也不能完全避免肝功能衰竭[2]。
1.2 综合评分系统 主要有Child-Pugh分级和终末期肝病模型(model of end stage liver disease,MELD)评分系统。虽然目前Child-Pugh分级已广泛用于肝叶切除患者的术前评估,但其5个变量均凭经验选入,含有主观因素,对病变严重性仅分为3级,取值范围窄,且某些指标易受治疗等因素影响,故很难准确反映手术前后的肝功能。MELD评分所选变量相对客观,对病变严重性的区分力较强,但非肝病因素会影响MELD分级中的肌酐、胆红素、国际标准化比值等指标,且MELD评分未考虑外科手术因素的影响,在肝叶切除方面预测肝功能尚存在许多局限性。
1.3 影像学评估方法 肝功能评估的影像学检查具有无创、方便、操作简单等优点,日益受到广大临床工作者的重视。其中CT和MRI可较准确地测量肝脏体积,Tu等[3]认为肝脏体积与肝储备功能有关。而SPE-CT可测定功能性肝脏体积,甚至能够反映每个叶段的功能信息,但因其空间分辨率低,检测所需的同位素缺乏且价格昂贵,因此临床推广困难。CT及MRI灌注成像可以反映肝脏血流灌注情况。扩散加权成像能反映微观水分子的流动、扩散及细胞内外水平衡等信息,Sandrasegaran等[4]认为肝脏ADC值可以评估肝纤维化的严重程度,两者呈负相关。MRI波普成像可在活体状态下定性、定量地测定细胞内代谢产物(如三酰甘油),进而评估肝功能,但其信噪比低、受影响因素多,不能很好地解决呼吸运动带来的组织污染[5]。肝细胞特异性对比剂Gd-EOBDTPA MRI成像评估肝功能是近年来研究的热点,具有其他影像检查不可替代的优势。
2 钆塞酸二钠的概述
Gd-EOB-DTPA是在非特异性对比剂钆喷替酸葡甲胺分子上添加脂溶性的乙氧基苯甲基(EOB)形成,其进入肝脏后,被肝细胞膜上有机阴离子载体多肽摄取,摄取量为40%~60%,并通过肝脏毛细胆管细胞膜上另一载体即多药抵抗蛋白(MRPs)排泄入胆汁,其余经肾脏排泄,肝、肾排泄率几乎相同[6];肝胆期始于静脉注射后约20 min,持续2 h[7],静脉注射剂量仅为普通对比剂的1/4(0.025 mmol/kg)。该类对比剂具有细胞外间隙对比剂和肝脏特异性对比剂双重作用,主要用于肝脏疾病的鉴别诊断及肝功能的评估。
3 钆塞酸二钠MRI增强扫描评估肝脏储备功能的参数
3.1 T1弛豫
3.1.1 相对强化程度(elative enhancement,RE) Verloh等[8]采用3D扰相梯度回波T1序列测定肝实质Gd-EOB-DTPA增强扫描前后的T1信号强度(SIpre、SIpost),根据公式(1)计算增强扫描前后的RE。
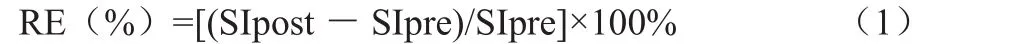
分析RE与MELD评分的相关性,并通过统计学分析得出区别正常肝功能及肝功能受损的RE临界值。Wibmer等[9]也通过RE分析其预测肝大部切除术后肝衰竭的效力,结果证实术后肝衰竭组的各叶平均RE低于未衰竭组,并且通过多因素回归分析证实RE为预测术后肝衰竭的独立影响因素。
3.1.2 肝脏摄取率 Dahlqvist等[10]通过测定肝功能正常者与肝功能受损患者Gd-EOB-DTPA增强扫描前后肝、脾T1信号强度,再用药代动力学模型计算脾脏矫正后的肝脏摄取率,发现使用Gd-EOB-DTPA增强扫描后,肝功能受损患者的肝脏摄取率明显低于肝功能正常者。
3.1.3 肝脏摄取分数 Ryeom等[11]通过制备肝细胞性肝癌动物模型,获得Gd-EOB-DTPA动态增强扫描肝区与主动脉区的时间-信号强度曲线,利用反卷积法计算出肝脏摄取分数,结果发现诱导形成肝细胞肝癌后肝脏摄取分数显著降低,同时也证明了肝脏摄取分数与ICG15(15 min ICG清除率)有很好的相关性。
3.1.4 吸收指数 Yamada等[12]对肝病患者进行Gd-EOBDTPA增强扫描,得出增强扫描20 min后肝、脾信号强度(L20、S20)及肝脏体积(VL),根据公式(2)计算肝细胞吸收指数(hepatocellular uptake index,HUI)。

对HUI与ICG清除率进行回归分析,结果证明肝细胞HUI可用于定量评估与ICG清除率相关的肝功能,并且有可能提高肝段功能的评估水平。
3.1.5 信号比增加百分率 罗宴吉等[13]通过测定Gd-EOBDTPA对比增强扫描前后肝脏及同层面竖脊肌信号强度比值,根据公式(3)计算信号比增加百分率(increased signal,IS)。
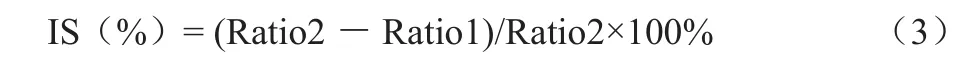
其中Ratio1、Ratio2分别为扰相梯度回波T1加权上对比增强扫描前后肝脏与竖脊肌信号比值,结果表明IS与肝功能不同Child-Pugh分级差异有统计学意义。
3.1.6 信噪比峰值 Tajima等[14]对不同肝病患者行肝脏容积加速采集,利用多重回归统计分析Gd-EOB-DTPA增强扫描后的肝脏实质信噪比峰值与肝功能各血清学指标的关系,结果发现肝功能受损组肝脏信噪比峰值明显低于肝功能正常组,并且肝实质信噪比峰值与ICG15紧密相关,提示通过测量Gd-EOB-DTPA增强扫描后肝脏实质信噪比峰值也可评估肝脏功能。
3.1.7 T1弛豫时间及T1图 有学者[15-17]对肝功能正常及慢性肝病不同肝功能分级(Child-Pugh分级或MELD分级)患者进行Gd-EOB-DTPA增强扫描,绘制出不同肝功能组的T1图,并计算Gd-EOB-DTPA增强扫描前和强化后20 min的T1弛豫时间及增强扫描后T1时间减低率,结果显示随着肝功能Child-Pugh分级或MELD分级增高,强化后肝实质的T1弛豫时间延长,而强化后T1弛豫时间的降低率减低。Haimerl等[15]还通过肝实质强化后T1时间及T1时间减低率定量评估肝功能受损的临界值,并提出肝实质强化后T1时间降低50%可作为区别肝功能正常和轻度受损的参考值。因此肝实质T1弛豫时间或T1图可作为评估肝储备功能的有效方法。以上参数均证实肝实质Gd-EOB-DTPA增强扫描前后T1弛豫的变化可定量评估肝功能。
Kamimura等[18]对比肝功能不同Child-Pugh分级患者Gd-EOB-DTPA增强扫描后肝实质的T1弛豫时间与T1信号强度对肝功能评价的效力,发现T1弛豫时间与肝功能不同Child-Pugh分级之间有很好的相关性,能很好地区分正常肝功能与不同Child-Pugh分级患者,而肝实质信号强度变化仅在区别正常肝功能与Child-Pugh B级时有显著差异,且T1弛豫时间与ICG清除率的相关性更好。
3.2 T2*弛豫时间降低率 Katsube等[19]对不同肝功能(Child-Pugh)分级患者行多回波T2*加权成像,通过后处理软件得到组织T2*图,并计算肝实质Gd-EOB-DTPA强化后T2* 弛豫时间降低率,结果显示随着肝功能Child-Pugh分级增高,Gd-EOB-DTPA强化后T2* 弛豫时间降低率减低,从而证实T2* 弛豫降低率也可以评估肝功能,但相对于T1值减低率各组T2* 值降低率较小,且各组间T2* 弛豫时间差异无统计学意义。
3.3 胆道强化程度 Okada等[20]将不同肝功能分级及不同血清总胆红水平患者进行分组,对其各时间点肝实质和胆道强化程度进行分析,结果证实胆道强化程度与肝实质强化程度密切相关,肝功能明显受损患者的肝实质及胆道强化程度低于肝功能正常或轻度受损者,且其肝实质及胆道强化程度上升延迟,同时随着胆红素水平的增高,肝实质及胆道强化程度减低。Takao等[21]将胆道强化程度与总胆红素、血清白蛋白、凝血酶原时间及ICG 15进行回归分析,证实肝功能异常的患者胆道强化延迟,强化峰值减低,且ICG 15可以很好地预测胆道强化程度。Tschirch等[22]的研究表明,肝功能正常组在注射Gd-EOB-DTPA后20 min得到满意的胆道图像,而肝功能异常组只有40%的患者在30 min内得到满意的胆道图像,并将其与MELD评分及实验室检查进行分析,在注药后20 min,胆道不能充分显影的临界值为MELD评分≥11分、血清总胆红素≥30 mmol/L。提示肝功能受损的患者胆道系统显示差,甚至不显示,间接证明胆道系统的强化程度可以评估肝功能。冯汝静等[23]对肝胆排泄期的各级胆管显示情况进行5级评分,再根据各级胆管显示总评分对肝功能进行评估,结果证实用Gd-EOB-DTPA对比增强的肝功能MR分级与Child-Pugh分级吻合程度极好。Feng等[24]认为肝功能Child-Pugh分级A级组的胆管可视化程度及胆总管信号强度较B、C级组高,且血清总胆红素及MELD评分能很好地预测胆总管信号强度。
3.4 钆塞酸二钠MRI灌注成像 Xie等[25]对不同肝纤维化分级患者进行MRI Gd-EOB-DTPA灌注成像,得到时间-信号强度曲线,用节段性线性拟合将其分为门静脉信号达峰值到感兴趣区(ROI)信号达峰值的间隔时间(Tin)、ROI信号开始下降到其信号下降斜率的转折点(Tout)以及信号下降斜率改变后的斜率(Kup),分别代表动脉及门静脉灌注时间、造影剂廓清并特异性摄取及肝胆期肝脏摄取率,并得出ROI信号峰值与强化后20 min信号比值。结果发现血清前白蛋白与Kup和信号比成正比,与Tin和Tout成反比,晚期肝纤维化组(S3~4)的Tin和Tout比正常组及早期肝纤维化组(S0~2)长,且Kup和信号比更小,而Tout为预测晚期肝纤维化最好的指标,提示Gd-EOB-DTPA MRI灌注成像也可以定量评估肝功能。
4 总结与展望
Gd-EOB-DTPA可定性甚至定量评估肝脏储备功能,既往文献还制订了无创性评估肝脏储备功能的MRI量化指标[15],使区域性肝功能评估[13]成为可能。但是Gd-EOB-DTPA增强扫描用于肝功能评估尚处于临床试验阶段,缺乏大量临床数据支持,目前仍缺乏定量的评估标准,且扫描过程耗时较长,部分需要特殊的扫描序列及特定的后处理软件,并不适合所有肝病患者。然而MRI Gd-EOB-DTPA增强扫描在无创性及区域性肝功能评估中仍具有不可替代的作用,随着相关研究的成熟与完善,期待Gd-EOB-DTPA MRI增强扫描能更好地检测慢性肝病肝功能的情况并更好地预防术后肝衰竭。
[1] 李龄, 朱小东. 肝脏储备功能评价. 中国医学文摘: 内科学, 2006, 27(6): 543-544.
[2] Tarantino G. Could quantitative liver function tests gain wide acceptance among hepatologists? World J Gastroenterol, 2009, 15(28): 3457-3461.
[3] Tu R, Xia LP, Yu AL, et al. Assessment of hepatic functional reserve by cirrhosis grading and liver volume measurement using CT. World J Gastroenterol, 2007, 13(29): 3956-3961.
[4] Sandrasegaran K, Akisik FM, Lin Chen, et al. Value of diffusionweighted MRI for assessing liver fibrosis and cirrhosis. Am J Roentgenol, 2009, 193(6): 1556-1560.
[5] 苏中振, 单鸿. 肝储备功能定量评估的影像学研究进展. 中国医学影像技术, 2007, 23(11): 1741-1744.
[6] Hamm B, Staks T, Mühler A, et al. Phase I clinical evaluation of Gd-EOBDTPA as a hepatobiliary MR contrast agent: safety, pharmacokinetics, and MR imaging. Radiology, 1995, 195(3): 785-792.
[7] Jeong WK, Kim YK, Song KD, et al. The MR imaging diagnosis of liver diseases using gadoxetic acid: emphasis on hepatobiliary phase. Clin Mol Hepatol, 2013, 19(4): 360-366.
[8] Verloh N, Haimerl M, Zeman F, et al. Assessing liver function by liver enhancement during the hepatobiliary phase with Gd-EOB-DTPA-enhanced MRI at 3 Tesla. Eur Radiol, 2014, 24(5): 1013-1019.
[9] Wibmer A, Prusa AM, Nolz R, et al. Liver failure after major liver resection: risk assessment by using preoperative Gadoxetic acidenhanced 3-T MR imaging. Radiology, 2013, 269(3): 777-786.
[10] Dahlqvist Leinhard O, Dahlström N, Kihlberg J, et al. Quantifying differences in hepatic uptake of the liver specif i c contrast agents Gd-EOB-DTPA and Gd-BOPTA: a pilot study. Eur Radiol, 2012, 22(3): 642-653.
[11] Ryeom HK, Kim SH, Kim JY, et al. Quantitative evaluation of liver function with MRI using Gd-EOB-DTPA. Korean J Radiol, 2004, 5(4): 231-239.
[12] Yamada A, Hara T, Li Feng, et al. Quantitative evaluation of liver function with use of gadoxetate disodium-enhanced MR imaging. Radiology, 2011, 260(3): 727-733.
[13] 罗宴吉, 蔡华崧, 汤地, 等. 肝细胞特异性MR对比剂在肝脏功能评价中的初步研究. 中华消化病与影像杂志(电子版), 2013, 3(5): 23-26.
[14] Tajima T, Takao H, Akai H, et al. Relationship between liver function and liver singal intensity in hepatobiliary phase of gadoliniun ethoxybenzyl diethylenetriamine pentaacetic acidenhanced magnetic resonance imaging. J Comput Assist Tomogr, 2010, 34(3): 362-366.
[15] Haimerl M, Verloh N, Fellner C, et al. MRI-based estimation of liver function: Gd-EOB-DTPA-enhanced T1 relaxometry of 3T vs. the MELD score. Sci Rep, 2014, (4): 5621.
[16] Haimerl M, Verloh N, Zeman F, et al. Assessment of clinical signs of liver cirrhosis using T1 mapping on Gd-EOB-DTPA-enhanced 3T MRI. PLoS One, 2013, 8(12): e85658.
[17] Katsube T, Okada M, Kumano S, et al. Estimation of liver function using T1 mapping on Gd-EOB-DTPA-enhanced magnetic resonance imaging. Invest Radiol, 2011, 46(4): 277-283.
[18] Kamimura K, Fukukura Y, Yoneyama T, et al. Quantitative evaluation of liver function with T1 relaxation time index on Gd-EOB-DTPA-enhanced MRI: comparison with signal intensitybased indices. J Magn Reson Imaging, 2014, 40(4): 884-889.
[19] Katsube T, Okada M, Kumano S, et al. Estimation of liver function using T2* mapping on Gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid enhanced magnetic resonance imaging. Eur J Radiol, 2012, 81(7): 1460-1464.
[20] Okada M, Ishii K, Numata Kazushi, et al. Can the biliary enhancement of Gd-EOB-DTPA predict the degree of liver function? Hepatobiliary Pancreat Dis Int, 2012, 11(3): 307-313.
[21] Takao H, Akai H, Tajima T, et al. MR imaging of the biliary tract with Gd-EOB-DTPA: effect of liver function on signal intensity. Eur J Radiol, 2011, 77(2): 325-329.
[22] Tschirch FT, Struwe A, Petrowsky H, et al. Contrast-enhanced MR cholangiography with Gd-EOB-DTPA in patients with liver cirrhosis: visualization of the biliary ducts in comparison with patients with normal liver parenchyma. Eur Radiol, 2008, 18(8): 1577-1586.
[23] 冯汝静, 黄仲奎. MR特异性对比剂肝功能评价研究. 临床放射学杂志, 2013, 32(4): 503-507.
[24] Feng ST, Wu L, Chan T, et al. Functional magnetic resonance cholangiography enhanced with Gd-EOB-DTPA: effect of liver function on biliary system visualization. J Magn Reson Imaging, 2014, 39(5): 1254-1258.
[25] Xie S, Sun Y, Wang L, et al. Assessment of liver function and liver fi brosis with dynamic Gd-EOB-DTPA-enhanced MRI. Acad Radiol, 2015, 22(4): 460-466.
R445.2;R657.3
2015-02-02
2015-07-12
(本文编辑 冯 婕)
1.泸州医学院附属医院放射科 四川泸州 646000;
2.泸州医学院附属医院核医学科 四川泸州 646000
舒 健 E-mail: shujiannc@163.com
10.3969/j.issn.1005-5185.2015.08.019
