水稻二半乳糖甘油酯合成酶DGD 响应热胁迫的 生物信息学和基因表达分析
2015-07-15彭澎刘兰兰汪启明饶力群
彭澎,刘兰兰,汪启明,饶力群
(湖南农业大学生物科学技术学院,湖南 长沙 410128)
随着全球气温的上升,热逆境对植物的影响日趋显著[1–2]。水稻在孕穗期和抽穗期对温度极为敏感[3]。水稻剑叶的膜透性与温度相关,它影响细胞膜结构的稳定性,从而影响水稻生长[4]。植物类囊体膜的通透性与植物耐热存在密切联系,类囊体二半乳糖甘油酯合成酶(DGD)基因对膜通透性起调控作用。在拟南芥和其他一些高等植物中,DGD 基因通过调控类囊体单半乳糖甘油酯和双半乳糖甘油酯的比例调控拟南芥耐热能力,从生理水平提高植物的耐热性[5]。关于DGD 基因功能研究的研究对象多集中于拟南芥[6–8],而对于其在水稻中表达的研究较少。利用基因芯片分析植物逆境胁迫下的表达情况,可以发掘与胁迫响应相关的基因,探究逆境胁迫下的分子机制,为植物抗逆提供理论基础[9]。笔者通过多种水稻生物信息学网站,分析水稻DGD基因的基因序列及其响应热和干旱胁迫的表达特征;利用实时定量PCR 技术,分析OsDGD 在不同时间热胁迫日本晴、9311 和N22 中的表达水平,旨在进一步明确OsDGD 参与水稻耐热信号传导的机理。
1 材料和方法
1.1 材料
供试材料为日本晴(Oryza sativa L. spp. japonica cv. Nipponbare)、9311(Oryza sativa L. spp. indica cv. 9311)、N22(Oryza sativa L. spp. Aus cv. Nagina 22)水稻品种。
1.2 方法
1.2.1 水稻DGD 基因的生物信息学分析
水稻DGD 基因的结构特征和上游调控元件分别由Rice–map(http://www.ricemap.org/ index.jsp)和PlantCARE(http://bioinformatics.psb.ugent.be/webtool s/plantcare/html/)进行分析;分别进行蛋白同源性及相互作用分析和系统进化树的构建。利用STRING(http://www.string–db.org/)分析蛋白同源性及其相互作用;运用MEGA 5.0 软件构建系统进化树;利用ROAD(http://ricearray.org/index.shtml)进行水稻DGD 基因的生物芯片分析,其中干旱胁迫处理水稻分蘖期叶片的相对含水量为65% ~75%,热胁迫处理材料为生长14 d 的水稻幼苗,于42℃培养3 h。
1.2.2 水稻DGD 基因表达的实时荧光定量分析
取幼穗分化至6 ~7 期的水稻材料,置于光照16 h、相对湿度80%、42℃的恒温培养室,分别取处理0、3、6、12 h 的水稻剑叶进行液氮速冻,于-80℃保存,以处理0 h 的植株为对照。利用Trizol法分别提取以上材料的总RNA,反转录合成cDNA,均一化浓度后作为反应模板。根据OsDGD 的cDNA序列设计特异引物,以水稻ACTIN 作为内参基因(表1),进行实时荧光定量PCR 扩增,反应步骤参照荧光定量PCR 试剂盒(康为世纪公司)。试验进行3次重复。相对表达水平用2–ΔΔCt法[10]计算。
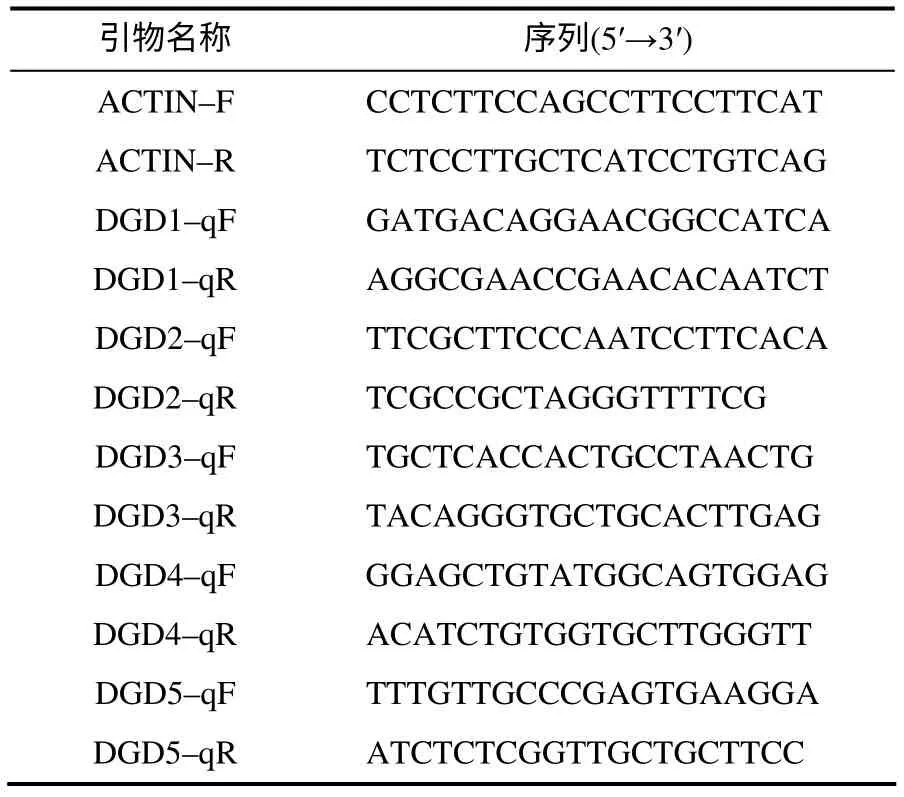
表1 实时荧光定量PCR引物 Table 1 Primers for RT–qPCR
2 结果与分析
2.1 水稻DGD 基因的生物信息学分析结果
2.1.1 水稻DGD 基因的序列分析结果
比对拟南芥DGD 序列,发现水稻DGD2 基因(LOC_Os11g05990)位于11 号染色体,长度为4 773 bp,其蛋白质含737个氨基酸残基。进一步在水稻基因组中比对水稻DGD2 基因,发现水稻中还存在另外4个与OsDGD2(LOC_Os11g05990)同源性较高的基因 OsDGD1(LOC_Os03g11560.1)、OsDGD3 (LOC_Os02g33580.1)、OsDGD4(LOC_Os 03g16140.1)和OsDGD5(LOC_Os04g34000.1),它们都具有二半乳糖甘油脂合成酶功能。分析OsDGD 启动子顺式作用元件,发现5个基因均具有光应答顺式作用元件G–box,且OsDGD3 和OsDGD4 具有热胁迫应答顺式作用元件HSE,OsDGD2、OsDGD3、OsDGD4和OsDGD5都具有脱落酸应答顺式作用元件ABRE。
2.1.2 水稻DGD 的同源比对与进化分析
通过STRING 对5个OsDGD 的蛋白序列进行同源比对,并构建系统进化树(图1)。由图1 可知,DGD 存在于多个物种中,在高粱、短柄草、拟南芥、葡萄和毛果杨的相似度较高,表明DGD 基因在多种物种中保守存在。

图1 OsDGD同源蛋白的系统进化树 Fig.1 Phylogenetic tree of OsDGDgenes and their homologous proteins
2.1.3 水稻DGD 基因的生物芯片分析
水稻对干旱的响应能力分析结果表明,在叶、根、穗等部位,OsDGD2、OsDGD3、OsDGD4 和OsDGD5 基因在干旱胁迫处理后的表达水平比正常生长的均高,而OsDGD1 的表达水平比正常生长的低(图2–A)。通过对水稻热胁迫响应能力进行分析,发现5个OsDGD 基因的表达水平均比正常生长的低(图2–B)。通过对OsDGD 在不同水稻品种中的表达进行分析,发现在日本晴和9311 中,OsDGD1、OsDGD2 和OsDGD5 基因的表达量均不高,而OsDGD3 和OsDGD4 的表达量较高(图3–A)。在N22中,OsDGD2、OsDGD3 和OsDGD4 的表达量较高,而OsDGD1 和OsDGD5 的表达量较低(图3–B)。

图2 OsDGD基因在干旱和热胁迫下的芯片表达分析结果 Fig.2 Chip expression analysis of OsDGDgenes in drought and thermal stresses

图3 OsDGD基因在不同材料中的芯片表达分析结果 Fig.3 Chip expression analysis for OsDGDgenes at different materials
2.2 水稻DGD 基因响应热胁迫的表达分析
利用实时定量PCR 方法研究OsDGD 在热胁迫时的表达水平,结果表明,不同水稻品种中,OsDGD响应热胁迫的表达呈现较大的差异。在热胁迫时,OsDGD1 在日本晴及9311 中的表达量下降,在N22中的表达量升高。OsDGD1 在9311 中的表达量随着热处理时间的增加而逐渐降低;在日本晴及N22中,随着热处理时间的增加,其表达量也逐渐增加(图4)。OsDGD2 在日本晴中的表达为先下降后升高,随着热处理时间的增加,其表达量逐渐升高;在9311 中,OsDGD2 的表达量下降,且3 h 处理后的表达量基本不变;在N22 中,OsDGD2 在高温胁迫下被显著诱导,其表达量明显提高(图 5)。OsDGD3 基因在日本晴及9311 中,其表达是先下降后升高,而在N22 中表达明显提高,且随着高温胁迫时间的增加,其表达量均逐渐增加(图6)。OsDGD4 与OsDGD3 呈现出类似的表达情况,但其总体表达量均比OsDGD3 的高(图7)。随着高温胁迫时间的增加,OsDGD5 在日本晴中的表达量逐渐增加;随着热处理时间增加,OsDGD5 在9311 及N22 中的表达量有所下降(图8)。上述研究结果表明,随高温处理时间的增加,在耐热水稻中,OsDGD1、OsDGD2、OsDGD3 和OsDGD4 的表达量增加,而在不耐热水稻中的表达量减少,表明OsDGD1、OsDGD2、OsDGD3 和OsDGD4 参与了水稻的热胁迫反应。
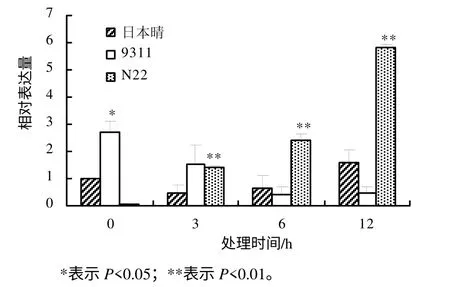
图4 OsDGD1 在不同热胁迫处理水稻中的相对表达量 Fig.4 Expression analysis for OsDGD1 at different thermal stresses and different rice varieties
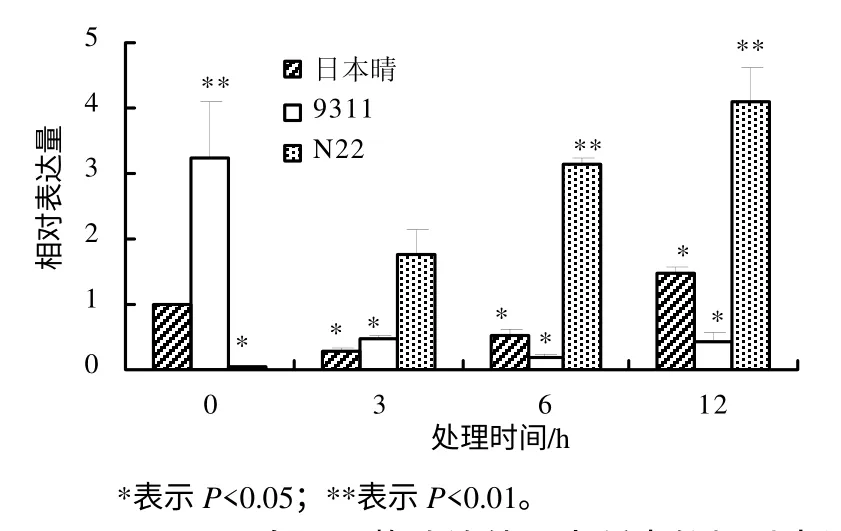
图5 OsDGD2 在不同热胁迫处理水稻中的相对表达量 Fig.5 Expression analysis for OsDGD2 at different thermal stresses and different rice varieties
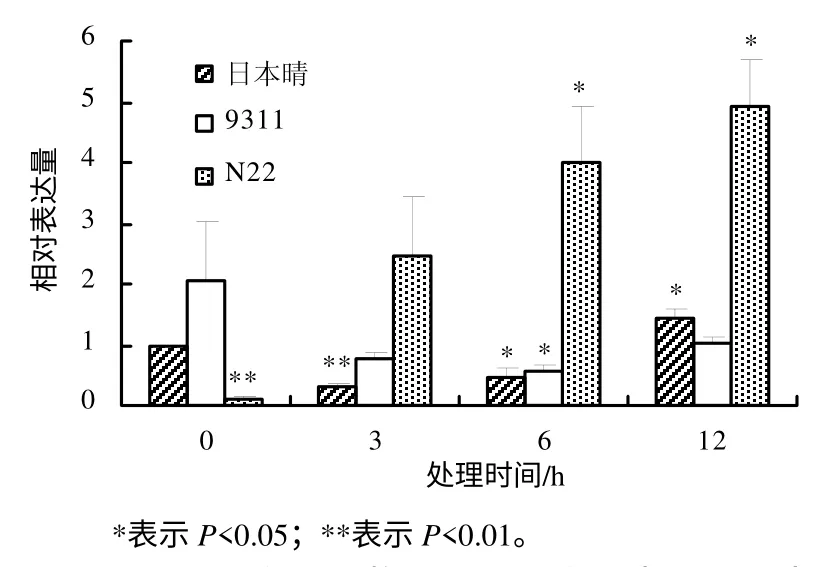
图6 OsDGD3 在不同热胁迫处理水稻中的相对表达量 Fig.6 Expression analysis for OsDGD3 at different thermal stresses and different rice varieties
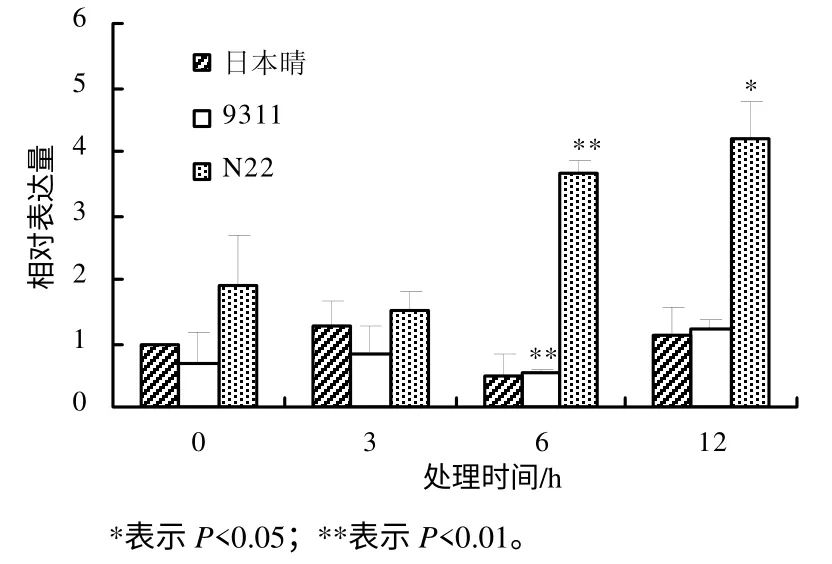
图7 OsDGD4 在不同热胁迫处理水稻中的相对表达量 Fig.7 Expression analysis for OsDGD4 at different thermal stresses and different rice varieties

图8 OsDGD5 在不同热胁迫处理水稻中的相对表达量 Fig.8 Expression analysis for OsDGD5 at different thermal stresses and different rice varieties
3 结论与讨论
拟南芥DGD1 突变体的DGDG 含量较野生型的低,导致该突变体的光合系统结构和功能以及对热胁迫的响应等方面均发生了一定变化[11–12]。本研究中通过生物信息学网站STRING,分析了可能与OsDGD 蛋白相互作用的蛋白,发现粳稻中参与合成光合膜主要结构成分的单半乳糖甘油酯合成酶与OsDGD 的相互作用最强,表明DGD 与叶绿体中类囊体膜的透性相关。对OsDGD 启动子顺式作用元件的分析结果表明,5个基因分别具有与光应答和非生物胁迫相关的作用元件。热胁迫应答顺式作用元件HSE,OsDGD2、OsDGD3、OsDGD4 和OsDGD5 具有脱落酸应答顺式作用元件ABRE。由此推测,OsDGD 可能参与调控光合系统结构和响应耐热等非生物胁迫的信号传导。
水稻耐热品种N22 受热胁迫时表现出相对较好的花药开裂水平和较高的结实率,体现了其本质的耐热性[13]。Li 等[14]和Deepti 等[15]发现水稻N22品种响应干旱胁迫与热胁迫的信号途径中存在多个调控元件。本研究中通过干旱胁迫和热胁迫的水稻芯片分析,发现OsDGD 表达受耐热和干旱胁迫调控,且在N22 中多个OsDGD 对干旱胁迫更敏感。通过实时定量PCR 分析,发现在分化至6 ~7 期的水稻幼穗剑叶中,5个OsDGD 同源基因在日本晴、9311 和耐热品种N22 中的表达有差异,OsDGD3和OsDGD4 的表达量均高,OsDGD1 和OsDGD5的表达量均低,而OsDGD2 在日本晴及9311 中的表达量较低,在N22 中的表达量高。随高温处理时间的增加,在日本晴中,5个OsDGD 基因的表达量无明显变化;在9311 中,5个OsDGD 基因的表达量均下降,而在耐热水稻品种N22中,除OsDGD5外,其余4个基因的表达量较其他2 种水稻材料的高, OsDGD1、OsDGD2 和OsDGD3 在N22 中的表达明显受到热胁迫的诱导。试验结果与生物芯片分析结果基本相吻合,进一步表明OsDGD 参与了对水稻耐热性的调控。
综合分析,认为OsDGD 与水稻耐热具有相关性,是一个潜在的水稻耐热调控元件。水稻的耐热表型与多种环境因子密切相关,植物响应光、温信号基因表达调控网络的分子遗传机制至今仍不清楚,因此,挖掘新的水稻耐热分子传导途径对全面认识植物耐热分子调控网络具有重要意义。
[1] Peng S,Huang J,Sheehy J E,et al.Rice yields decline with higher night temperature fromglobal warming[J]. Proc Natl Acad Sci,2004,101:9971–9975.
[2] Grover A,Chandramouli A,Agarwal S,et al.Transgenic Rice for Tolerance Against Abiotic Stresses[M].Rice Improvement in the Genomic Era.New York:Datta S K,2009:237–267.
[3] Satake T,Yoshida S.High temperature induced sterility in indica rices at flowering[J].Jpn J Crop Sci,1978,47:6–17.
[4] 邓化冰,史建成,肖应辉,等.开花期低温胁迫对水稻剑叶保护酶活性和膜透性的影响[J].湖南农业大学学报:自然科学版,2011,37(5):581–585.
[5] Chen J,Burke J J,Xin Z,et al.Characterization of the Arabidopsis thermosensitive mutant atts02 reveals an important role forgalactolipids in thermotolerance[J]. Plant Cell Environ,2006,29(7):1437–1448.
[6] Dörmann P,Hoffmann-Benning S,BalboⅠ,et al. Isolation and characterization of an Arabidopsis mutant deficient in the thylakoid lipid digalactosyl diacylglycerol [J].The Plant cell,1995,7(11):1801–1810.
[7] Kelly A A,Froehlich J E,Dörmann P.Disruption of the two digalactosyldiacylglycerol synthasegenes DGD1 and DGD2 in Arabidopsis reveals the existence of an additional enzyme ofgalactolipidsynthesis[J].Plant Cell,2003,15(11):2694–2706.
[8] Jagadish S V K,Craufurd P Q,Wheeler T R. Phenotyping parents of mapping populations of rice for heat tolerance during anthesis[J].Crop Sci,2008,48:1140–1146.
[9] 雷东阳,旷浩源,陈立云.利用基因芯片研究植物非生物逆境响应基因表达的进展[J].湖南农业大学学报:自然科学版,2012,38(2):156–161.
[10] Livak K J,Schmittgen T D.Analysis of relativegene expres sion data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402–408.
[11] Klau Essemine J,Govindachary S,Ammar S,et al. Functional aspects of the photosynthetic light reactions in heat stressed Arabidopsis deficient in digalactosyldia- cylglycerol[J].Plant Physiol,2011,168(13):1526–1533.
[12] Sashka Boychova Krumova,Sergey Petrovich Laptenok,Laszlo Kovacs Tunde Toth,et al.Digalactosyl– diacylglycerol-dificiency lowers the thermal stability of thylakoid membranes[J].Photosynthesis Res,2010,105(3):229–242.
[13] 穰中文,周清明.耐热水稻品种Nagina 22高温胁迫下的生理响应[J].植物遗传资源学报,2012,13(6):1045–1049.
[14] Li Xia,Lovely M F Lawas,Richard Malo,et al.Metabolic and transcriptomicsignatures of rice floral organs reveal sugar starvation as a factor in reproductive failure under heat and drought stress[J].Plant Cell Environ,2015,doi:10.1111/ pce.12545.
[15] Deepti Nigam,Sanjeev Kumar,Mishra D C.Synergistic regulatory networks mediated by microRNAs and transcription factors under drought,heat and salt stresses in Oryza sativa spp.[J].Gene,2015,555(2):127–139.
