利用生物酶降解烟草果胶的研究
2015-07-15朱晓兰刘百战王维妙高芸
朱晓兰,刘百战,王维妙,高芸
(1.中国科学技术大学烟草与健康研究中心,安徽 合肥230052;2.上海烟草集团有限责任公司烟草行业卷烟烟气重点实验室,上海200082)
果胶是植物细胞壁所特有的组分,属于多糖类碳氢化合物[1]。过多的果胶质影响烟叶的弹性和韧性[2],造成干烟叶糙碎。果胶因亲水力强,易使烟叶过度吸湿,造成烟叶的工业可用性和贮藏的安全性降低。果胶发酵生成多达1% ~1.5%的乙酸,乙酸有辛辣和刺激味[3]。果胶质在燃吸过程中产生甲醇,甲醇再进一步氧化为甲醛、甲酸,不仅使烟气具有刺激性,而且不利于吸烟的安全性;较高的果胶质含量还会导致卷烟焦油量升高[4],因此,对于烟草吸味品质来说,果胶是一种不利的化学成分。
有研究表明,在烟草加工过程中,向烟叶中添加一定量的生物酶,能促使部分细胞壁物质降解为水溶性糖,使得烟叶刺激性杂气有所降低,从而改善烟叶品质[5–6]。于建军等[7]用果胶酶处理烟叶,烟叶果胶质含量降低,香气物质总量提高了29.94%。巩效伟等[8]利用果胶酶处理烟梗后,细胞壁类物质含量降低,还原糖含量升高,中性致香成分总量明显提高。笔者利用果胶甲酯酶、果胶裂解酶、多聚半乳糖醛酸酶、纤维素复合酶4 种生物酶处理烟叶,部分细胞壁物质发生了降解,采用13C NMR 光谱法研究了降解后果胶的含量和结构(甲酯度、乙酰度及中性糖比例)的变化,并结合烟叶致香成分的分析,试图从果胶的精细结构上把握果胶的降解,为提高烟叶品质和使用价值提供理论依据。
1 材料与方法
1.1 材料
云南清香型烟叶C3F,取自安徽中烟工业公司,烟样于40℃烘箱中干燥4 h后,粉碎备用。
果胶甲酯酶(PE)、多聚半乳糖醛酸酶(PG)、果胶裂解酶(PNL)和纤维素复合酶(CE),活性为20 000 U/g,购自南京添嘉生物科技有限公司。聚半乳糖醛酸(PGA,99.5%)和四甲基硅烷(98.5%)购自上海百灵威化学品公司;山梨醇内标和中性糖标样购自上海试剂二厂。
主要仪器:AVANCE AV 400 spectrometer超导傅立叶数字化核磁共振谱仪(瑞士布鲁克公司);Trace ISQ 气相色谱–质谱联用仪(美国Thermo Fisher公司,配DB–5MS毛细管色谱柱);同时蒸馏萃取装置(中国科学技术大学玻璃仪器厂定制);S7500超声波发生器(广东必能信超声有限公司)。
1.2 方法
将PE、PG、PNL和CE用50℃的蒸馏水溶解,配制成5、10、20g/L的单酶液,现配现用。
将云南烤烟C3F烟叶回潮后切丝,每份50g。将质量浓度为5、10、20g/L的酶溶液50mL,装入小型喷雾器,均匀喷洒于烟丝上。将烟丝装入2层用水湿润过的食品包装袋中,密封,置于调温调湿箱中(温度50℃,相对湿度25%)贮存4 h,用于酶解。酶解结束后,迅速将烟丝放入80℃烘箱中,保持20min,使酶在高温条件下完全失活。以不加酶的蒸馏水作为对照,每个处理重复3次。酶解后的烟丝40℃烘干,研磨成粉末,用于测定果胶含量及结构、纤维素、木质素、常规化学成分和中性致香成分。
烟叶中的纤维素、半纤维素和木质素含量按照YC/T347—2010 的方法测定。果胶的提取、含量及结构的测定按文献[9]方法进行。
按YC/T159—2002、YC/T160—2002、YC/T161— 2002、YC/T162—2002、YC/T217—2007 测定烟叶中总糖、总植物碱、总氮、氯离子、钾离子的含量。
按照文献[10]方法,采用同时蒸馏萃取和GC/MS 测定烟叶中性致香物质含量。参照文献[13]和[11]方法进行果胶中性糖的水解和衍生化分析。
2 结果与分析
2.1 酶处理对烟叶细胞壁类物质含量的影响
表1列出了4种酶处理后,烟叶中纤维素和木质素含量、果胶含量及结构的变化。与对照相比,酶处理后的烟叶样品果胶、纤维素和木质素含量均降低;随着酶浓度的增大,烟叶中细胞壁类物质的含量呈下降趋势,当酶质量浓度高于10g/L后,下降趋缓。果胶酶处理后,烟叶果胶含量降幅较大,降低率为4.6% ~17.8%,纤维素含量降低了0.87% ~ 6.7%,木质素降低了2.1% ~9.5%。纤维素酶处理后,烟叶果胶含量降低了1.5% ~4.1%,纤维素含量降低了3.9% ~12.6%,木质素降低了4.9% ~8.6%。纤维素酶是复合酶,在直接降解纤维素,促进纤维素、半纤维素分解的同时,可促进植物细胞壁的溶解,酶处理后烟叶细胞壁受到一定程度的破坏,提高了烟叶中果胶酶和木质素酶与细胞壁物质的作用效果[12]。果胶甲酯酶和果胶裂解酶处理后,烟样果胶的甲酯度显著降低;多聚半乳糖醛酸酶处理后,烟叶果胶的甲酯度略有增大;纤维素复合酶处理后,烟叶果胶结构变化不明显,这主要与不同酶作用的底物不同[13]有关。果胶甲酯酶促进果胶酸酯脱酯降解生成果胶酸,果胶裂解酶也能够降解高度甲酯化的果胶,因而使果胶的甲酯度降低更明显。多聚半乳糖醛酸酶促进聚半乳糖醛酸降解为单糖或寡糖,使得果胶酯的比例增大,因此酯化度增大。烟叶样品中果胶的乙酰度本身含量较低,酶处理后也有下降的趋势。
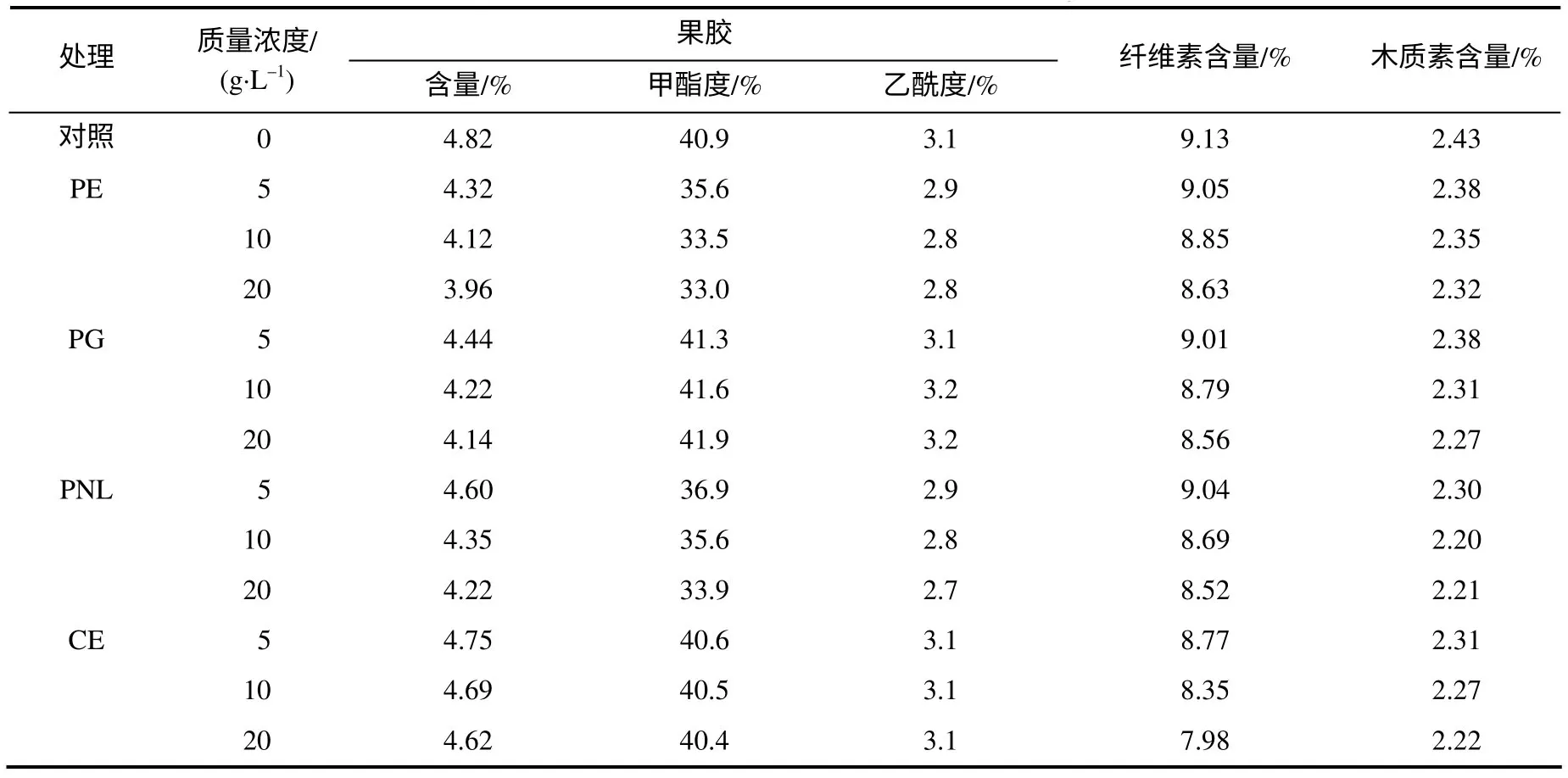
表1 酶处理后烟叶纤维素和木质素含量及果胶的甲酯度和乙酰度 Table 1 Contents of cellulose and lignin and degrees of methylation and acetylation of pectin in tobacco treated with enzymes
2.2 酶处理对烟叶常规化学成分的影响
从表2 中可以看出,与对照相比,酶处理后,烟叶总糖含量增加,且随酶浓度的增加而增大。烟碱、钾离子和氯离子含量也有所提高,总氮与对照持平或略有下降。糖含量的升高与细胞壁类物质的降解有关,同时还为美拉德反应提供了反应底物,有利于烟叶的香吃味的形成。糖类物质必须和烟碱、总氮协调,才能使烟气丰满、醇和、吃味甜润、舒适[14],从糖碱比、糖氮比和氮碱比来看,酶浓度适中(10g/L)时,处理后的烟叶总糖含量明显提高,但仍能保持化学成分的协调性[15],有利于提高烟叶的使用价值。
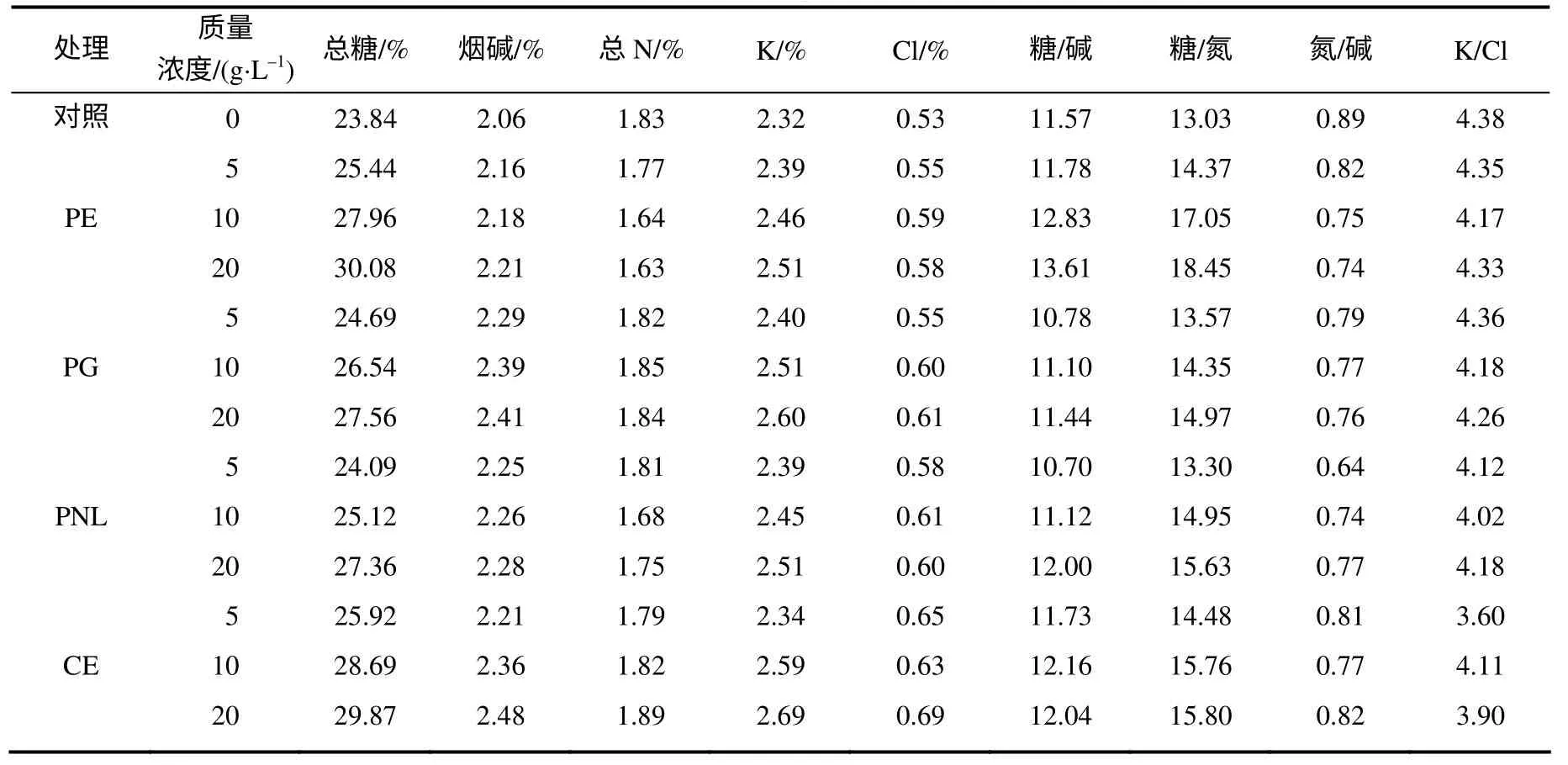
表2 酶处理后烟叶的常规化学成分含量 Table 2 Contents of routine chemical components in tobacco treated with enzymes
2.3 酶处理对果胶中性糖的影响
果胶有3 种结构,HG、RG–Ⅰ和RG–Ⅱ型,主要由以半乳糖醛酸为基本结构的平滑区和带有大量中性糖支链的半乳糖醛酸和鼠李糖交替连接的毛发区组成[16],在没有酶催化的情况下,果胶的中性糖支链和一些聚合物的糖苷联接在提取过程中有轻微的水解,糖醛酸之间和糖醛酸与鼠李糖之间的联接是最稳定的[17]。表3 结果显示,经酶处理后,果胶的中性糖的含量均比对照高。果胶甲酯酶处理的中性糖增加最多,其次是多聚半乳糖醛酸酶处理,纤维素复合酶处理也使果胶中性糖含量(尤其是葡萄糖)增加。
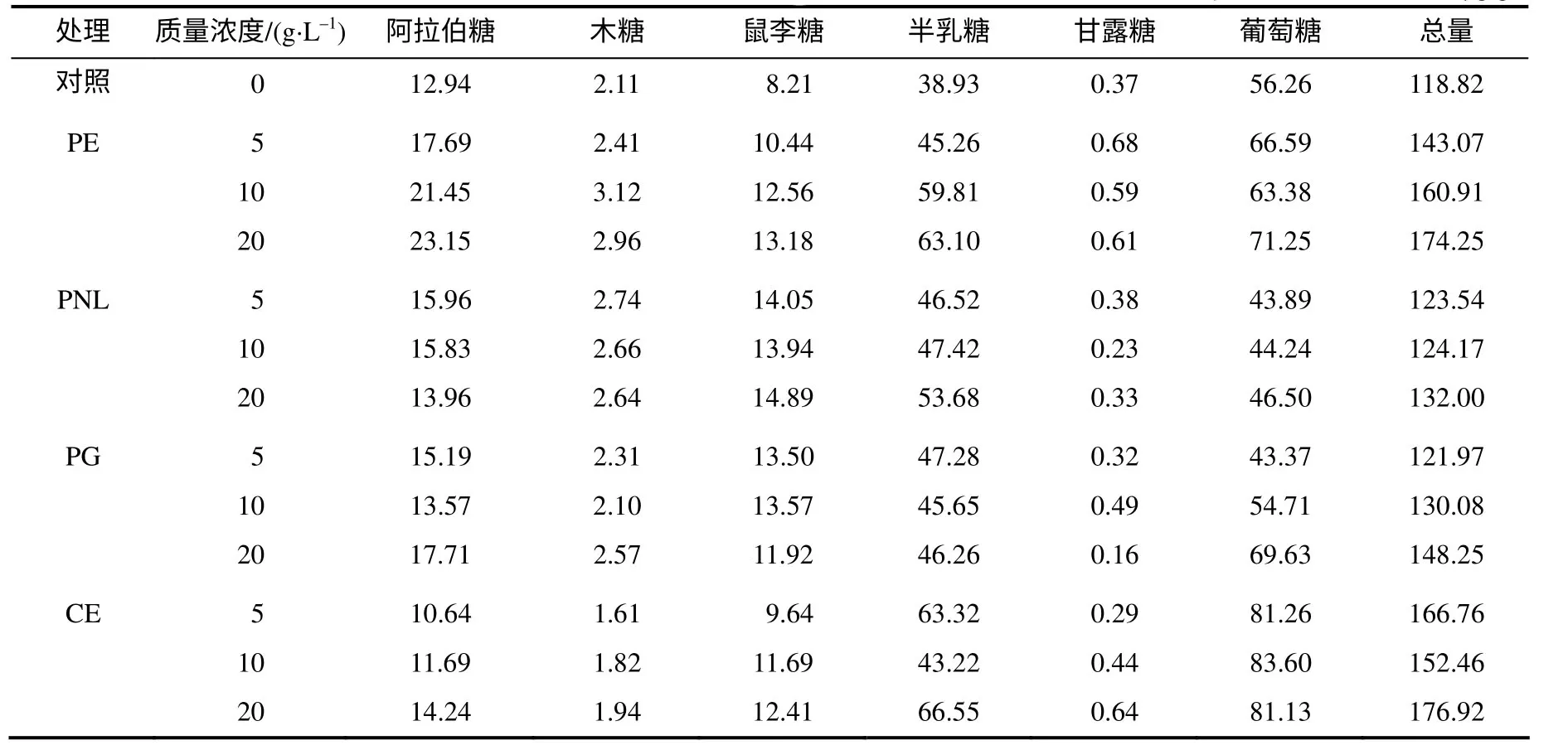
表3 酶处理后烟叶的果胶中性糖含量 Table 3 Neutral sugar contents in pectin from tobacco treated with enzymes μg/g
图1为不同酶处理后烟叶果胶样品的中性糖比例。与对照相比,3种果胶酶处理,阿拉伯糖和半乳糖比例明显增加,尤其是果胶甲酯酶和果胶裂解酶处理后样品。因为果胶酶的底物分子是聚半乳糖醛酸和果胶酯,更多的是促进主链断链, RG–Ⅰ型结构会相对增大[16],因此,阿拉伯糖、鼠李糖和半乳糖比例会增大。而纤维素酶不具备专一的底物催化效应,虽然也使细胞壁类物质含量下降,但不能对果胶中性糖比例产生类似效果,反而会使葡萄糖比例增大。

图1 不同酶处理烟草中酸提取果胶中性糖的比例 Fig.1 Ratios of neutral sugars in acid extracted pectin from tobacco treated with enzymes
2.4 酶处理对中性致香物质含量的影响
2.4.1 对苯丙氨酸转化产物含量的影响
从表4可以看出,与对照相比,经过酶处理的烟叶的苯丙氨酸转化产物含量均有不同程度的提高,以质量浓度为20g/L的果胶裂解酶处理增加幅度最大,为56.0%,苯甲醇和苯乙醛的含量分别增加了60.4%和64.1%。
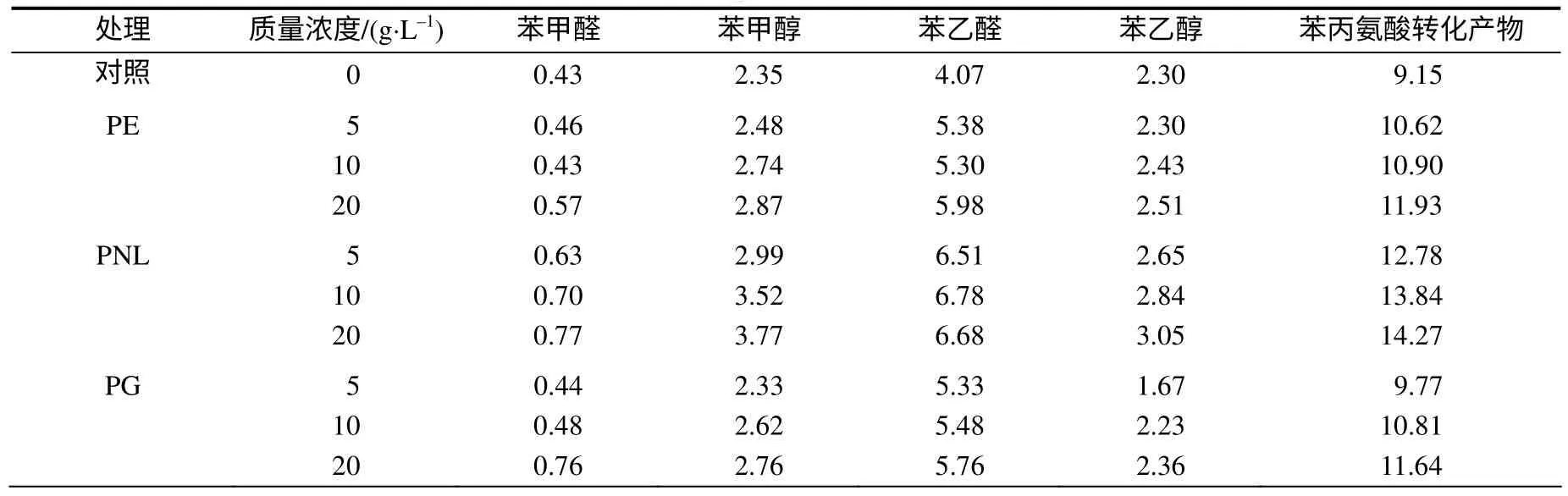
表4 酶处理后烟叶苯丙氨酸转化产物的含量 Table 4 Contents of phenylalanine degradation products in tobacco treated with enzymes μg/g

表4 (续) μg/g
2.4.2 对棕色化反应产物含量的影响
由表5看出,经过酶处理的烟叶,棕色化反应产物(主要是糠醛和糠醇)均有明显提高,其中以纤维素复合酶和多聚半乳糖醛酸酶处理增幅较大,在酶质量浓度为20g/L时增幅分别为43.3%和35.6%,果胶甲酯酶和果胶裂解酶处理样品的棕色化反应产物糠醛增幅较小。
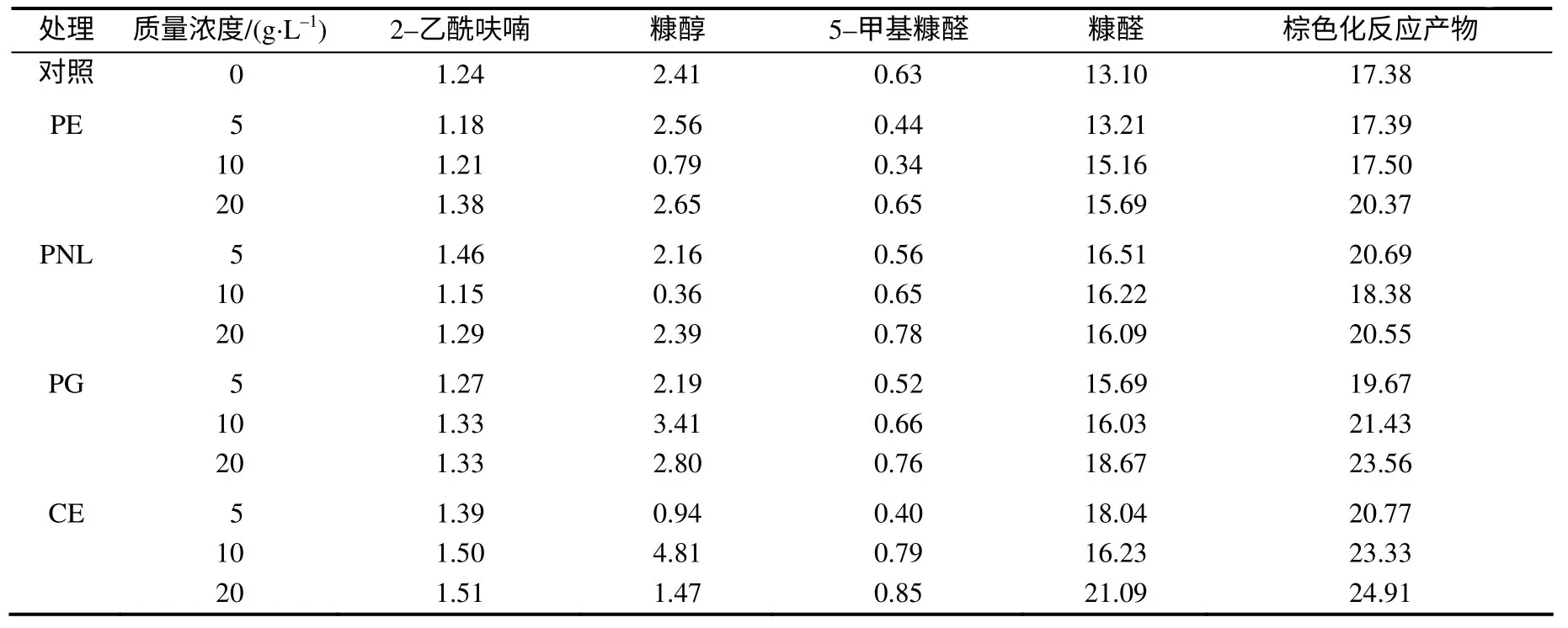
表5 酶处理后烟叶棕色化反应产物的含量 Table 5 Content of maillard reaction products in tobacco treated with enzymes μg/g
2.4.3 对类胡萝卜素降解产物含量的影响
从表6看出,酶处理后,大部分类胡萝卜素降解产物比对照有所提高,尤其是β–大马酮、β–二氢大马酮和香叶基丙酮含量提高较多。多聚半乳糖醛酸酶和果胶甲酯酶处理,烟叶的类胡萝卜素降解产物总含量与对照相近,而果胶裂解酶和纤维素复合酶处理的样品明显增加,在酶质量浓度为20g/L时,增幅分别为21.4%和16.9%。

表6 酶处理后烟叶类胡萝卜素降解产物的含量 Table 6 Content of carotenoid degradation products in tobacco treated with enzymes μg/g
2.4.4 对新植二烯含量和中性致香物质总量的影响
结果显示,多聚半乳糖醛酸酶和果胶甲酯酶处理的样品的新植二烯含量分别为84.79和87.53μg/g与对照(90.93μg/g)相比略有降低,果胶裂解酶处理样品的新植二烯含量(96.56μg/g)略有增加,纤维素复合酶处理样品的新植二烯含量与对照相比有较大增加,在酶质量浓度为20g/L时增幅为56.4%,说明纤维素酶处理比果胶酶处理更能增加烟叶的新植二烯含量。
对中性致香物质总量(不含新植二烯)的分析表明,与对照(87.57μg/g)相比,多聚半乳糖醛酸酶和果胶甲酯酶处理样含量(分别为94.89和89.99μg/g)略有增加,而果胶裂解酶和纤维素复合酶处理烟叶含量比对照有较大幅度提高,在酶浓度为20g/L时增幅分别为24.4%和21.9%。
3 结论
采用13C NMR光谱法研究4种酶制剂降解烟叶后果胶含量及结构变化,结果表明:添加果胶酶或纤维素酶都可以有效降解烟叶中的果胶、纤维素和木质素。不同种类酶对果胶的结构变化的影响有所不同,果胶甲酯酶和果胶裂解酶处理样品均使果胶的甲酯度降低,多聚半乳糖醛酸酶处理后,果胶的甲酯度略有增大,纤维素复合酶处理变化不明显。酶处理后果胶中性糖的含量均比对照样有所增加,其中果胶甲酯酶处理增加最大,但不同种类酶处理的中性糖比例有区别,果胶酶处理后阿拉伯糖和半乳糖比例明显增加,而纤维素酶处理后葡萄糖比例增加较多。
对中性致香物质的分析表明,所有酶处理均使苯丙氨酸转化产物和棕色化反应产物含量呈增加趋势,但类胡萝卜素降解产物和新植二烯含量经多聚半乳糖醛酸酶和果胶甲酯酶处理略有降低或持平,而果胶裂解酶和纤维素酶处理后则呈增加趋势,其中性香气物质总量(不含新植二烯)分别提高了24.4%和21.9%。据任晓红等[2]报道,烟叶中果胶的含量与中性香气物质和一些香气前体物质含量呈负相关,本试验中酶处理使烟叶果胶含量下降,中性致香物质的总含量增加,与任晓红等的研究结论相一致。
[1] Ha M A,Vietor R J,Jardine G D,et al.Conformation and mobility of the arabinan andgalactanside-chains of pectin[J].Phychemistry,2005,66(15):1817–1824.
[ 2] 任晓红,陈刚,马海燕,等.烤烟细胞壁物质对烟叶质量影响研究[J].中国农学通报,2010,26(4):113–116.
[3] Georgiev Y,Ognyanov M,Yanakieva I,et al.Isolation,characterization and modification of citrus pectins[J].J BioScience Biotechnology,2012,1(3):223–233.
[4] 饶巍,庹苏行,钟科军,等.烟草果胶的提取分析研究进展[J].广州化学,2009,34(1):71–76.
[5] Husson E,Buchoux S,Avondo C,et al.Enzymatic hydrolysis of ionic liquid-pretreated celluloses :Contribution of CP–MAS 13C NMR and SEM[J]. Bioresource Technology,2011,102(15):7335–7342.
[6] 肖瑞云,林凯.不同复合酶对烟梗化学成分和感官评吸的影响[J].江西农业学报,2010,22(10):70–72.
[7] 于建军,马海燕,杨寒文,等.利用果胶酶降解烟叶中果胶的研究[J].江西农业学报,2009,21(3):136–138.
[8] 巩效伟,陈兴,申晓锋,等.利用果胶酶改善烟梗内在品质的研究[J].安徽农业科学,2013,41(15):6889–6891.
[9] Zhu X,Liu B,Zheng S,et al.Quantitative and structure analysis of pectin in tobacco by13C CP/MAS NMR spectroscopy [J].Anal Methods,2014,6(8):6407–6413.
[10] Peng F,Sheng L,Liu B,et al.Comparison of different extraction methods:Steam distillation,simultaneous distillation and extraction and headspace co-distillation,used for the analysis of the volatile components in aged flue-cured tobacco leaves[J].Journal of Chromatography A,2004,1040(1):1–17.
[11] 杜启云,何海娟.卷烟中非挥发性有机酸、糖类、某些氨基酸和磷酸的同时测定[J].烟草科技,2007(7):30–35.
[12] Mori T,Chikayama,E,TsuboiY,et al.Exploring the conformational space of amorphous cellulose using NMR chemical shifts[J].Carbohydrate Polymers,2012,90:1197–1203.
[13] 李立恒,谢达平,兰时乐.环状芽孢杆菌A6 产生的果胶酶和木聚糖酶分离纯化及酶学性质[J].湖南农业大学学报:自然科学版,2007,33(6):667–671.
[14] 杨丽丽,邓小华,邓井青,等.湘南稻田浓香型烤烟适宜采收成熟度研究[J].湖南农业大学学报:自然科学版,2014,40(3):236–240.
[15] 李国栋,马海燕,于建军,等.纤维素酶降解烟叶中纤维素的作用效果[J].中国农学通报,2008,24(12):256–259.
[16] Willats W G T,Knox J P,Mikkelsen J D.Pectin:New insights into an old polymer are starting togel[J].Trends in Food Science & Technology,2006,17(3):97–104.
[17] Garna H,Mabon N,Wathelet B,et al.New method for a two step hydrolysis and chromatographic analysis of pectin neutral sugar chains [J].Journal of Agricultural and Food Chemistry,2004,52(15):4652–4659.
