巨球百合无菌播种影响因素的研究
2015-07-13马怡迪李岳李丹青任梓铭夏宜平
马怡迪,李岳,李丹青,任梓铭,夏宜平
(浙江大学农业与生物技术学院,浙江 杭州 310058)
巨球百合(Lilium brownii F. E. Brown ex Miellez var.giganteum) 是野百合(L. brownii)的变种。野百合鳞茎直径2 ~4.5 cm,而巨球百合在野生状态下鳞茎直径可达10 ~12 cm,鳞片100 余枚,花冠淡黄色,通常有5 ~8 朵花,因其鳞茎特大,富含矿质元素硒,花多而美丽,可供药用、食用及观赏,是百合育种的优良基因材料,具有较高的开发利用价值[1–2]。
无菌播种获得组培苗是一种有效的保存珍稀植物的方法,成功的离体组织培养能够在短时间内获得大批量的植物材料[3]。有关光照、温度等因子对百合属种子萌发的影响已有较多报道[4–11],而有关种子无菌播种的研究主要集中在兰科植物[12–18],百合属植物此方面的研究报道较少。吴昀等[19]、崔祺等[20]和向地英等[21]经研究得出了药百合(L. speciosum Thunb. var.gloriosoides Baker)、淡黄花百合(L. sulphureum Baker)和百合杂交种子无菌播种的最适培养基配方。杜方等[22]认为巨球百合与野百合的聚类很近。百合属植物种子无菌播种已有报道,说明其种子无菌播种可行性强。巨球百合鳞茎资源珍稀,不易获得种球,属需保护的稀有野生种质资源,因此,其种子无菌播种的研究具有理论和实践意义。
本试验以巨球百合种子为材料,比较不同激素配比的培养基对种子萌发的影响,旨在找出巨球百合种子萌发的最适激素配比,为保护巨球百合野生种质资源,加快无性繁殖提供依据。
1 材料与方法
1.1 材料
供试材料为2014年8月下旬于浙江省温州市海岛采集的已成熟野生巨球百合蒴果。选择饱满、胚清晰(胚长≥1/2 种长)的种子为试验材料(图1)。种子千粒重为4.689g。
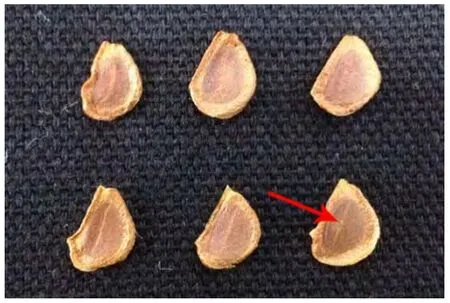
图1 巨球百合种子 Fig. 1 Seeds of L. brownie F. E. Brown ex Miellez var.giganteum
试验所用基本培养基均为MS 培养基,并添加9 种不同配比的6–BA 及NAA,以不添加任何激素的MS 培养基(空白培养基)为对照,培养基的pH 值为5.9。培养基在121℃灭菌20min。具体配方见表1。
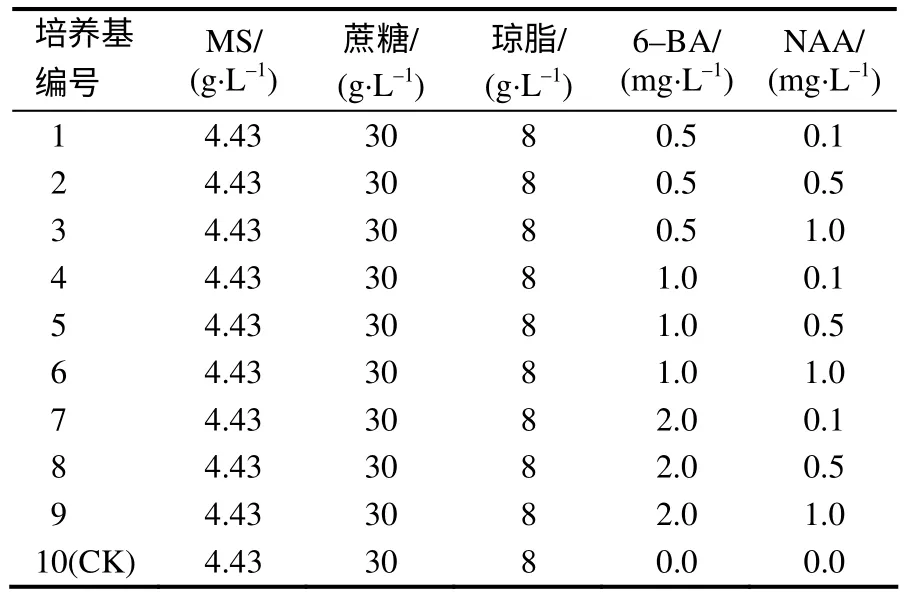
表1 培养基配方 Table 1 The formula of different culture mediums
1.2 方法
试验于2014年9月至2015年2月在浙江大学观赏植物生长发育与分子生物学实验室进行。无菌培养室光照度约2 000 lx,每天光照14 h,温度(25±2 )℃。试验参考吴昀等[19]的药百合种子无菌播种的方法进行。将种子置于添加吐温–20 及洗洁精各1 ~2 滴的水溶液中浸泡 30min,去除浮起的干瘪种子,流水下冲洗 2 h,75%乙醇消毒30 s,2% NaClO 振荡处理6min,无菌重蒸水冲洗5 ~6次,放滤纸上吸干水分。将经过处理的种子平均分成2份:1 份作剥皮处理;另一份种子不剥皮。之后,分别接种于10个培养基(表1)上,每个处理接种10粒种子,重复4次。
1.3 观察与统计方法
种子接种试验开始后每天观察1次,记录种子开始萌发时间,之后每隔3 d 观察和统计1次。接种至第45天时统计萌发率、诱导率及诱导芽数等,并于第45天时将萌发种子转入含空白培养基的柱形瓶中,每瓶转接5 粒,在柱形瓶中生长45 d 后统计小鳞茎数,测量小鳞茎宽度及小鳞茎高度等指标,其中,种子萌发以胚根和幼芽突破种皮为准[23]。
萌发率=(发芽种子数/总接种种子数)×100%;
诱导率=(诱导出芽的种子数/总接种种子数)× 100%;
诱导芽数=诱导芽总数/分化芽的种子数。
1.4 数据处理
采用Microsoft Excel 2007和IBM SPSS 20对数据进行方差分析和因素内多重比较。
2 结果与分析
2.1 剥皮处理对巨球百合种子萌发的影响
无菌播种45 d 时统计的萌发率(表2)表明,10个不同培养基处理中有8个剥皮处理种子的开始萌发时间早于不剥皮处理;8个剥皮处理种子高峰期延续时间均短于不剥皮处理种子;9个不剥皮处理种子的萌发率在70.0%以上,不同编号培养基之间差异不显著,而10个剥皮处理种子的萌发率均在77%以上,且大部分剥皮处理种子的萌发率略高于不剥皮处理。综合来看,剥皮处理较不剥皮处理更有利于巨球百合种子的萌发。

表2 不同培养基与种子剥皮与否对种子萌发的影响 Table 2 Effects of different culture mediums and peeling treatments onseedgermination
2.2 不同激素配比对剥皮种子萌发的影响
剥皮处理种子生长45 d 时,1 号和6 号培养基上的种子的萌发率均达到100%(表3),显著高于3、5、9、10 号培养基处理;1 号培养基上的种子诱导率达90.0%,显著高于2、3、5、6、7、8、9 号培养基处理,且其茎和根也较长,生长势良好(图2);对诱导芽数而言,不同编号培养基之间并无显著差异。综合分析,1 号培养基激素配比更有利于巨球百合种子的萌发。
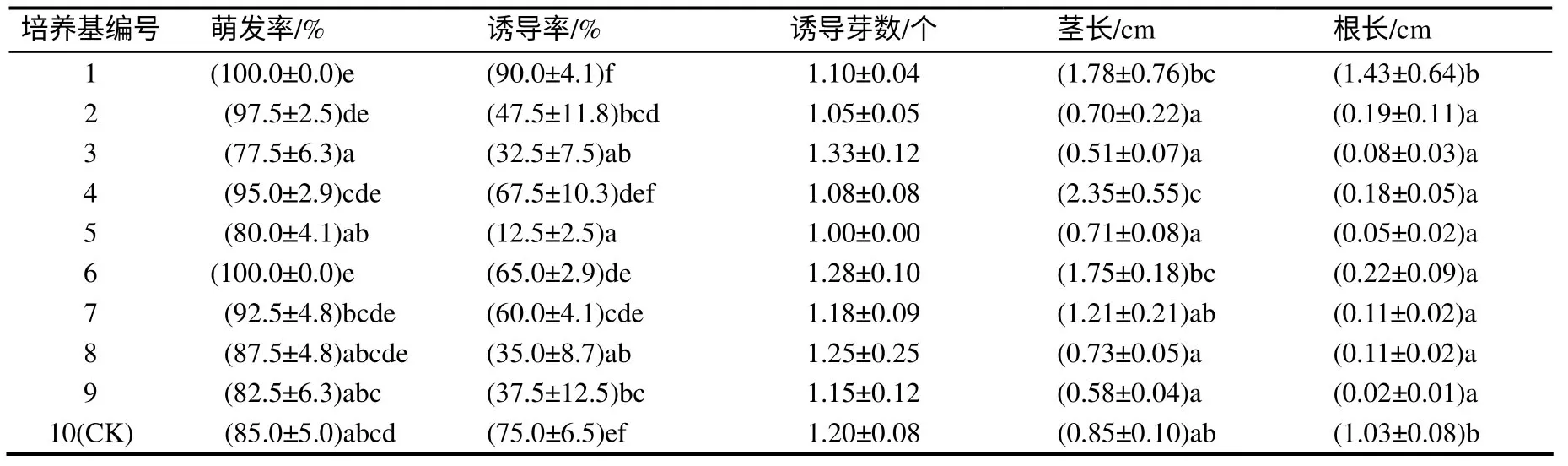
表3 不同培养基对剥皮种子萌发的影响 Table 3 Effects of different culture mediumson thegermination of seeds with peeling treatment

图2 不同培养基上生长45 d 的巨球百合种子(剥皮处理) Fig.2 Seeds(with peeling treatment)after 45 days'growthon different culture mediums
2.3 萌发种子转入MS 培养基后生长45 d 的情况
从表4 和图3 可知,不同编号培养基上的萌发种子转入MS 培养基生长45 d 后,在小鳞茎数、小鳞茎高度、小鳞茎宽度、叶片数以及生根数等指标上表现出了差异,其中3 号培养基上的小鳞茎个数较多(图4),平均达3.57个,显著高于其他处理,2、6 和8 号培养基上的小鳞茎个数亦较多,显著高于对照。

表4 萌发种子转接后生长45 d 的各项生长指标 Table 4 Thegrowth ofgermination seeds after transferred to MS basal medium for 45 days

图3 萌发种子转接后生长45 d 的观察结果 Fig. 3 Thegrowth ofgermination seeds after transferred to MS basal medium for 45 days

图4 3 号培养基上的种子转入MS 培养基45 d 后获得的丛生小鳞茎 Fig.4 Clumping bulblets from seeds in No.3 Medium after transferred to MS basal medium for 45 days
3 结论与讨论
百合属种子具有坚厚的种皮,会对种子萌发形成较大的机械阻碍,使其不能吸收足够水分,导致生长停滞、萎缩甚至死亡[19,24]。有研究[19–20,24–25]表明,通过预冷、预热处理擦破种皮,或直接剥除种皮,可以显著提高种子的萌发速度和萌发率,本试验结果与其结论接近。孙叶等[18]发现,利用NaClO 溶液预处理兰花杂交种子,能明显提高其萌发率。在本试验中,采用NaClO 溶液振荡处理巨球百合种子,既能对种子进行消毒,又能腐蚀种皮,同时溶解一些种皮内含有的酸性抑制物,且在实际操作中,延长无菌水冲洗时间,可一定程度软化种皮,去除种皮表层的蜡质和油脂,增强皮透性,减轻剥皮处理难度,提高萌发率[18–19]。
吴昀等[19]得出药百合种子无菌播种最适培养基为MS+1.0mg/L 6–BA + 0.1mg/L NAA;向地英等[21]和周晓杰等[25]均认为MS+1.0mg/L 6–BA +0.01mg/L NAA 为百合杂交种子无菌播种的最适培养基。综合考虑各因素,巨球百合种子萌发的最适培养基为MS+1.0mg/L 6–BA+ 1.0mg/L NAA。此培养基培养巨球百合种子,种子萌发率为100.0%,诱导率为65.0%,平均诱导不定芽1.28个,转入MS 培养基生长45 d 后,平均形成小鳞茎2.35个,平均生成3.6片叶,生根6.7 条,萌发种子转接后的各项生长指标均优于1 号培养基,且植株生长比1 号培养基的植株健壮,说明1.0mg/L 6–BA 的培养基较适合百合属种子萌发,这与前人的研究结果相符。当细胞分裂素与生长素的比值高时,6–BA 和NAA 的不同配比可诱导芽的分化;比值低时,则促进根的生成[26]。从吴昀等[19]、向地英等[21]、周晓杰等[25]和本试验结果来看,最适培养基中的细胞分裂素与生长素的比值均较高,所对应的诱导芽数也较多,充分印证了这一观点。
[1] 李根有,陈征海,颜福彬.产于浙江温岭的百合属一新变种——巨球百合[J].浙江林学院学报,2007(6):767–768.
[2] 吴昀,徐康,张琳,等.巨球百合鳞茎营养成分分析[J].营养学报,2014(1):102–104.
[3] Chang C,Chen C T,Tsai Y C,et al.A tissue culture protocol for propagation of a rare plant Liliumspeciosum Thunb.var.gloriosoides Baker[J].Bot Bull Acad Sin,2000,41(2):139–142.
[4] 管康林.论种子的需光性[J].浙江林学院学报,1989(1):71–82.
[5] 伍丹,周兰英.光照和温度对大百合种子萌发的影响[J].中国野生植物资源,2007(2):52–54.
[6] 杨炜茹,张启翔.岷江百合种子萌发的研究[J].种子,2008(11):5–7.
[7] 金淑梅,杨利平,张月学.百合种子萌发影响因素的探讨[J].北方园艺,2008(6):117–118.
[8] 方晶.光照、温度等因子对卷丹百合种子萌发特性的影响[J].北方园艺,2011(4):91–92.
[9] 杨利平,宋满珍,张晶.光照和温度对百合属6 种植物种子萌发的影响[J].植物资源与环境学报,2000(4):14–18.
[10] 曾宋君,陈之林,吴坤林,等.兜兰无菌播种和组织培养研究进展[J].园艺学报,2007(3):793–796.
[11] Urbaniec-Kiepura M,Bach A.Effect of pre-storage on Liliummartagon L.seed longevity following cryopre- servation[J].Cryoletters,2014,35(6):462–472.
[12] 王芬,徐步青,刘幸佳,等.春兰种子无菌播种萌发过程及其影响因素[J].浙江农林大学学报,2013(1):136–140.
[13] 周辉明,林辉锋,尚伟,等.垂花蕙兰种子无菌播种和快速繁殖[J].福建农业学报,2013(10):981–986.
[14] 郑君爽,宁惠娟,吕慧,等.国兰与大花蕙兰杂交育种及无菌播种研究进展[J].中国农学通报,2011(4):81–84.
[15] 姚丽娟,徐晓薇,林绍生,等.蝴蝶兰无菌播种技术[J].北方园艺,2004(4):82–83.
[16] 余慧琳,胡月华,朱一仪.蝴蝶兰种子无菌播种诱导增殖原球茎试验研究[J].北方园艺,2009(4):188–190.
[17] 俞继英,郑勇平,王春,等.蝴蝶兰无菌播种与组织培养研究进展[J].林业科技开发,2010(3):5–10.
[18] 孙叶,包建忠,刘春贵,等.影响春兰、蕙兰杂交种子无菌萌发的若干因素[J].江苏农业科学,2010(2):187–188.
[19] 吴昀,马怡迪,张琳,等.药百合种子萌发及染色体倍性检测[J].中国农学通报,2013(13):153–157.
[20] 崔祺,贾桂霞.3 种百合组培快繁体系的优化[J].湖南农业大学学报:自然科学版,2014,40(6):621–626.
[21] 向地英,陈思,王丽霞.百合杂交种子无菌播种育苗技术研究[J].安徽农业科学,2007(24):7461.
[22] 杜方.百合不同器官转录组分析及SSR 标记开发应用[D].杭州:浙江大学,2014.
[23] 管康林.种子的休眠与萌发[J].热带植物研究,1981(18):39–51.
[24] 李雪,杜捷,陈丽梅,等.克得利亚百合种子萌发及鳞茎生长的研究[J].西北师范大学学报:自然科学版,2004,40(2):69–71.
[25] 周晓杰,樊金萍,龚束芳,等.百合远缘杂交种子快繁方法的研究[J].作物杂志,2009(3):110–113.
[26] 刘庆昌,吴国良.植物细胞组织培养[M].北京:中国农业大学出版社,2003.
