菜籽粕固态发酵产纳豆激酶条件的优化
2015-07-13廖杰琼陈力力杨伊磊青文哲康汝罄
廖杰琼,陈力力,*,杨伊磊,,青文哲,康汝罄
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.食品科学与技术湖南省重点实验室,湖南 长沙 410128)
菜籽粕是油菜籽榨油后的副产物,含有丰富的粗蛋白、粗纤维、脂肪、维生素及矿物质等营养成分,但由于含有硫代葡萄糖甙等有毒物质,其营养价值一直没有得到很好的利用,仅以很小比例的添加量作为反刍动物和淡水鱼养殖的饲料或用作肥料[1–5]。利用纳豆芽孢杆菌发酵菜籽粕,能有效分解菜籽粕中的抗营养因子,得到纳豆激酶。纳豆激酶具有较强的纤溶活性,能直接作用于纤溶蛋白,也能激活体内纤溶酶原。与其他溶栓类药物相比,纳豆激酶具有安全性好、成本低、纤溶活性强、可口服、作用时间长等优点,有望被开发为新一代的口服抗血栓药物[6–7]。固态发酵是微生物在没有或基本没有游离水的固态基质上进行发酵的方式。与液态发酵相比,固态发酵具有基质简单、来源广泛、投资少、技术简单和产物产率高等优点[8–10],更适合于工业化生产。笔者以菜籽粕和麸皮为原料,研究微生物固态发酵方式产纳豆激酶的条件,旨在为利用菜籽粕大规模生产纳豆激酶提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种及培养基
菜籽粕由湖南农业大学食品科学与技术湖南省重点试验室用水酶法提取油菜籽油后的副产物加工而成(将其干燥、粉碎,过孔径450 µm 的不锈钢筛);麸皮从饲料公司购得。纳豆芽孢杆菌U49(Bacillus nattoU49)由湖南农业大学食品科学与技术湖南省重点实验室选育。菌种培养基为LB固体培养基和LB 液体培养基;基础发酵培养基以菜籽粕和麸皮按一定比例配制而成。
1.1.2 主要仪器与试剂
主要仪器为722N 可见分光光度计(上海菁华科技仪器有限公司)、SW–CJ–2D 双人单面(垂直)净化工作台(江苏通净净化设备有限公司)、ZHWY– C2102 恒温培养箱(上海新苗医疗器械制造有限公司)和TP–620A 电子天平(湘仪天平仪器设备有限公司)。
主要试剂凝血酶购自中国药品生物制品检定所;尿激酶由丽珠药业生产;纤维蛋白原为Sigma产品;其余试剂均为国产、分析纯。
1.2 方法
1.2.1 菌种的活化与种子液制备
从纳豆芽孢杆菌U49 保藏斜面中取一环菌苔接种于LB 斜面培养基中,在37℃生化培养箱中培养36 h 进行活化,随后挑取一环活化的菌种接入装有30mL LB 肉汤培养基的250mL 三角瓶中,摇匀后在37℃生化培养箱中培养18 h,备用。
1.2.2 初始产酶培养基及培养条件的确定
以菜籽粕和麸皮为基本原料(按质量比7∶3 混合),基本原料中葡萄糖、尿素、氯化钙的添加浓度分别为0.55、0.40、0.35g/(100g),初始物料比为95g/(100g),接种量为10g/(100g),装瓶量为10%(采用300mL 三角瓶),于pH 7.0、37℃下培养48 h。
1.2.3 单因素试验
在1.2.2 的基础上,分别以接种量、种龄、发酵温度、发酵时间、装瓶量、初始物料比、初始pH为自变量,在不同条件下进行固态发酵培养,以纳豆激酶酶活力为考核指标进行单因素试验。
1.2.4 纳豆激酶酶活力的测定
收集适宜发酵条件下获得的发酵产物,用生理盐水浸提,离心,收集上清液(上清液即为粗酶液),采用纤维蛋白平板法[11–12]测定纳豆激酶酶活力。
1.2.5 Plackett–Burman 试验
在前期培养基组成优化试验的基础上,选用N–11 的Plackett–Burman 试验设计,即以产纳豆激酶酶活力为响应值,对接种量、种龄、发酵温度、发酵时间、装瓶量、初始物料比、初始pH 值等7个因素的重要性进行考察,另外取4个虚拟因素,每1个因素取–1 和+12个水平。
1.2.6 最陡爬坡试验
根据Plackett–Burman 试验结果,以各显著因素的正、负效应确定最陡爬坡试验[13–15]的变化方向和变化步长,逼近最大响应区域,找到下一步响应面试验的中心点,进行最陡爬坡试验设计。
1.2.7 响应面试验
综合爬坡试验结果确定重要影响因素的取值区间,根据Box–Behnken 中心组成设计原理[16–20],设计三因素三水平(Design Expert 8.0.3)的三元二次响应面分析试验,以优化固态发酵条件。
1.2.8 数据处理
用Excel 2007 对数据进行处理。采用Design– Expert 8.0.3 软件分析Plackett–Burman 试验、最陡爬坡试验及响应面试验的结果。
2 结果与分析
2.1 单因素试验结果
在1.2.2 条件下发酵后的酶活力为3 935.07 IU/g。根据单因素试验结果选取的产酶各因素的最佳点见表1 中的–1 水平,即最佳接种量为8g/(100g),种龄为18 h,发酵温度为37℃,发酵时间为96 h,装瓶量为6.67%,初始物料比为90g/(100g),初始pH 为7。

表1 Plackett–Burman试验设计的因素和水平 Table 1 Factors and levels of Plackett–Burman design
2.2 主效因素的筛选结果
以纳豆激酶酶活力为响应值,N–11 的Plackett– Burman 试验设计及其结果见表2。对表2 进行回归分析的结果见表3。
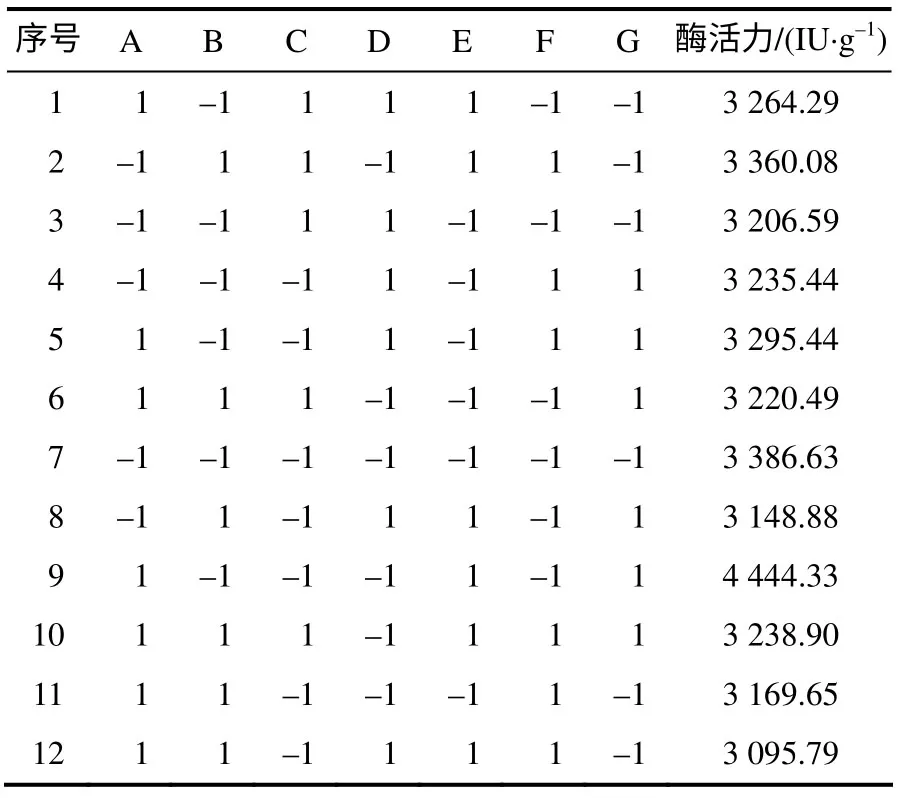
表2 Plackett–Burman试验设计及结果 Table 2 Schemes and their results of Plackett–Burman design

表3 Plackett–Burman试验各因素及其影响效果 Table 3 Significance analysis of Plackett–Burman design
由表3 可知,发酵温度、初始物料比、发酵时间、接种量、种龄、初始pH 值、装瓶量对产纳豆激酶的影响依次减小。由模型贡献率可知,对产酶影响最大的3个因素为发酵温度、初始物料比和发酵时间,其贡献率分别为59.99、24.05 和5.56,其余因素对结果影响不大,所以,将这3个因素作为最陡爬坡试验的主效因素,根据各因素的效应值确定变化步长,逼近最大响应区域。
2.3 最陡爬坡试验结果
由于表3中3个主效因素的效应度均为负值,因此,最陡爬坡试验各主效因素水平的取值范围都应以单因素的水平为起点,向逐渐减小方向设计5个水平(表4)。由表4可见,第2组试验的纳豆激酶酶活力最大(5 408.34 IU/g),所以,选取该组试验的3个因素为中心组合试验的中心点。
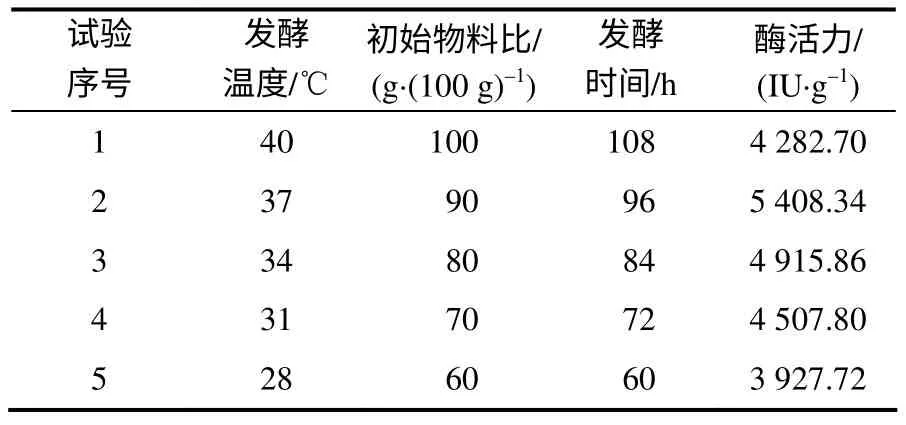
表4 最陡爬坡试验设计及其结果 Table 4 Designs and their results of the steepest ascent experiment
2.4 发酵条件的响应面优化结果
根据最陡爬坡试验的结果,以纳豆激酶酶活力为响应值,以对纳豆激酶产量有显著影响的因素(发酵温度、初始物料比、发酵时间)为自变量设计中心优化组合试验的因素编码及水平见表5。中心组合试验结果见表6。

表5 中心组合试验设计的因素和水平 Table 5 Levels and factors of response surface analysis

表6 Box–Behnken试验设计及试验结果 Table 6 Design matrix and their results of Box–Behnken experiment
利用Design Expert 8.0.3对上述试验结果进行二次回归拟合的方程为Y= –72 088.954 25+ 2 791.705 89X1+ 219.570 66X2+ 387.128 39X3–1.009 75 X1X2+ 3.803 30X1X3+ 0.314 73X2X3–42.413 54X12– 1.177 18X22–2.975 90X32。式中,Y为纳豆激酶酶活力的预测值;X1、X2、X3分别代表发酵温度、初始物料比、发酵时间的编码值。
由表7三元二次响应面模型的方差分析结果可以看出,模型的F=10.72,该回归方程的决定系数R2=0.932 3,P=0.002 5<0.01,模型的回归项极显著,但失拟项不显著,表明该模型在被研究的回归区域与实际情况的拟合度良好,失拟较小,预测值和实测值之间具有高度相关性,可用于对纳豆芽孢杆菌固态发酵菜籽粕产纳豆激酶进行预测。

表7 二阶回归方程的方差分析结果 Table 7 Variance analysis for the second order regression equation
由图1~3可见,过高或过低的初始物料比、发酵时间和发酵温度均不利于酶活力的提高。发酵温度对酶活力的影响最明显。运用Design Expert 软件对模型进行分析,得到纳豆芽孢杆菌固态发酵产纳豆激酶的最佳发酵条件为发酵温度36℃,初始物料比90.24g/(100g),发酵时间92.82 h。在此条件下,纳豆激酶酶活力预测值为6 031.33 IU/g。
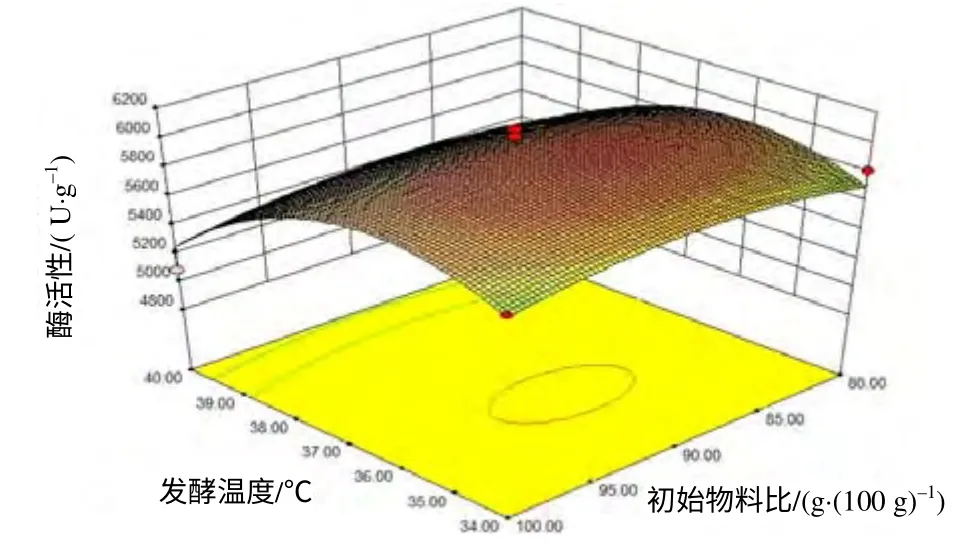
图1 不同发酵温度和初始物料比条件下产纳豆激酶的酶活力 Fig.1 Activity of Natto-kinase at various conditions of fermentation temperature and ratio of initial Materials
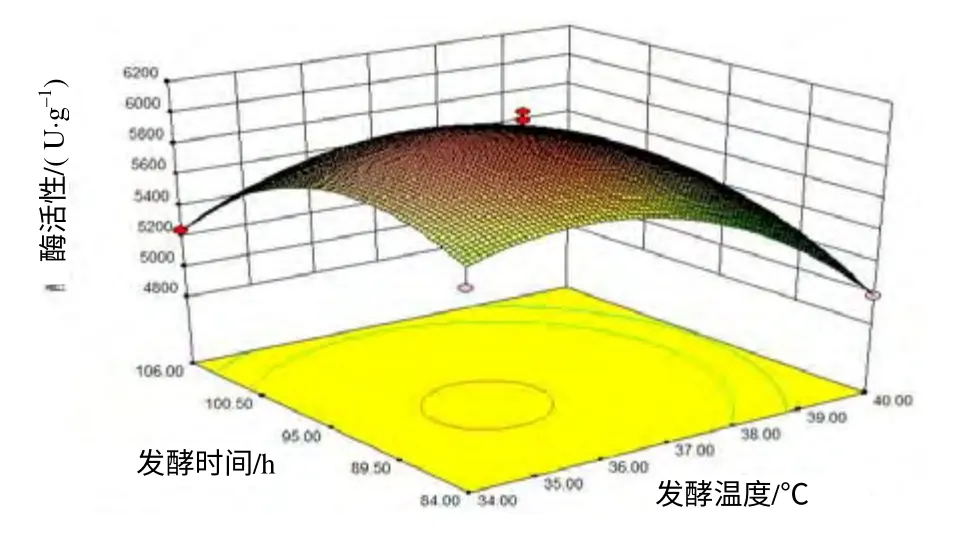
图2 不同发酵温度和发酵时间条件下产纳豆激酶的酶活力 Fig.2 Activity of Natto-kinase at various conditions of fermentation temperature and time

图3 不同发酵时间和初始物料比条件下产纳豆激酶的酶活力 Fig.3 Activity of Natto-kinase at various conditions of fermentation time and ratio of initial materials
3 结论
采用响应面法对纳豆芽孢杆菌固态发酵产纳豆激酶的发酵条件进行优化,得出了产纳豆激酶的最佳发酵条件为发酵温度36℃,初始物料比90.24g/(100g),发酵时间92.82 h。在此条件下以菜籽粕和麸皮为基础培养基(按质量比7∶3混合),按0.55、0.40、0.35g/(100g)添加葡萄糖、尿素、氯化钙,于初始pH 7.0,接种量8g/(100g)发酵培养纳豆芽孢杆菌,所产纳豆激酶的酶活力达6 031.33 IU/g,比优化前提高了1.55倍。
发酵温度、发酵时间和初始物料比对酶活力的影响依次减小。在一定范围内,随初始物料比、发酵时间和温度的增加,纳豆激酶酶活力增加。
[1] 顾斌,马海乐,刘斌.菜籽粕混菌固态发酵制备多肽饲料的研究[J].中国粮油学报,2011,26(1):83–87.
[2] 岳隆耀,谯仕彦.菜籽粕营养价值总结[J].蛋白饲料新研究,2009(3):13–16.
[3] 杨玉芬,孟洪莉,张力.发酵温度和水分对菜籽粕发酵品质的影响[J].中国农学通报,2010,26(8):52–55.
[4] 鞠兴荣,何海艳,何荣,等.固态发酵生产菜籽肽及其清除自由基能力的研究[J].食品科学,2009,30(19):259–262.
[5] Guggenbuhl P,Waché Y,SimoesNunes C,et al.Effects of a 6-phytase on the apparent ileal digestibility ofminerals and amino acids in ileorectal anastomosed pigs fed on a corn-soybean meal-barley diet[J].Journal of Animal Science,2012,90(sup.4):182–184.
[6] 宁树成,赵丽娜,张岸平,等.纳豆激酶研究进展[J].华北煤炭医学院学报,2006,8(5):632–633.
[7] 迟东升,阮新民.新型溶栓剂——纳豆激酶[J].心血管病学进展,2007,28(4):545–550.
[8] Sheng J,Chi Z,Yan K,et al.Use of response surface methodology for optimizing process parameters for high inulinase production by the marine yeast Cryptococcus aureus G7a in solid state fermentation and hydrolysis of inulin[J].Bioprocess and Biosystems Engineering,2009,32(3):333–339.
[9] 胡永娜,李爱科,王之盛,等.微生物固态发酵菜籽粕营养特性的研究[J].中国粮油学报,2012,27(3):76–80.
[10] 郭海勇,王波,乔继伟,等.纳豆激酶固体发酵条件优化[J].吉林师范大学学报,2008(2):66–68.
[11] 姚露燕,张水华,曹昱,等.金属离子浓度对枯草芽孢杆菌芽孢率的影响[J].现代食品科技,2008,24(8):770–772.
[12] 魏华,赵祥颖,刘建军.纳豆激酶的活性测定[J].山东轻工业学院学报,2007,2l(1):60–63.
[13] 李欣,黄昌伟.响应面法优化杆菌肽发酵培养基[J].河北化工,2011(2):17–19.
[14] 张鹏为,储消和,郭美锦,等.响应面设计优化盐霉素发酵条件[J].中国抗生素杂志,2010,35(2):96–99.
[15] 陈晓萍,孙付保,陈晓旭,等.响应面法优化康宁木霉产纤维素酶固态发酵培养基[J].食品与生物技术学报,2011(1):106–112.
[16] Guo N,Gong F,Chi Z,et al.Enhanced inulinase production in solid state fermentation by a mutant of the marine yeast Pichiaguilliermondii using surface response methodology and inulin hydrolysis[J] . Journal of Industrial Microbiology and Biotechnology,2009,36:499–507.
[17] 胡博涵,吴晖,赖富饶,等.农家风味剁辣椒发酵工艺的优化[J].湖南农业大学学报:自然科学版,2014,40(1):110–114.
[18] 宇光海,尹艳丽,张垚.响应面法优化达托霉素发酵培养基的研究[J].化学与生物工程,2012,29(10):40–44.
[19] 陈浩,谭忠元,冯昆达,等.响应面法优化康宁木霉产纤维素酶的发酵培养基[J].酿酒技术,2011(11):45–48.
[20] 杨俊换,郭华,欧阳晶.用响应面法优化油茶籽壳发酵产羧甲基纤维素酶的条件[J].湖南农业大学学报:自然科学版,2014,40(4):416–419.
