致乏库蚊体内菌群结构分析
2015-07-13吴滟辉王晓君
吴滟辉,王晓君
(1.湖南农业大学附属医院,湖南 长沙 410128,2.湖南农业大学分析测试中心,湖南 长沙 410128)
致乏蚊虫[1–2]是尖音库蚊的一个亚种,在中国广泛分布于上海、江苏、安徽、河南、陕西、西藏等地区,其幼虫在脏污的水中生长,发育成蛹、蚊。雄蚊吸食花粉、花蜜和植物汁液;雌蚊叮咬人畜,吸食血液,并传播班氏丝虫病、流行性乙型脑炎等疫病,至于能否传播其他疾病,目前尚缺少这方面的研究。为了准确评估致乏蚊虫的公共卫生意义,笔者利用PCR–DGGE技术对致乏库蚊雌成虫的带菌情况进行了分析,现将结果报道如下。
1 材料与方法
1.1 材料
致乏库蚊采自湖南农业大学校园(经形态学和分子生物学鉴定认定为致乏库蚊)。标本保存于湖南农业大学寄生虫教研室。
1.2 主要试剂与仪器
2×EasyTaq PCR SuperMix、2×TransTaq HiFi SuperMix Ⅰ为北京全式金生物技术有限公司产品;细菌基因组DNA提取试剂盒、DNA片段快速纯化/回收试剂盒为北京鼎国昌盛生物技术有限责任公司产品;高纯质粒小提试剂盒为天根生化科技(北京)有限公司产品;EcoRⅠ、XhoⅠ、pMD18–T、E. coli DH5ɑ为宝生物工程(大连)有限公司产品。扩增引物341f(5′–CCTACGGAGGCAGCAG–3′)、907r(5′–CCC CGTCAATTCATTTGAGTTT–3′)、341fGC(5′–CGCC CGCCGCGCGCGGCGGGCGGGGCGGGGGCACG GGGGGCCTACGGAGGCAGCAG–3′)和518r(5′–AT TACCGCGGCTGCTGG–3′)由生工生物工程(上海)股份有限公司合成。
主要仪器:变性梯度凝胶电泳仪系统(JY– TD331,北京君意东方电泳设备有限公司产品); PCR仪(2720 thermal cycler,Applied Biosystems产品);凝胶成像系统(alphamager®EP,Alpha Innotech产品)。
1.3 方法
1.3.1 DNA 的提取
取致乏库蚊雌成虫3只,于75%乙醇浸泡90 s;用无菌水冲洗,于无菌条件下研磨;加无菌生理盐水500.00 µL,200×g离心1min,取上清液。按试剂盒说明书操作,提取细菌基因组DNA。
1.3.2 16S rDNA V3–V5 区的扩增
以341f和907r为引物扩增16S rDNA V3–V5区。扩增体系50 µL:基因组DNA 5.00 µL,上下游引物(10 µmol/L)各2.00 µL,2×EasyTaq PCR SuperMix 25.00 µL,ddH2O 16.00 µL。扩增条件:94℃预变性5min;94℃预变性30 s,61.5℃退火30 s,72℃延伸34 S,32个循环;72℃延伸7min。产物于2%琼脂糖凝胶电泳。
1.3.3 16S rDNA V3 区的扩增
以上述扩增产物为模板,以341fGC和518r为引物扩增16S rDNA V3区。扩增体系50 µL:基因组DNA 1.00 µL,上下游引物(10 µmol/L)各2.00 µL,2×TransTaq HiFi SuperMix 25.00Ⅰ µL,ddH2O 16.00 µL。扩增条件:94℃预变性5min;94℃预变性30 s,66℃退火30 s,72℃延伸12 s,31个循环;72℃延伸10min。产物于2%琼脂糖凝胶电泳。以DNA片段快速纯化/回收试剂盒纯化。
1.3.4 细菌16S rDNA V3 片段变形梯度凝胶电泳
取纯化产物7.00 µL进行DGGE凝胶电泳;电泳条件为60℃、120 V、4 h。EB染色,拍照。
1.3.5 切胶回收、克隆和测序
切取凝胶中清晰、明显的条带,ddH2O洗涤3次,捣碎,加入无菌生理盐水40.00 µL,4℃过夜。12 000×g离心过夜产物5min。
取上清液5 µL,以341f和518r为引物扩增,条件同1.2.3。以DNA片段快速纯化/回收试剂盒回收PCR产物。
取回收产物4.00 µL、pMD18–T载体1 µL、Solution 5.00Ⅰ µL,16℃条件下连接12 h。连接产物转化于E.coli DH5ɑ感受态细胞;涂布于含X–Gal、IPTG和氨苄青霉素的LB固体培养基,37℃振荡培养12 h。挑选单个白色菌落于含Amp的LB液体培养基,37℃振荡培养12 h。
以高纯质粒小提试剂盒提取质粒;取质粒7.00 μL, EcoRⅠ、XhoⅠ各1.00 μL,10×H Buffer 2.00 μL,ddH2O 9.00 μL,37℃酶切1 h;产物于2%琼脂糖凝胶电泳。阳性质粒送生工生物工程(上海)股份有限公司测序。
1.3.6 数据处理
将所测序列与GenBank登录序列Blast进行比对,寻找亲缘关系最为相近的菌种或序列。用Quantity One4.6.2对DGGE图谱进行分析。
2 结果与分析
2.1 细菌基因组DNA 的扩增结果
以341f和907r为引物扩增致乏库蚊雌成虫细菌基因组DNA的产物大小(图1–A)与预计大小一致。以341fGC和518r为引物扩增,获得细菌16S rDNA V3区产物的大小约为180 bp(图1–B),与预计大小相符。

图1 细菌16S rDNA V3–V5区(A)和16S rDNA V3 (B)扩增结果 Fig.1 Amplification fragments of the bacteria 16S rDNA V3–V5 region (A) and V3 region (B)
2.2 16S rDNA V3 区片段的DGGE 电泳结果
对致乏库蚊成蚊携带菌16S rDNA V3区片段进行DGGE的结果见图2–A;以Quantity One绘制DGGE示意图(图2–B)。
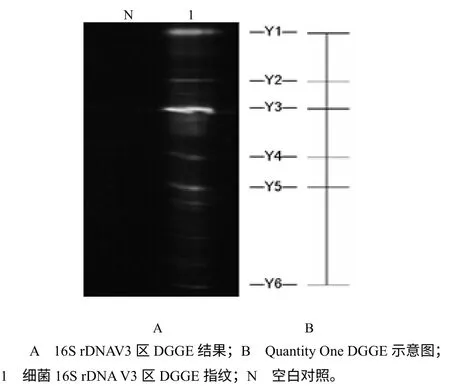
图2 细菌16S rDNAV3 区DGGE 指纹 Fig.2 DGGE profiles of the bacteria 16S rDNA V3 region
由图2可知,DGGE凝胶中较亮的条带共6条,表明有6 种优势菌。6个条带内的DNA 序列与GenBank数据比对的结果(表1)为:1种为派毕梯斯沃巴契亚体(Wolbachia pipientis),另外5种分别与假单胞菌属、埃希氏杆菌属、沃尔巴克氏体属和γ–变形纲、α–变形纲未知种的亲缘关系极近。

表1 DGGE 条带序列分析比对结果 Table 1 Analysis and blast result of the DGGE band sequences
3 结论与讨论
本研究结果表明,致乏库蚊携带的优势菌共6种,其中1种为派毕梯斯沃巴契亚体(Wolbachia pipientis),另外5种尚未被鉴定,分别隶属于假单胞菌属、埃希氏杆菌属、沃尔巴克氏体属和γ–变形纲、α–变形纲某未知种属。
PCR–DGGE技术[3]已广泛应用于环境、食品微生物等诸多领域。2010年,李美等[4]曾利用该技术分析了中华按蚊的中肠菌群结构,并发现短芽孢杆菌、气单胞菌、丛毛单胞菌、金黄杆菌以及γ–变形纲的某未知细菌在中华按蚊中肠内存在。本研究结果与前人的研究结果一致。凌天翼[5]从饲养和野生的致乏库蚊幼虫体内分离出假单胞菌属(Pseudomonas sp.)和埃希氏杆菌属(Escherichia sp.)10株细菌;Demaio等[6]利用定量培养的方法分析不同状态、不同阶段的尖音库蚊Culex pipiens)中肠菌群的变化,认为假单胞菌属和埃希氏杆菌属在尖音库蚊中肠内为优势菌群。Pidiyar等[7]结合传统分离培养与16SrRNA文库鉴定野生致乏库蚊中肠细菌,发现γ–变形纲的细菌占已分离细菌总数的70%以上。Hertig等[8]以尖音库蚊卵巢为研究对象,首次发现Wolbachia pipientis,之后,Wright等[9]证明该菌也存在于伊蚊属。本研究DGGE 图谱中代表Wolbachia 的条带最亮,表明Wolbachia在致乏库蚊体内数量较多,为优势细菌。
环境中存在大量的细菌[10]。为了减少蚊虫体表的细菌污染,本试验中使用了大剂量的75%乙醇和无菌水进行洗涤、稀释,另外DGGE仅能显示优势菌群的V3区条带,故笔者推测本研究中鉴定的6种细菌可能为致乏库蚊雌成蚊体内的优势菌群。
[1] 陆宝麟,李蓓思,姬淑红,等.中国动物志,昆虫纲,第8卷,双翅目:蚊科(上卷)[M].北京:科学出版社,1997.
[2] 陆宝麟,李蓓思,姬淑红,等.中国动物志,昆虫纲,第8卷,双翅目:蚊科(下卷)[M].北京:科学出版社,1997.
[3] 鲍新宇,杨剑,高新艳,等.DGGE 技术的原理及其在动物胃肠道微生态系统研究中的应用[J].畜牧与饲料科学,2011,32(11):25–26.
[4] 李美,汤林华.中华按蚊实验室种群中肠内细菌菌群分析[J].中国寄生虫与寄生虫病杂志,2010,28(2):143–147.
[5] 凌天翼,唐俊杰.致倦库蚊幼虫体内正常菌群的分离和鉴定[J].贵阳医学院学报,1993,18(4):278–281.
[6] Demaio J,Pumpuni C B,Kent M,et al.The midgut bacterial flora of wild aedes triseriatus,culex pipiens,and psorophora columbiae mosquitoes[J].Am J Trop Med Hyg,1996,54(2):219–223.
[7] Pidiyar V J,Jangid K,Patole M S,et al.Studies on cultured and uncultured Microbiota of wild Culex quinquefasciatus mosquito midgut based on 16S ribosomal RNAgene analysis[J].Am J Trop Med Hyg,2004,70(6):597–603.
[8] Hertig M,Wolbach S B. Studies on rickettsia-like micro-organisms in insects[J]. The journal of medical research,1924,44(3):329–374.
[9] Wright J D,Barr A R.The ultrastructure and symbiotic relationships of Wolbachia of mosquitoes of the Aedes scutellarisgroup[J].Journal of Ultrastructure Research,1980,72(1):52–64.
[10] 陈东科,孙长贵.实用临床微生物学检验与图谱[M].北京:人民卫生出版社,2011.
