水稻矮秆多分蘖突变体CA648 的农艺性状分析及分子验证
2015-07-13刘清朱允华陈靓靓李海林b史齐李合松沈革志彭克勤萧浪涛
刘清,朱允华,陈靓靓 ,李海林b,史齐 ,李合松,沈革志,彭克勤,萧浪涛*
(1.湖南农业大学a.植物激素与生长发育湖南省重点实验室;b.农学院,湖南 长沙 410128;2.南华大学药学与生物科学学院,湖南 衡阳421001;3.上海市农业科学院作物研究所,上海 201106)
近年来,“品种设计育种”理念受到了广泛重视,育种工作者希望通过改良水稻的穗、叶、根来获得“理想株型”,以尽可能提高群体的光能利用率和干物质生产能力[1–3]。水稻的分蘖能力能影响有效穗数、穗长、籽粒充实度、每穗籽粒数等性状,而且单位面积内的分蘖数还可影响光照条件,进而改变光能的利用效率[4]。通常只有主茎和早期发生的几个初生和次生分蘖才具备成穗能力,后期的次生分蘖属于无效分蘖。过多的无效分蘖不仅会造成光合产物浪费,还会引起田间环境恶化和病虫害滋生等导致减产[5]。
目前,有关水稻分蘖发育相关基因的研究取得了重要进展,其中,MOC1 参与了叶腋分生组织、分蘖芽的形成和分蘖伸长过程[6];OsTB1 则作为负调节因子控制分蘖芽的伸长[7];HTD 控制分蘖芽形成[8];LAZY1[9]、TAC1[10]、PROG1[11–12]控制分蘖角度;OSH1[13]、DWARF10[14]控制蘖芽萌发;D5 负责调控独脚金内酯信号转导,进而影响分蘖[15–16];OsPIN1 等[17]均直接影响水稻的分蘖。除上述功能基因外,对植物的生长发育具有重要影响的microRNA 也参与水稻分蘖调控,过表达miR156家族的OsMIR156d 和OsMIR156h 导致株高变矮分蘖增多[18],减弱或消除 OsmiR156 对靶基因OsSPL14 的调控作用后可使分蘖数减少,小穗数和穗长增加[19–20]。分蘖的形成是一个复杂的发育过程,与其相关的分蘖数量[21]、分蘖角度[22]、分蘖成穗能力[23]等均为受多基因控制的数量性状。已有的研究还远未阐明分蘖发生的潜在机理,更多水稻分蘖突变体材料的发现及基于这些材料的深入研究将有利于进一步阐明水稻分蘖发生与发育的分子机理。本研究中,以T–DNA 插入突变体库中筛选到的矮秆多分蘖突变体为材料,对其进行了农艺性状调查及分子检测等,以期为克隆该突变体性状相关基因和进一步的功能研究提供依据。
1 材料与方法
1.1 材料
供试水稻材料有粳稻品种中花11(Oryza sativa japonnica L. Zhonghua 11)、多分蘖突变体丛矮648(CA648)。其中,CA648 是由载体pDsBr1300 转化粳稻品种中花11(ZH11)而引起的多分蘖丛生、矮化突变体。突变体的多分蘖特性不受植物生长调节剂处理影响[24]。pDsBr1300 载体的T–DNA 区中携带Ds转座子,Ds 的内部插入Bar 基因,能提供对Basta 除草剂(有效成分为膦丝菌素PPT)的抗性,且在Ds 的旁侧插入潮霉素磷酸转移酶基因Hpt,载体pDsBar1300中T–DNA 区间的物理图谱如图1 所示[25]。
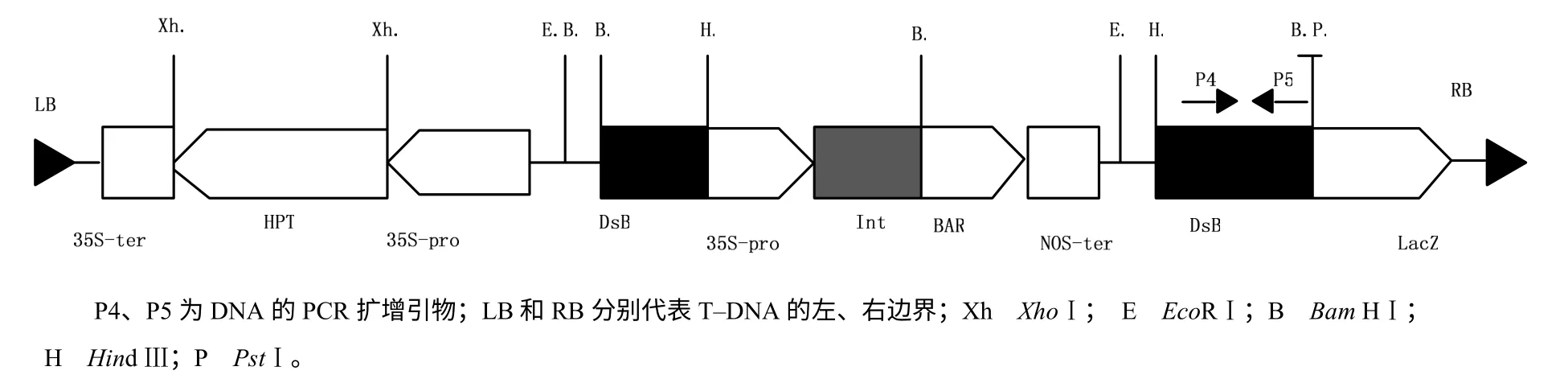
图 1 质粒pDsBar1300 中T–DNA 区的物理图谱 Fig. 1 Physical map of T–DNA region in plasmid pDsBar1300
1.2 方法
1.2.1 农艺性状调查
分别于2006、2008、2009年在湖南农业大学植物激素生长发育重点实验室网室种植突变体CA648、对照ZH11。每种材料种植10 盆,于每年4月中旬播种,5月上旬移栽,常规管理,保持正常生长。于苗期(4 叶期)、分蘖期及成熟期分别进行株高、分蘖数等相关农艺性状调查。
杂交实验在上海农业科学院进行。主要由沈革志研究员带领的课题组完成。2002—2004年,分别在海南、上海两地利用CA648 与ZH11 正反杂交获得不同F1杂交组合,然后将F1自交获得F2群体;对F2群体采用叶片涂抹处理[26],并对Basta 抗性、敏感性分离特性进行分析,并分别统计株高、有效分蘖(有效穗)、千粒重等。
1.2.2 PCR 及TAIL–PCR 分析
以CTAB 法提取的水稻材料叶片的DNA 为模板,分别参考前人方法,以引物P10 (5′–TCCCGTCC GATTTCGACTTTA–3′)和P5 (5′–AAGCTCAAGCT GCTCTAGCATTCG–3′)进行PCR 分析[27];采用TAIL–PCR 法分析T–DNA 插入位点的旁侧序列[28]。回收TAIL–PCR 的第3 轮产物与克隆载体PMD–19–T连接,并采用热激法转化大肠杆菌DH5α,在含氨苄抗生素的LB 固体培养基上长出菌落后,挑选单菌落摇菌扩繁后进行PCR 分析,将阳性菌落提取质粒,送Invitrogen 公司进行测序。
1.2.3 生物信息学分析
测序结果的序列去除载体对应序列后即可获得T–DNA 插入片段的旁侧序列。将所获得水稻基因组上的旁侧序列在网络上不同数据库(http://www.ncbi.nlm.nih.gov/http://rice.plantbiology.msu.edu/index.shtml 等)进行核酸序列匹配,即Blast分析,并针对所获得的高相似性候选基因的序列设计引物,分别与T–DNA 上的引物进行PCR 验证,在确定了插入位点后,分别利用生物信息学方法定位T–DNA 插入的准确位置,并确定候选基因;以候选基因的对应DNA 序列或推测氨基酸序列为模板,利用CLUSTALX 等软件分析候选基因的相关信息。
2 结果与分析
2.1 突变体CA648 的农艺性状分析
盆栽试验结果表明,与野生型ZH11 相比,CA648 表现出株高变矮、多分蘖、叶片变短、变窄等突变性状(图2–A),但在苗期(4 叶期前),CA648的株高、叶片大小等与ZH11 没有明显差别(图2–B)。表1 为苗期与成熟期对两者部分农艺性状的调查结果。虽然苗期株高没有明显差异,但成熟期时CA648 的株高明显低于对照ZH11。分蘖期,两者间的分蘖性状出现较明显差异,CA648 形成分蘖的速度比ZH11 快, CA648 的有效分蘖数比ZH11约多1 倍。虽然CA648 株系产生的空壳秕谷数量远远多于ZH11,但两者间饱满籽粒的千粒重无明显差异。

图2 水稻突变体CA648 与对照ZH11 的形态特征 Fig. 2 Phenotypes of mutant rice CA648 and wild-type ZH11

表1 CA648 和ZH11 的主要农艺性状 Table 1 Comparison of the main agronomic traits between CA648 and ZH11
2.2 突变体CA648 的遗传特性及分子检测
CA648 分别作为父本和母本,与ZH11 配组进行杂交,获得F1材料。以F1材料自交获得F2群体。对F2群体进行农艺性状分离特性分析。由于CA648突变表型的主要特征是株高变矮,分蘖数增多,在进行农艺性状统计调查时植物的株高相对于分蘖数更容易区分差异,因此,本试验中选用株高作为F2群体遗传分析性状。对F2群体株高的调查结果显示,不同单株按株高可依次划分为正常(大于100 cm)、半矮秆(80~90 cm)和矮秆(小于70 cm) 3个类别。不同株高的统计结果如表2 所示。不论CA648为父本或为母本,正反交所获得的F1自交后的F2群体的株高遗传分离特性符合单基因控制的分离规律,即正常单株数与矮化(半矮秆+矮秆)单株数符合1∶3 的比例(两者的χc2均小于3.84),且株高正常、半矮、矮秆的单株数符合1∶2∶1 的比例(CA648/ZH11 的结果170∶352∶169;ZH11/CA648的结果211∶392∶189)。由于CA648 具有对Basta抗性特征,因此,可根据对Basta 抗性或敏感性进行遗传分离特性检测。F2群体对Basta 抗性的检测结果表明,抗性单株与敏感单株数之比分别是170∶(352+169)和211∶(392+189),也符合1∶3 的分离规律(表2)。进一步对F2群体中的株高与抗性进行综合分析,结果显示敏感株系的株高均正常,而抗性水稻材料的株高均为半矮或矮秆(表2)。上述结果表明,CA648 的T–DNA 插入与突变性状是共线性(连锁)关系。

表2 CA648 和ZH11 杂交后的F2 群体的遗传特性 Table 2 Genetic analysis on F2 population obtained by crossing hybrid rice with CA648 and ZH11
以T–DNA 序列设计的引物P10 和P5 分别对CA648 与ZH11 叶片为材料提取的DNA 模板进行PCR 检测,结果显示突变体CA648 中能够扩增出约400 bp 的预期片段,而ZH11 无对应条带(图3A),表明T–DNA 插入了CA648 的基因组中。以地高辛标记的T–DNA 插入序列片段为探针,分别对EcoRⅠ和XbaⅠ酶切后的结果显示,CA648 为单拷贝 T–DNA 插入突变体(数据未给出)。这些试验结果表明,CA648 的突变性状是由T–DNA 插入引起的,且该突变是由单基因突变造成的,因此,该突变体材料是开展分子遗传实验的理想材料。

图3 突变体材料中T–DNA 序列的PCR 结果 Fig. 3 Detecting the sequence of T–DNA by PCR analysis
2.3 T–DNA 插入位点分析
采用TAIL–PCR 方法对CA648 中的T–DNA 插入位点进行分析。分别以5 条随机引物与T–DNA插入序列的Ds 右边界引物配对进行TAIL–PCR 反应,以从CA648 材料提取的DNA 为模板,先后进行3 轮PCR 反应,代号为1#、3#、4#、8#的染色体获得了约300 bp 的产物,其中第2、3 轮反应后的部分产物凝胶电泳结果如图 3 所示。根据TAIL–PCR 实验原理,图4 中第3 轮的PCR 产物条带略小于第2 轮产物大小的仅有1#(T2–1,T3–1)和8#(T2–8,T3–8)。

图4 TAIL–PCR 分析结果 Fig. 4 Results of TAIL–PCR
参照分子实验步骤,将PCR 产物回收后连接到克隆载体并送测序,将测序结果去除载体与T–DNA上对应部分片段后的碱基序列(旁侧序列),在NCBI上进行Blast 分析(http://blast.ncbi.nlm.nih.gov/),得到了一些相匹配水稻 PAC (Plant artificial chromosome)信息,如8#染色体的AP0082414、AP004703、AP004702 等。进一步以旁侧序列在TIGR 数据库(ricegenome annotation project, http://rice.plantbiology.msu.edu/)中搜索,发现序列与8#染色体的Loc_os08g34249.1、Loc_os08g34258.1,2#染色体的 Loc_os02g3150.1,11#染色体的Loc_os11g17790.1,7#染色体的Loc_os7g39630.1 等具有较高的相似性。为进一步确定T–DNA 插入位点,以上述Blast 结果中的相似性高的8#、2#染色体上的可能插入位点附近相关序列分别设计引物,与Ds 上的1 条引物(5’– GAGGTATTTTACCGAC CGTTACCG–3’)进行PCR 验证分析,如能够与Ds序列上的引物扩增出大小相符的特异序列,就表明该区域为T–DNA 插入位点,PCR 验证结果见图5。其中以2#染色体上的引物的扩增没有出现特异条带,而8#染色体上的引物能够与Ds 上的引物配对,从CA648 的DNA 模板上扩增出特异条带,且产物大小与预期相符,表明T–DNA 插在水稻的8#染色体上。
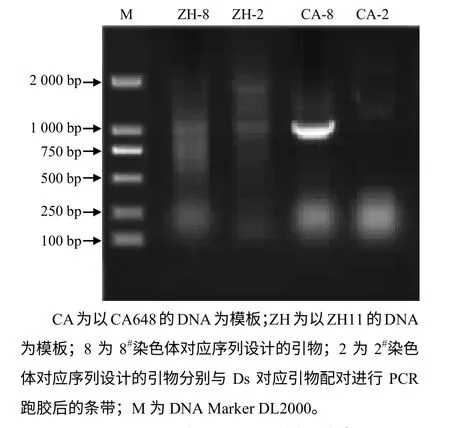
图5 PCR 验证T–DNA 插入位点 Fig. 5 Verifying the T–DNA inserted site by PCR
2.4 T–DNA 插入区间序列相关基因分析
以T–DNA 旁侧序列为索引,将8#染色体上的AP004703,AP004702 对应区间碱基序列在TIGR数据库进行基因功能注释查找。结果表明,T–DNA插入在LOC_Os08g34258 中,该候选基因的功能还未确定,是一个具有推测功能的蛋白,属于抑制蛋白家族(inhibitor I family protein)。将该候选基因序列在NR 蛋白数据库进行Blast 比对检索,相似度高的11个同源蛋白如表3 所示。

表3 候选基因的同源蛋白 Table 3 The homologous proteins of putativegene
使用CLUSTALX 软件对目标序列产物蛋白及上一步所得同源蛋白序列进行多重序列比对,比对结果见图6。候选基因编码的预测蛋白与其他蛋白之间存在相似度很高的保守序列区间,暗示LOC_Os08g34258 基因编码的蛋白产物可能与subtilisin inhibitor家族蛋白具有类似功能。

图6 采用CLUSTALX 软件对候选基因编码的预测蛋白(inhibitor)进行同源蛋白序列多重序列比对的结果 Fig. 6 Multiple sequence alignment of homologous protein sequences of protein (inhibitor) encoded by the putativegene using CLUSTALX program
3 结论与讨论
农杆菌介导T–DNA 插入方法被广泛应用于功能基因组研究。当T–DNA 序列插入到某个具有功能的基因或转录子的编码区或调控区域内时就可能导致突变表型产生。本研究中的T–DNA 插入引起的矮秆多分蘖突变体CA648 与野生型ZH11 相比,两者在苗期表型无明显差异,而进入分蘖期后,CA648 产生的分蘖数远多于ZH11。该突变体的株高受不同生长调节剂处理而显著改变,但其多分蘖特性非常稳定[24]。这些特征表明CA648 基因组中一个可能与分蘖相关的基因受到了T–DNA 插入的影响。
F2群体对株高与Basta 抗性的调查分析结果表明,2 种性状的遗传分离比均接近1∶3,暗示CA648的突变性状是由单基因突变造成的。同时,F2群体中的正常株高株系都对Basta 处理敏感,而具有矮化突变性状的株系(含半矮秆与矮秆)却均表现出抗性,这一结果暗示CA648 的突变性状与T–DNA 插入连锁,即T–DNA 插入造成了CA648 的突变表型。
对于由外源T–DNA 或转座子随机插入产生的突变体材料可通过借助T–DNA 或转座子上的已知序列,利用Inverse–PCR[29]或TAIL–PCR[28]等方法获得与插入位点相对应的旁侧序列。遗传与分子试验表明,CA648 是由单T–DNA 插入引起的突变体,T–DNA 插入在 8#染色体一个功能未知基因LOC_Os08g34258 的内部。进一步的检索分析表明,除在水稻花药中存在与LOC_Os08g34258 的mRNA外,水稻的其他部位(器官)在公共数据库中未检测到其相应的芯片或RNA–seq 数据,暗示该基因所编码蛋白的功能目前还知之甚少,因此,CA648 的突变性状是否是由于LOC_Os08g34258 基因表达紊乱造成的还有待进一步验证。
[1] 袁隆平.超级杂交水稻育种研究的进展[J].中国稻米,2008(1):1–3.
[2] 杨守仁,张龙步,陈温福,等.水稻超高产育种的理论和方法[J].中国水稻科学,1996,10(2):115–120.
[3] Wang F,Cheng F,Zhang G.Difference ingrain yield and quality among tillers in ricegenotypes differing in tillering capacity[J].Rice Science ,2007,14(2):135–140.
[4] 朱满山,符福鸿,黄慧君,等.水稻分蘖成穗率遗传育种研究进展与展望[J].广东农业科学,2006(9):88–91.
[5] 赵祥强,杨学明,王军,等.转基因技术改良水稻株型研究进展[J].江苏农业科学,2005(6):5–8.
[6] Li X,Qian Q,Fu Z,et al.Control of tillering in rice[J].Nature,2003(422):618–621.
[7] Takeda T,Suwa Y,Suzuki M,et al.The OsTB1gene negatively regulates lateral branching in rice[J].Plant Journal ,2003,33(3):513–520.
[8] Zou J,Zhang S,Zhang W,et al.The rice HIGH– TILLERING DWARF1 encoding an ortholog of Arabidopsis MAX3 is required for negative regulation of the outgrowth of axillary buds[J].Plant Journal,2006,48(5):687–696.
[9] Li P,Wang Y,Qian Q,et al.LAZY1 controls rice shootgravitropism through regulating polar auxin transport[J]. Cell Research,2007,17(5):402–410.
[10] Yu B,Lin Z,Li H,et al.TAC1,a major quantitative trait locus controlling tiller angle in rice[J].Plant Journal,2007,52(5):891–898.
[11] Jin J,Huang W,Gao J,et al.Genetic control of rice plant architecture under domestication[J].Nature Genetics,2008,40(11):1365–1369.
[12] Tan L,Li X,Liu F,et al.Control of a key transition from prostrate to erectgrowth in rice domestication[J].Nature Genetics,2008,40(11):1360–1364.
[13] Sato Y,Hong S,Tagiri A,et al.A rice homeoboxgene,OSH1,is expressed before organ differentiation in a specific region during early embryogenesis[J].PNAS,1996,93(15):8117–8122.
[14] Arite T,Iwata H,Ohshima K,et al.DWARF10,an RMS1/MAX4/DAD1 ortholog , controls lateral bud outgrowth in rice[J].Plant Journal,2007,51(6):1019–1029.
[15] Jiang L,Liu X,Xiong G,et al.DWARF 53 acts as a repressor of strigolactone signalling in rice[J].Nature,2013,504:401–405.
[16] Zhou F,Lin Q,Zhu L,et al.D14–SCFD3–dependent degradation of D53 regulates strigolactone signalling[J]. Nature,2013,504:406–610.
[17] Xu M,Zhu L,Shou H,et al.A PIN1 familygene,OsPIN1,involved in auxin-dependent adventitious root emergence and tillering in rice[J].Plant and Cell Physiology,2005,46(10):1674–1681.
[18] Xie K,Wu C,Xiong L.Genomic organization,differential expression,and interaction of SQUAMOSA promoter-binding-like transcription factors and microRNA156 in rice[J].Plant Physiology,2006,142(1):280–293.
[19] Miura K,Ikeda M,Matsubara A,et al.OsSPL14 promotes panicle branching and highergrain productivity in rice[J].Nature Genetics,2010,42(6):545–549.
[20] Jiao Y,Wang Y,Xue D,et al.Regulation of OsSPL14 by OsmiR156 defines ideal plant architecture in rice[J].Nature Genetics,2010,42(6):541–544.
[21] 孙佩,才宏伟,卫晓轶.水稻最高分蘖数和有效分蘖数的QTL 分析[J].河南农业科学,2014,43(3):12–15.
[22] 赵春芳,周丽慧,于新,等.基于CSSL 的高密度物理图谱定位水稻分蘖角度 QTL[J].植物学报,2012,47(6):594–601.
[23] 梁永书,李艳萍,孙海波,等.籼粳交组合培矮64S/日本晴F2、F3及F6代主要农艺性状分析[J].植物学通报,2008,25(1):59–66.
[24] 刘清,童建华,史齐,等.一个矮秆多分蘖水稻突变体的植物激素动态特性分析[J].中国农业科学,2014,47(13):2519–2528.
[25] 王江,李琳,宛新杉,等.插入玉米Ds 转座因子的水稻转化群体及其分子分析[J].植物生理学报,2000,26(6),501–506.
[26] 陈游,程世军,王江,等.检测转基因水稻中PPT 抗性表达的快速简便方法[J].植物生理学通讯,2000,36(1):50–52.
[27] 刘芳,张向前,张泽民,等.水稻Ac/Ds 系统的Ds转座行为[J].科学通报,2007,52(14):1649–1655.
[28] Liu Y G,Chen Y.High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences[J].BioTechniques,2007,43(5):649–656.
[29] Ochman H,Gerber A S,Hart D L.Genetic applications of an inverse polymerase chain reaction [J].Genetics,1988,120(3):621–623.
