高效液相色谱法测定芒草60Co γ 辐照降解副产物
2015-07-13李夏洁李清明苏小军熊冬梅胡秋龙熊兴耀
李夏洁,李清明,*,苏小军,熊冬梅,胡秋龙,熊兴耀
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.湖南省作物种质创新与资源利用重点实验室,湖南 长沙410128;3.中国农业科学院蔬菜花卉研究所,北京 100081)
芒草是禾本科多年生草本植物,适应性强,产 量高[1],在中国资源丰富,是一种优良的制取燃料乙醇的木质纤维素原料。中国在《生物质能源“十二·五”规划》中把木质纤维素制取燃料乙醇的研究作为重点项目[2]。木质纤维素是由纤维素、半纤维素和木质素紧密结合构成的,它很难被纤维素酶水解成单糖而发酵成乙醇,因此,在酶解木质纤维素原料前通常要经过预处理来打破它的结构。预处理是在高温、高压和辐射或强酸、强碱等条件下进行的,因此,原料在结构被打破的同时还会发生一些降解作用,从而产生一些不可用于制取乙醇的降解副产物。这些副产物有的对后续酶解、菌种发酵有抑制作用,有的具有可利用价值,如香草醛可用作化妆香精和治疗癫痫病,对香豆酸对金黄色葡萄球菌、痢疾杆菌、大肠杆菌及绿脓杆菌等均有不同程度的抑制作用,等等,因此,定性、定量检测木质纤维素预处理后的降解副产物对后续酶解、菌种发酵的脱毒以及副产物的有效利用等具有重要意义。
木质纤维素降解副产物主要包括酚类化合物、呋喃类化合物和有机酸[3–4]等3 大类。原料不同,所用的预处理方法也不同,所产生的抑制物种类及含量也不一样[4–5]。经60Co γ 辐照预处理芒草中含量较高且对后续酶解、发酵有抑制作用的降解副产物较多,主要包括香草醛、香草酸、对羟基苯甲酸、4–羟基苯甲醛、对香豆酸、丁香酸等6 种酚类化合物和糠醛等呋喃类化合物以及甲酸、乙酸等有机酸[6]。不同类型副产物的化学性质不同,用高效液相色谱法对其进行检测的检测条件也不一致,要同时检测出这几种不同类型的物质,常需要对检测条件进行摸索。虽然已有关于糠醛[7]、酚类化合物[8–9]、有机酸[10–11]高效液相检测的研究,但关于同时定量检测出这些目标化合物的方法尚未见报道。笔者探寻芒草经60Co γ 辐照后的主要降解副产物的高效液相色谱定量检测方法,并用建立的方法测定 1 200 kGy60Co γ 辐照芒草中各目标化合物的含量,现将结果报道如下。
1 材料与方法
1.1 材料
芒草采自湖南农业大学教学科研基地。
1.2 主要试剂与仪器
主要试剂:甲醇和乙腈(色谱纯,CNM 公司);浓盐酸、乙酸乙酯和无水硫酸镁(分析纯,国药集团化学试剂有限公司);磷酸(分析纯,金华大化学试剂有限公司);磷酸氢二铵(分析纯,西陇化工股份有限公司)。水为超纯水。
标准品:香草酸(纯度98%,国药集团化学试剂有限公司);丁香酸和对香豆酸(纯度98%,西亚试剂公司);对羟基苯甲酸和4–羟基苯甲醛(化学纯,国药集团化学试剂有限公司);香草醛、糠醛、甲酸和乙酸(分析纯,国药集团化学试剂有限公司)。
主要仪器:中草药粉碎机(广州华凯机电设备有限公司);BS224S 型电子天平(北京赛多利斯仪器有限公司);Agilent 1260 Infinity 液相色谱仪(配有紫外可变波长检测器VWD、Agilent 化学工作站和150 mm×4.6 mm,5 μm ZORBAX SB–C18柱,美国Agilent公司)。
1.3 试验条件的确定
1.3.1 标准溶液的配制
准确称取上述9 种标准品,用5%的乙腈–水溶液(用磷酸调pH 至2.7)分别配制如下单标准溶液作为贮备液:质量浓度50mg/L 的对羟基苯甲酸;50mg/L 的香草酸;25mg/L 的丁香酸;50mg/L 的4–羟基苯甲醛;50mg/L 的香草醛;75mg/L 的对香豆酸;50mg/L 的糠醛;50mg/L 的甲酸;50mg/L 的乙酸。以9 种单标准溶液为基础,配制含9 种标准品的混合标准溶液,置于4℃冰箱中备用。
1.3.2 芒草预处理
辐照处理在湖南省辐射技术应用研究中心进行。试验采用60Co γ 辐照源,源强为9.99×1015Bq,剂量率为2 kGy/h。将准备好的试验材料置于辐射场中,于室温条件下进行照射,选用辐照剂量为 1 200 kGy 的样品。辐照后将样品用中草药粉碎机粉碎,装入磨口玻璃瓶中备用。
1.3.3 辐照芒草中目标化合物的提取
称取1.00g 的芒草辐照样品,加入20mL 蒸馏水,在80℃时恒温水浴30min,过滤,取滤液。先用浓盐酸调节滤液的pH 值至2.0,再用等体积的乙酸乙酯萃取3次,混匀收集有机相,然后用无水硫酸镁脱水,抽滤,除去沉淀。有机相于63℃、0.085 MPa 下减压旋转蒸发至干后,用20mL 5%的乙腈–水溶液(用磷酸调pH 至2.7)溶解。
1.3.4 色谱条件
色谱柱为ZORBAX SB–C18柱。流动相 A 相为0.01 mol/L 磷酸氢二铵溶液(用磷酸调pH 至2.7),B相为乙腈。梯度洗脱程序为:0~25min B 相占流动相的比率为5%~20%;25~30min B 相占流动相的比率为20%~80%;30~35min B 相占流动相的比率为80%~5%;35~40min B 相占流动相的比率为5%。柱温 25℃; 多波长(205、218、230、256、280、310 nm)进行检测;流速为0.8mL/min;进样量为10 μL。
2 结果与分析
2.1 辐照芒草中目标化合物分离条件的确定
2.1.1 检测波长的选取
用液相对9 种物质的标准品分别进行全波长(190~400 nm)检测,以确定各物质的最大吸收波长,结果表明,各标准品的最大紫外吸收波长有明显差异。甲酸、乙酸、糠醛、对羟基苯甲酸的最大吸收波长分别为206、204、278、256 nm,香草酸、丁香酸的最大吸收波长均为218 nm,4–羟基苯甲醛、香草醛、对香豆酸的最大吸收波长分别为284、230、310 nm。综合考虑后确定检测波长为205、218、230、256、280、310 nm。
2.1.2 流动相的选取
2.1.2.1 流动相中有机溶剂的选取
分别以甲醇和乙腈作为流动相中的有机溶剂,比较各目标化合物的分离效果及峰形,结果表明,在选用甲醇作为流动相中的有机溶剂时,混标的HPLC 色谱图中4–羟基苯甲醛和香草醛2个峰之间出现连峰,甲酸、乙酸的单标HPLC 色谱图中有基线干扰现象。这可能是因为乙腈截止波长为190 nm,甲醇截止波长为205 nm,而样品所用的检测波长应大于流动相截止波长20 nm 左右。选用乙腈作为流动相中的有机溶剂时,各目标产物峰形窄尖,在达到有效分离的同时缩短了整个分析时间(表1),且乙腈的灵敏度比较高,柱压低,故选择乙腈作为流动相中的有机溶剂。

表1 以甲醇–水溶液和乙腈–水溶液为流动相时各目标化合物的保留时间 Table 1 Retention time of the target chemicals at two flowing phases of methanol-water solution and acetonitrile-water solution
2.1.2.2 酸种类的选取
酚类化合物容易产生解离,甲酸、乙酸均为弱酸,在水溶液中也会解离,以非单一的形式存在,这容易导致色谱峰形变宽、拖尾和不对称等现象出现,因此,可以在流动相中加入酸来抑制上述化合物的电离,使它们能够以分子的形式在反相柱上保留。液相色谱的分离效果与酸的种类有关[12],目前,用液相检测酚类化合物时多数是利用乙酸[13]或甲酸[14]对流动相进行pH 调节,本试验中需要在低紫外检测波长下进行检测,而作流动相的物质在检测波长附近应没有吸收,否则,会有基线干扰,因此,选择磷酸作为pH 的调节剂。
2.1.2.3 流动相中缓冲盐的选取
缓冲盐溶液能够有效改善峰形,影响酸存在形式的稳定性,从而影响分离效果。芒草样品的成分复杂,含有多种杂质,如果没有缓冲盐溶液的缓冲就会形成负峰[15]。磷酸氢二铵是在检测波长处无吸收的弱酸电离抑制剂,因此,本试验中选择磷酸氢二铵为缓冲盐溶液。
2.1.2.4 流动相pH 的选取
在柱温35℃、流速0.8mL/min 的条件下,用磷酸调节流动相中磷酸氢二铵盐溶液pH 进行单因素试验的结果见表2。由表2 可知,pH 对目标化合物分离效果和保留时间的影响不明显。

表2 不同pH条件下各目标化合物的保留时间 Table 2 Retention time of the target chemicals at different pH values
随着pH 值增大,香草醛和对香豆酸的保留时间间隔逐渐变小,分离度变小,在pH 为3.3 时,香草醛和对香豆酸的分离度为1.37(通常分离度大于等于1.5 才视为2个峰完全分离),因此,pH 为3.3 时香草醛和对香豆酸的分离度不够,形成连峰。因为长时间使用过低的pH 会引起色谱柱键合相的损失,而且可能导致基线严重漂移[16],所以,综合考虑后确定流动相pH 为2.7。
2.1.3 流速的选择
在35℃、流动相中盐溶液pH 为2.7 的条件下分别设置流速0.5、0.8、1.0、1.2mL/min 进行单因素试验的结果见表3。由表3 可知,流速对分离度和各峰保留时间的影响较大。流速越大,各峰的保留时间明显提前,使得整个分析时间大大缩短。流速在0.5mL/min 时,香草醛和对香豆酸出峰时间重叠;流速为1.0mL/min 时,丁香酸和4–羟基苯甲醛出锋不能完全分开;流速为1.2mL/min 时,丁香酸和4–羟基苯甲醛的出峰时间重叠;流速为0.8mL/min 时,各峰分离效果较好,且整个分离时间较为合适,所以,本试验中确定流速为0.8mL/min。

表3 不同流速条件下各目标化合物的保留时间 Table 3 Retention time of the target chemicals at different flowing velocities
2.1.4 柱温的选择
在流动相中盐溶液pH 为2.7、流速为0.8mL/min 的条件下,分别设置柱温20、25、30、35、40℃进行单因素试验,结果(表4)表明,随着柱温升高,大部分目标化合物的保留时间有所提前,其中香草醛和对香豆酸、丁香酸和4–羟基苯甲醛的分离度逐渐减少。在柱温为40℃时,HPLC 色谱图中的香草醛和对香豆酸的色谱峰相连,又因缓冲盐在较低温时易结晶析出,对色谱柱有不利影响,所以,综合考虑各色谱峰的分离度和峰形后确定柱温为25℃。

表4 不同柱温条件下各目标化合物的保留时间 Table 4 Retention time of the target chemicals at different column temperatures
2.1.5 洗脱梯度的选择
以0.01 mol/L 磷酸氢二铵盐溶液(用磷酸调pH 为2.7)为A 相,以乙腈为B 相,在流速0.8mL/min、柱温为25℃的条件下设置3个梯度洗脱条件(表5)。

表5 洗脱梯度条件 Table 5 Elutiongradient conditions
由表6 可知,在0~25min,随着B 相所占比率的增加,各目标化合物的保留时间提前,分离度也降低。在梯度3 中,香草醛和对香豆酸的色谱峰相连,香草酸和丁香酸的色谱峰相连。在梯度1、2 中,各目标化合物达到基线分离,且分离效果较好,但考虑到芒草样品成分复杂,目标化合物分离度稍大,两物质之间干扰较小,因此,确定洗脱梯度条件为表5 中的梯度1。
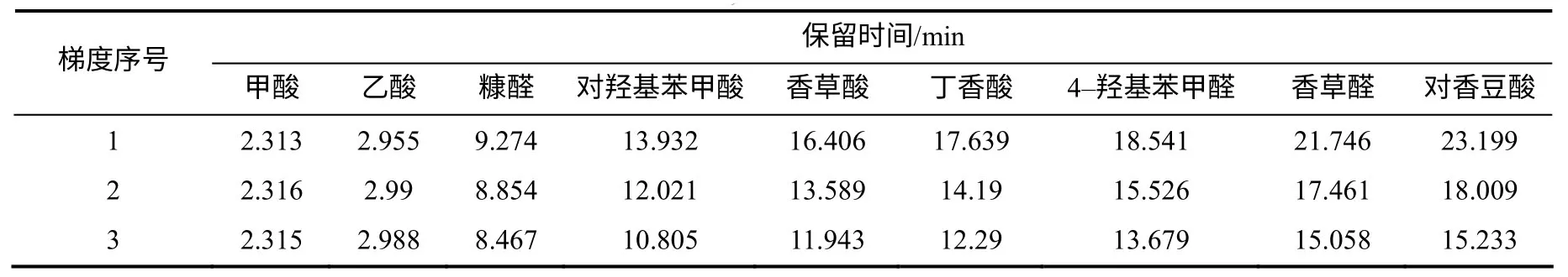
表6 不同梯度条件下各目标化合物的保留时间 Table 6 Retention time of the target chemicals at differentgradient conditions
2.2 标准曲线的制作
将单一标准品对比混合标样的色谱图进行分析,通过对比各峰保留时间的位置,确定9 种目标产物的相应峰位。图1 为目标产物混合标准溶液的HPLC 色谱图。

图1 混合标准溶液的HPLC色谱图 Fig.1 HPLC chromatogram of a mixed standard solution
对1.3.1 中配制的标准溶液里各目标化合物浓度进行稀释,得到5个浓度梯度的混合标准溶液。各浓度梯度的混标按前述色谱条件分别进样10 μL,以质量浓度X(mg/L)对峰面积Y 绘制标准曲线。其保留时间、线性回归方程和检出限(信噪比为3)结果如表7 所示。对芒草辐照预处理物料热水浴萃取物进行加标回收试验,样品重复进样测定6次;加入待测物标准品后再重复进样测定6次,计算加标回收率及相对标准偏差,结果见表7。由表7 可知,各目标化合物的加标回收率均高于96%,相对标准偏差<2.5%(n=6),结果满足定量分析要求。

表7 9 种目标化合物的保留时间、线性回归方程、检出限、加标回收率和精密度(n=6) Table 7 Retention time,linear regression equation,detection limit,recovery and precision of 9 kinds of target chemicals (n=6)
2.3 芒草辐照预处理后目标化合物的测定
取经1 200 kGy60Co γ 辐照后的芒草,按照1.2.3 中的方法提取芒草降解副产物样品。在优化后的色谱条件下测定样品中9 种目标化合物的含量,其色谱分离结果如图2 所示。

图2 芒草辐照预处理样品水提液的HPLC谱图 Fig.2 HPLC chromatogram from the water extracts of miscanthus pretreated with irradiation
由图2 可知,HPLC 法可用于对芒草辐照预处理后主要降解副产物的定量分析,9 种主要降解副产物的分离效果较好。计算结果表明,芒草水提液中甲酸、乙酸、糠醛、对羟基苯甲酸、香草酸、丁香酸、4–羟基苯甲醛、香草醛和对香豆酸的质量浓度分别为102.29、86.24、2.52、17.78、12.43、3.26、15.40、10.18、16.42mg/L。
3 结论与讨论
本研究中同时检测出了木质纤维素原料中的3大类副产物,跟江智婧等[9]的方法相比,在目标物达到有效分离的同时大大缩短了整个分析时间,提高了工作效率;与气质联用的方法相比[3,6],液相色谱法无需硅烷化,克服了气质联用法样品预处理要求高、衍生化不彻底等缺点。建立了同时检测出木质纤维素原料中9 种主要副产物的定量分析方法:采用C18色谱柱,柱温25℃,以乙腈–0.01 mol(NH4)2HPO4(用磷酸调节pH 至2.7) 为流动相,梯度洗脱,流速为0.8mL/min,多波长紫外检测,在此色谱条件下,9 种主要的降解副产物得到了较好的分离,相对标准偏差为1.5%~2.3%,最低检出限为0.10~0.89mg/L,且回收率均在96%以上。该方法具有简易性、实用性、可行性和重复性好等优点。经1 200 kGy60Co γ 辐照处理后的芒草水提液,在4~6min 还检测出了2个明显的峰,按出峰时间推测,这可能是其他有机酸所导致的(蒋怡乐等[6]利用气质联用法定性检测出芒草辐照降解产物中还有乳酸、乙酰丙酸和琥珀酸等有机酸)。芒草辐照降解产物成分复杂,难以全部定性定量,其后续研究与分析还有待开展。
[1] 易自力.芒属能源植物资源的开发与利用[J].湖南农业大学学报:自然科学版,2012,38(5): 455-463.
[2] 孙健,陈砺,王红林.纤维素原料生产燃料酒精的技术现状[J].可再生能源,2004(6):5–9.
[3] 朱均均,勇强,陈尚钘,等.玉米秸秆蒸汽爆破降解产物的分析[J].林产化学与工业,2009,29(2):22–26.
[4] 林贝.玉米秸秆酸解副产物对酒精发酵影响的研究[D].大连:大连理工大学,2007.
[5] Ximenes E,Kim Y,Mosier N,et al.Inhibition of cellulases by phenols[J].Enzyme and Microbial Techno- logy,2010,46(3):170–176.
[6] 蒋怡乐.芦苇、芒草60Co γ 辐照降解产物的分析及结构表征[D].长沙:湖南农业大学,2013.
[7] 江滔,路鹏,李国学.玉米秸秆稀酸水解时糠醛形成原因及影响因素[J].农业工程学报,2009(7):185–189.
[8] 朱峰,涂貌贞,王丽莉,等.高效液相色谱法同时测定纺织品中10 种酚类化合物[J].分析测试学报,2013 (3):336–340.
[9] 江智婧,朱均均,李鑫,等.反相高效液相色谱法定量分析木质素的主要降解产物[J].色谱,2011,29(1):59–62.
[10] Chen S F,Mowery R A,Castleberry V A,et al. High-performance liquid chromatography method for simultaneous determination of aliphatic acid,aromatic acid and neutral degradation products in biomass pretreatment hydrolysates[J].Journal of Chromatography A,2006,1104(1):54–61.
[11] 赵景婵,郭治安,常建华,等.有机酸类化合物反相高效液相色谱法的分离条件研究[J].色谱,2001,19(3):260–263.
[12] 刘江云,杨学东,徐丽珍,等.天然酚酸类化合物的反相高效液相色谱分析[J].色谱,2002,20(3):245–248.
[13] 姚兴东,聂园梅.紫锥花种属中酚类化合物的HPLC分析[J].分析科学学报,2006,22(2):199–201.
[14] 欧阳新平,陈子龙,邱学青.超高效液相色谱/高分辨质谱法测定木质素氧化降解产物中单酚类化合物[J].分析化学,2014(5):22.
[15] 尹莉丽,赵百东,杨虹琦,等.高效液相色谱法测定烤烟非挥发性有机酸含量[J].湖南农业大学学报:自然科学版,2014,40(2):139–143.
[16] 陈磊,黄雪松.高效液相色谱法同时检测黄酒中的5–羟甲基糠醛和9 种多酚[J].分析化学,2010(1):133–137.
