肥大细胞在胃癌及癌前病变组织中的分布及其临床意义
2015-07-11路敏敏金世禄刘宝珍张建吴艳芳
路敏敏,金世禄,刘宝珍,张建,吴艳芳
(1.滨州医学院临床学院,山东 滨州 256603;2.滨州医学院附属滨州市人民医院消化内科,山东 滨州 256610;3.滨州医学院附属滨州市人民医院病理科,山东 滨州 256610)
随着人们对于疾病认识的不断深入,肿瘤的发生、发展与其局部微环境之间的关系备受关注。肥大细胞(MC)是肿瘤微环境中浸润的炎症细胞之一,其在肿瘤发生发展过程中的具体作用尚无定论。本研究检测了MC在胃良性病变、胃癌前病变及胃癌组织中的分布情况,并分析其与临床病理资料的关系,以期进一步探讨MC在胃癌发生发展中的作用。
1 材料和方法
1.1 材料
选取2013年1月至2014年1月在滨州医学院滨州市人民医院行胃镜活检或手术切除的胃组织标本,其中胃癌标本23例,男16例,女7例;年龄30~73岁,平均(61.8±4.2)岁;TNM 分期:Ⅰ期8例,Ⅱ期4例,Ⅲ期8例,Ⅳ期3例,术前均未行放化疗。胃癌前病变(慢性萎缩性胃炎伴肠化生)标本30例,男22例,女8例;年龄34~79岁,平均(61.5±3.9)岁。胃良性病变(慢性非萎缩性胃炎)标本12例,男4例,女8例;年龄32~67岁,平均(60.8±3.9)岁。以上病例临床和病理资料完整,病理诊断均经病理科专家复核。3组患者性别构成、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 主要仪器与试剂
LEICA RM2245型组织切片机,OLYMPUS BX50型光学显微镜,兔抗人CD117单克隆抗体购于武汉博士德生物工程公司,快速免疫组化MaxVisionTM试剂盒购于福州迈新生物技术开发有限公司,Wathin-Starry胃幽门螺旋杆菌(HP)染色液购于厦门迈威生物科技有限公司。
1.3 方法
1.3.1 免疫组化染色 所有标本均经10%福尔马林液固定,石蜡包埋,4 μm厚连续切片。采用Max-VisionTM快速免疫组织化学染色方法对切片染色。实验步骤严格按照说明书进行:石蜡切片后脱蜡水化、3%H2O2孵育20 min灭活内源性过氧化酶、PBS洗涤;采用微波热修复法进行抗原修复;加入一抗、二抗孵育;DAB显色、苏木素复染、脱水、透明、封片。已知阳性片作为阳性对照,PBS代替一抗作为阴性对照。经免疫组化染色,MC胞浆呈棕色,各组织标本随机计数5个高倍镜视野下MC数量,并求其平均数。
1.3.2 HP染色 采用Wathin-Starry银反应法对切片染色。实验步骤严格按照说明书进行。被着色的胃幽门螺旋杆菌呈棕黑色或黑色,即阳性;反之,为阴性。
1.4 统计学分析
应用软件SPSS13.0统计分析。计量资料以均数±标准差(±s)表示,不同组别间MC数比较采用t检验,多组间比较应用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 不同病变组织中MC计数结果
经免疫组化染色后,镜下呈棕色的MC主要位于黏膜层及黏膜下层。胃良性病变组、胃癌前病变组和胃癌组的MC 平均数量分别为32.0 ±9.1、39.0±10.2、20.8 ±11.0,经统计分析,3 组MC 表达差异具有统计学意义(P<0.05)。见图1~3。

图1 胃癌前病变组织肥大细胞(×200)

图2 胃癌组织中肥大细胞表达(×200)

图3 胃良性病变组织中MC分布(×200)
2.2 胃癌前病变组织中MC数量与临床病理资料的关系
胃癌前病变组织中,除HP阳性和阴性组织中MC数量差异有统计学意义外(P<0.01),其余各指标与MC数量均无相关性(P>0.05),见表1。

表1 胃癌前病变组织中MC数量与临床病理资料的关系
2.3 胃癌组织中MC数量与临床病理资料的关系
胃癌组织中,除HP阳性和阴性组织中MC数量差异有统计学意义外(P<0.01),其余各指标与MC数量均无相关性(P>0.05),见表2。
3 讨论
炎症浸润[1]被认为是肿瘤微环境的基本特征之一,在肿瘤发生、进展过程中可刺激机体发生一系列复杂的炎症、免疫反应,其中MC的募集、浸润越来越受到研究者的关注[2]。MC作为免疫细胞,不仅在超敏反应中发挥重要作用,在固有免疫、获得性免疫中也发挥重大作用。MC可以释放分泌多种生物活性物质,这些具有各自生物学效应的介质不仅能直接引起相应的反应,还能间接诱导邻近细胞释放一些其它的介质,进一步扩大组织反应,表现为MC功能多样化。
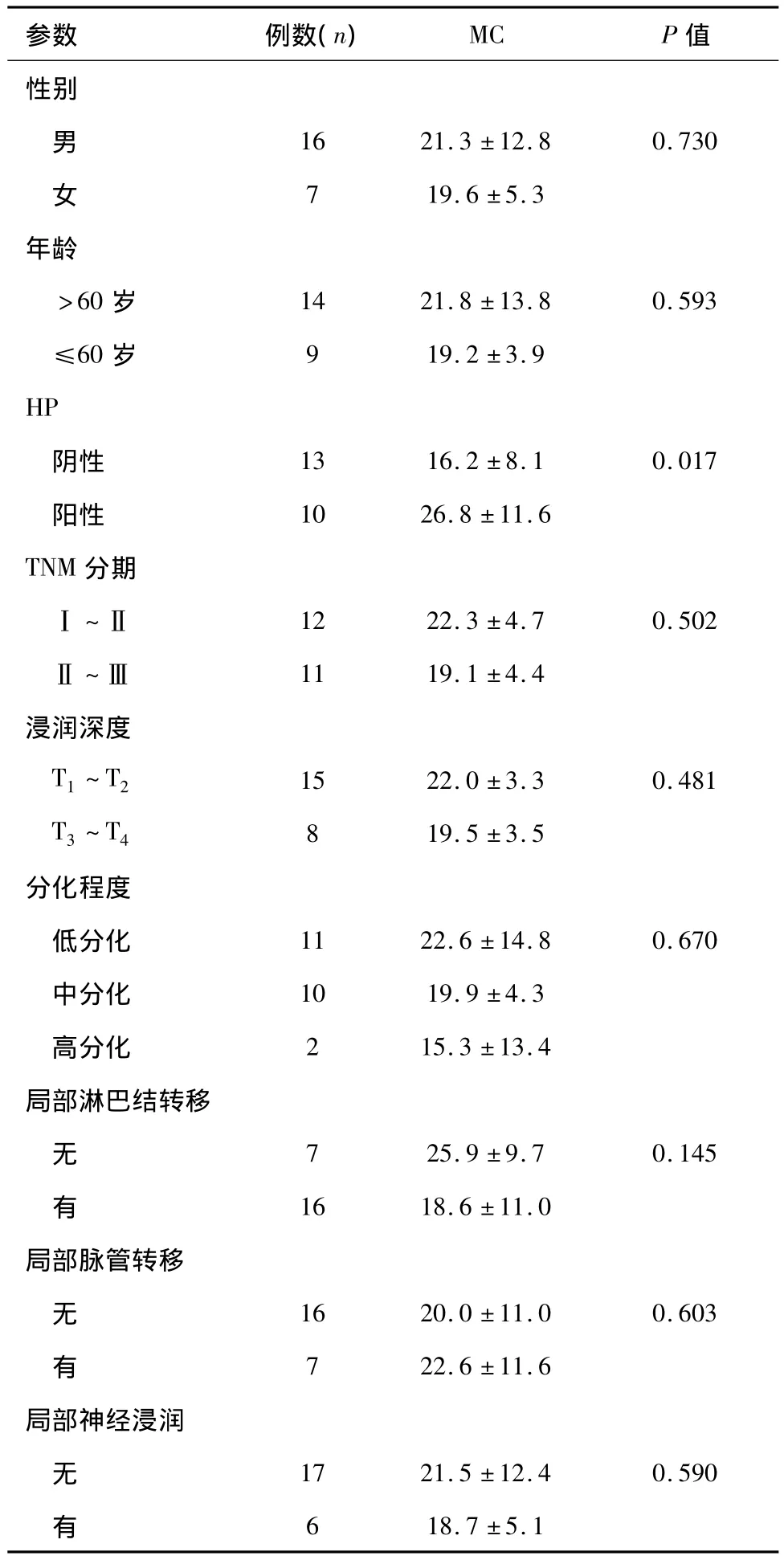
表2 胃癌组织中MC数量与临床病理资料的关系
研究证实,在肿瘤进展过程中,肿瘤组织可以产生重组人干细胞因子(SCF)[3],而 MC可以表达SCF 的受体 c-Kit,通过 SCF/c-Kit通路[4]作用,趋化迁移至肿瘤局部成为局部微环境中主要的间质细胞。在多种免疫学或非免疫学刺激因子作用下激活MC脱颗粒[5]分泌一系列生物活性介质,包括组胺、B-己糖胺酶、5-羟色胺、促炎性脂质介质、蛋白聚糖、生长因子、细胞因子、趋化因子和蛋白酶等。但关于MC在肿瘤中发挥的具体作用尚无一致意见。一方面,MC可能通过诱导血管生成[6],分泌蛋白水解酶破坏肿瘤细胞外基质的降解,免疫细胞招募方式等促肿瘤生长[7-8]。另一方面,肥大细胞通过释放组胺等增加血管壁通透性诱发免疫细胞、抗体等成分进入肿瘤内部;分泌肝素抑制肿瘤细胞的分裂限制肿瘤的生长;还可以分泌白细胞介素(IL)-1,IL-4,IL-6、肿瘤坏死因子-α(TNF-α)等细胞因子杀死肿瘤细胞。Amini等[9]探讨了乳腺癌中MC的浸润与预后的关系,结果显示MC计数越多,患者预后越好。Gustaf等[10]人在弥漫性大B细胞淋巴瘤中也得出同样的结论,即MC计数与病人的预后成正比,提示MC发挥抑制肿瘤生长的作用。但关于MC在胃癌中发挥什么作用目前尚无一致定论。Ribatti等[6]发现MC数量和血管密度正相关,与患者预后负相关。陈娜等[11]研究发现胃癌组织中MC显著低表达人类白细胞DR抗原(HLA-DR),并可以抑制胃癌细胞分泌TNF-α进而发挥免疫抑制作用。Liu等[12]研究发现MC是胃癌组织中IL-17的主要来源,IL-17通过促进靶细胞分泌多种促血管生成因子以及直接作用于血管内皮细胞,促进肿瘤血管生成。由此可见,MC与肿瘤发生发展的关系十分复杂。本实验发现胃癌前病变组织中MC数量高于胃癌组织及胃良性病变组织,且差异有统计学意义,与国内一些研究[13]相似。据此,笔者推测,在肿瘤发展初期,尤其是癌前病变时期,MC被募集到达局部,有可能在血管生成、组织重塑中起到关键作用,这有利于肿瘤的起始和生长,可能通过抑制微环境募集成熟的免疫效应细胞,发挥抗肿瘤作用。而胃癌组织中MC数量显著低于其他组织,且MC与肿瘤分化级别、浸润深度等临床病理因素无明显关系,MC有可在癌变的“转折点”前发挥更重要的作用,随着肿瘤进一步发展,则可能与其他免疫因子、免疫细胞一道参与重构胃癌微环境,但具体作用及机制尚待进一步研究。
有研究证明,MC及其脱颗粒过程[14]参与 HP感染,但其确切机制尚未明了。Bernard等[15]研究发现,HP通过释放的VacA作用于MC,后者释放一系列促炎因子,其中钙依赖性炎性细胞因子(如TNF-α)诱发MC内钙离子水平快速改变,导致MC脱颗粒,释放更多生物活性介质,使局部微环境发生了改变。IL-1、IL-4、IL-5、IL-7及白三烯等均有较强化学趋化性,能刺激白细胞游走、粘附、迁移至感染部位,其中中性粒细胞的浸润是HP致病的重要机制之一,其释放大量细胞酶、溶酶体酶、氧自由基、花生四烯酸代谢产物等可导致胃粘膜受损;MC脱颗粒释放大量炎性介质参与免疫调节,MC释放的组胺可与胃粘膜壁细胞受体结合,刺激胃酸分泌加重胃粘膜损伤。本研究发现,在胃癌前病变、胃癌组织中,HP阳性组织中MC数量均高于阴性组织,且差异具有统计学意义,提示MC可能参与HP感染过程,或与HP感染诱发的胃癌及癌前病变关系密切,与上述报道一致。
综上所述,MC参与重构慢性胃炎、胃癌微环境,且与HP感染相关,但涉及的分子机制尚待进一步探讨。
[1]Roesler BM,Costa SC,Zeitune JM.Eradication treatment of Helicobacter pylori infection:its importance and possible relationship in preventing the development of gastric cancer[J].ISRN Gastroenterol,2012,doi:10.5402/2012/935410.
[2]Maciel TT,Moura IC,Hermine O.The role of mast cells in cancers[J].F1000Prime Rep,2015,7:9.
[3]Han ZB,Ren H,Zhao H,et al.Hypoxia-inducible factor(HIF)-1 alpha directly enhances the transcriptional activity of stem cell factor(SCF)in response to hypoxia and epidermal growth factor(EGF)[J].Carcinogenesis,2008,29(10):1853 -1861.
[4]Huang B,Lei Z,Zhang GM,et al.SCF-mediated mast cell infiltration and activation exacerbate the irlflammation and lmmunosuppression in tumor microenvironment[J].Blood,2008,112(4):1269-1279.
[5]Heissig B,Rafii S,Akiyama H,et al.Low-dose irradiation promotes tissue revascularization through VEGF release from mast cells and MMP-9-mediated progenitor cell mobilization[J].J Exp Med,2005,19,202(6):739 -750.
[6]Rbatti D,Guidoli nD,Marzullo A,et al.Mast cells and angiogenesis in gastric Carcinoma[J].Int J Exp Pathol,2010,91(4):350 -356.
[7]Chang DZ,Ma Y,Ji B,et al.Mast cells in tumor microenvironment promotes the in vivo growth of pancreatic ductal adenocarcinoma[J].Clin Cancer Res,2011,17(22):7015 -7023.
[8]Wasiuk A,Dalton DK,Schpero WL,et al.Mast cells impair the development of protective anti-tumor immunity[J].Cancer Immunol Immunother,2012,61(12):2273 -2282.
[9]Amini RM,Aaltonen K,Nevanlinna H,et al.Mast cells and eosinophilsin in vasive breast carcinoma[J].BMC Cancer,2007,7:165-170.
[10]Hedstrom G,Berglund M,Molin D,et al.Mast cell infiltration is a favourable prognostic factor in diffuse large B-cell lymphoma[J].Br J Haematol,2007,138(1):68 - 71.
[11]陈娜,庄园,王婷婷,等.肥大细胞在胃癌患者中分布及其免疫抑制作用的研究[J].免疫学杂志,2014,30(1):1 -5.
[12]Liu X,Jin H,Zhang G,et al.Intratumor IL-17-positive mast cells are the major source of the IL-17 that is predictive of survival in gastric cancer patients[J].PLoS One.2014,9(9):e106834.
[13]刘亚楠,蔺丽慧,王娟,等.肥大细胞促进早期胃癌形成及其生物学意义[J].检验医学,2013,28(1):67 -71.
[14]刘克伟,朱海杭.肥大细胞生物学特征与慢性胃炎、消化性溃疡关系的研究进展[J].胃肠病学和肝病学杂志,2009,18(6):572-574.
[15]De Berbard M,Cappon A,Pancotto L,et al.The Helicobacter pylori VacA cytotoxin activates RBL-2H3 cells by inducing cytosolic calcium oscillations[J].Cell Microbiol,2005,7(2):191 - 198.
