SATB1基因在食管癌中的表达及临床意义
2015-07-11刘康李杰王兰赵云霞叶俊李佳秦家元宋桂芹
刘康,李杰,王兰,赵云霞,叶俊,李佳,秦家元,宋桂芹
(1.川北医学院组织工程与干细胞研究所;2.南充市中心医院生物治疗中心;3.川北医学院2012级临床医学系;4.川北医学院2013级临床医学系;5.川北医学院2011级临床医学系;6.川北医学院基础医学院生物学教研室,四川 南充 637000)
食管癌是我国常见的恶性肿瘤之一,我国食管癌的发病率、死亡率均位居世界前列,每年的发病人数占全世界的一半以上[1],而以四川南充、盐亭为代表的川东北地区是中国食管癌的主要高发区之一[2]。食管癌的术后转移和复发是造成预后差和死亡的主要原因之一,因此进一步探讨食管癌发病原因和发病机理,对尽早发现和治疗具有重要的现实意义。因此,有必要从遗传学和表观遗传学角度对食管癌的发生、转移机制进行深入研究,探讨食管癌发生、发展过程中细胞内各种基因和信号转导通路的异常活化,并针对细胞内的基因和信号通路中的重要分子开发定向拮抗药物,为诊断和治疗食管癌提供新靶点和策略。
特异AT序列结合蛋白1(special AT rich sequence binding protein 1,SATB1)是一种组织特异性核基质区结合蛋白,可特异性的与核基质结合区序列结合,参与染色体的高级包装和组织特异性基因表达的调控及核骨架的形成[3]。我们的前期研究发现,SATB1基因在胃癌组织和细胞中均呈高表达[4],体内外试验证实,经SATB1沉默的胃癌细胞其侵袭转移和增殖能力均有明显降低。但SATB1基因在食管癌中的表达和作用如何,目前国内外尚无探讨。本研究应用免疫组织化学染色和荧光定量PCR等方法,分析SATB1基因在食管癌中的表达与肿瘤发生、分化转移的关系,希望通过以上研究加深对食管癌生物学行为的了解,对食管癌的早期诊断和治疗提供参考。
1 材料与方法
1.1 临床资料
选取2013年10月至2014年4月我院附属医院心胸外科手术切除后经病理诊断为食管鳞状细胞癌及癌旁组织48例。其中男性34例、女性14例,年龄43~75岁,平均60岁。病理分级:高分化10例,中分化25例,低分化13例。所有患者术前均未接受放疗或化疗。
1.2 主要试剂
qRT-PCR引物由上海捷瑞生物工程有限公司合成,RNA提取试剂盒购自Omega公司,cDNA合成试剂盒和PCR试剂盒购自Thermo公司,兔抗人SATB1多克隆抗体购自bioss公司。
1.3 免疫组织化学染色
采用链霉素抗生素蛋白-过氧化酶连接法(S-P法)按试剂盒说明书进行操作。切片经二甲苯脱蜡,梯度酒精水化后,双氧水阻断内源性过氧化物酶活性后高压锅行抗原修复10 min,正常山羊血清封闭20 min后,滴加一抗(以PBS代替一抗作为阴性对照)4℃孵育过夜,PBS洗2遍,滴加生物素标记的二抗,室温孵育1 h,PBS洗2遍后滴加辣根过氧化物酶标记链霉素工作液,DAB显色,苏木素复染,中性树胶封片。SATB1基因阳性判断标准以胞浆或胞核内出现棕黄色颗粒为阳性。结果判定在双盲法下进行,每张切片由2名病理医师分别判断,两者结论不一致时重新评判。
1.4 实时荧光定量PCR
按照Omega RNA提取试剂盒说明书分别提取食管癌组织和癌旁组织RNA,按cDNA合成试剂盒说明书分别将RNA逆转录为cDNA,然后按照Bio-Rad荧光定量试剂盒说明书加样检测不同组织SATB1表达差异。qRT-PCR引物由上海捷瑞生物工程工程有限公司合成,引物序列见表1。所有反应均设有3个复孔,采用SYBR Green嵌合荧光方法在荧光定量PCR仪(Bio-Rad公司)扩增目的基因和内参基因。
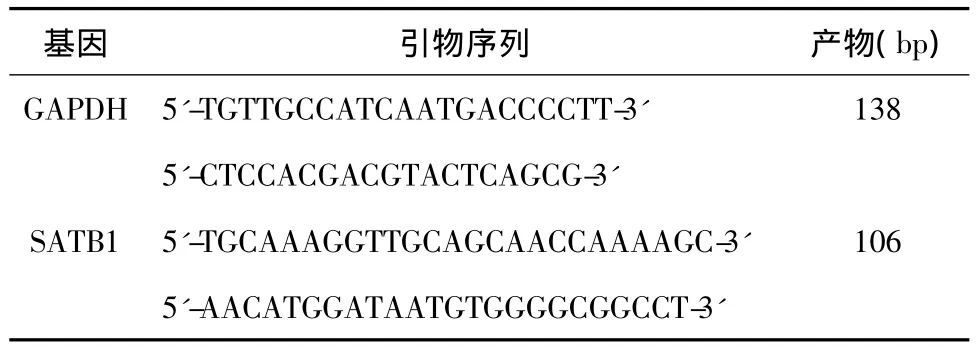
表1 实时荧光定量PCR扩增的引物序列及扩增片段的大小
1.5 统计学分析
采用SPSS 13.0统计软件进行数据分析,采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 SATB1蛋白在食管癌和癌旁的表达情况
SATB1定位于细胞核,呈淡黄色至棕黄、棕褐色,在食管癌组织中的表达率显著高于癌旁组织中的表达,为83.3%。见图1。
2.2 SATB1的表达与食管癌临床病理参数相关性分析
SATB1在食管癌组织各级总的表达率见表2。SATB1基因在食管癌中呈阳性表达,在食管癌组织各级的表达分别为:与患者年龄和性别无关,但与肿瘤细胞分化程度、淋巴结转移和病理学分期等呈显著正相关。肿瘤分化程度低、临床病理分期较晚和出现淋巴结转移的肿瘤组织SATB1蛋白的表达与肿瘤分化程度高、临床分期较早和未见淋巴结转移的肿瘤组织比较,统计学有显著意义(P<0.05)。
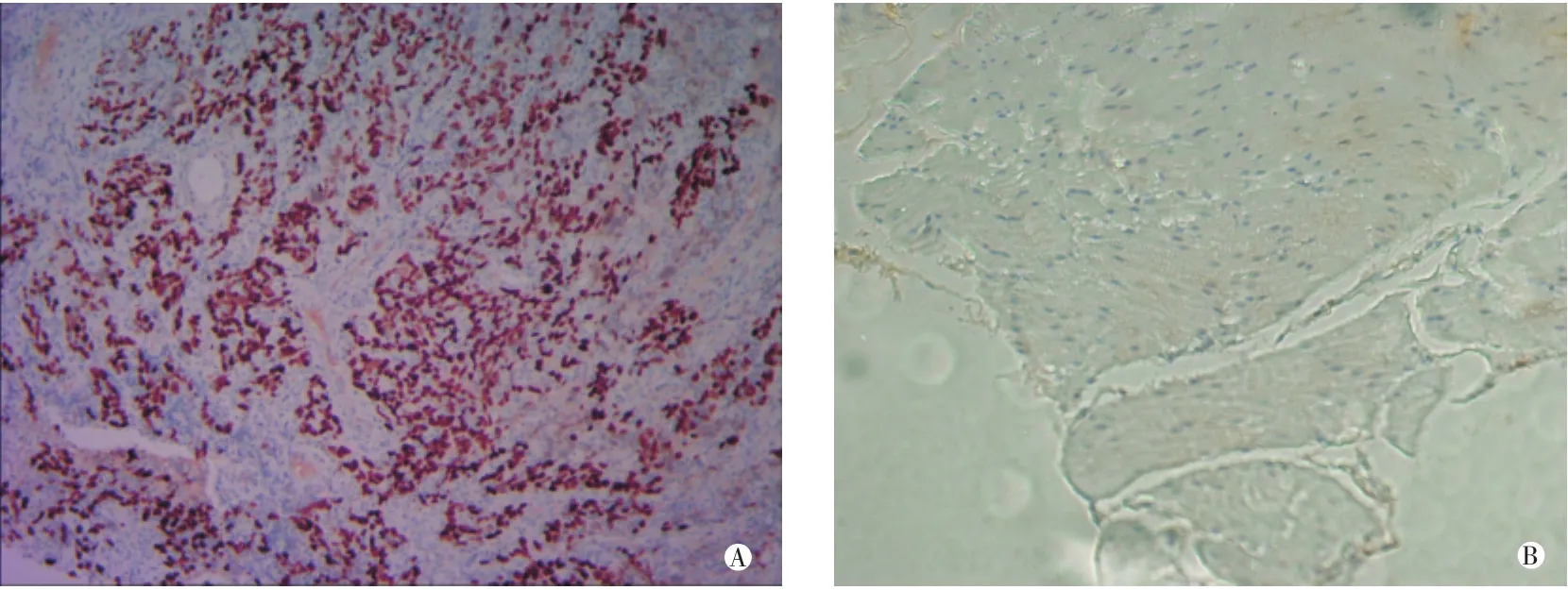
图1 SATB1在食管癌和癌旁中的表达情况(×200)
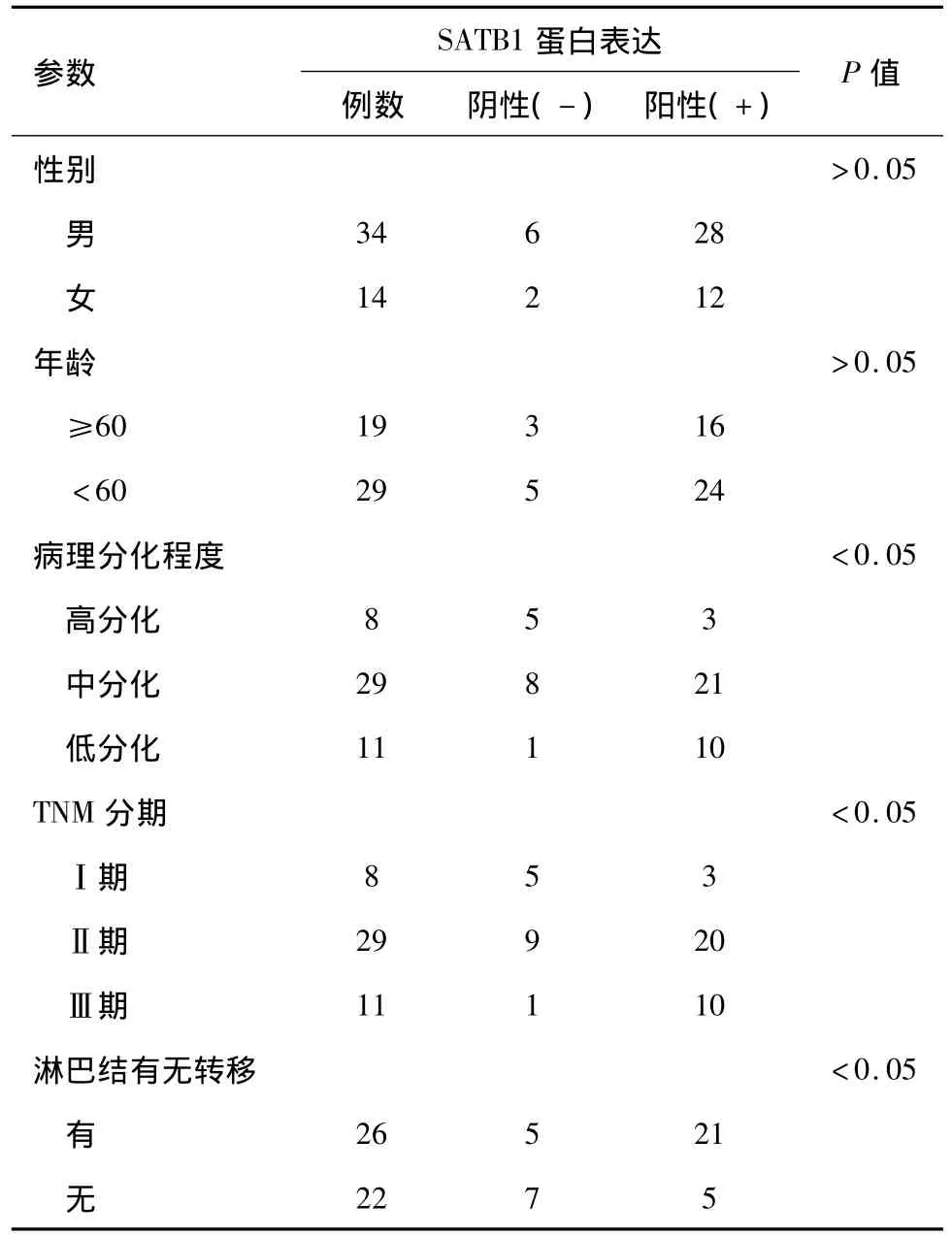
表2 SATB1与食管癌临床病理参数相关系性分析
2.3 SATB1基因在食管癌组织中的表达
荧光定量PCR结果显示,SATB1基因在癌组织中的表达率显著高于癌旁组织,结果见图2。
3 讨论
食管癌(esophageal carcinoma)是目前世界上最常见的胃肠道恶性肿瘤之一,而我国又是食管癌高发地区,年平均死亡人数约15万人,占全国肿瘤死亡率21.8%[5]。在导致死亡最多的癌症中,食管癌名列第4,侵袭转移是造成患者死亡的主要原因。迄今为止,食管癌的发病机制仍不清楚,食管癌的早期诊断和预后评估等一系列问题一直困扰着广大临床工作者。但大量研究表明,食管癌的发生和侵袭转移是一个多基因、多步骤的癌变过程,涉及大量相关基因结构和表达调控的改变,尤其是癌基因的活化和抑癌基因的失活起着重要作用[6]。相关基因在食管癌的发生及发展中扮演重要角色,肿瘤发生与癌基因的激活和抑癌基因的失活密切相关,食管癌的侵袭转移及发展和食管癌转移基因及食管癌转移抑制基因有密切联系。已知与食管癌发生、转移相关的癌基因很多,如 Survivin、β-catenin、c-myc、EGFR、ras和p16等,针对这些基因的基因治疗也取得了一定的进展[7-12],但是效果并不明显,因此,深入研究食管癌发生、侵袭转移的分子机制,寻找新的干预靶点对于食管癌的预防和治疗具有重要意义。
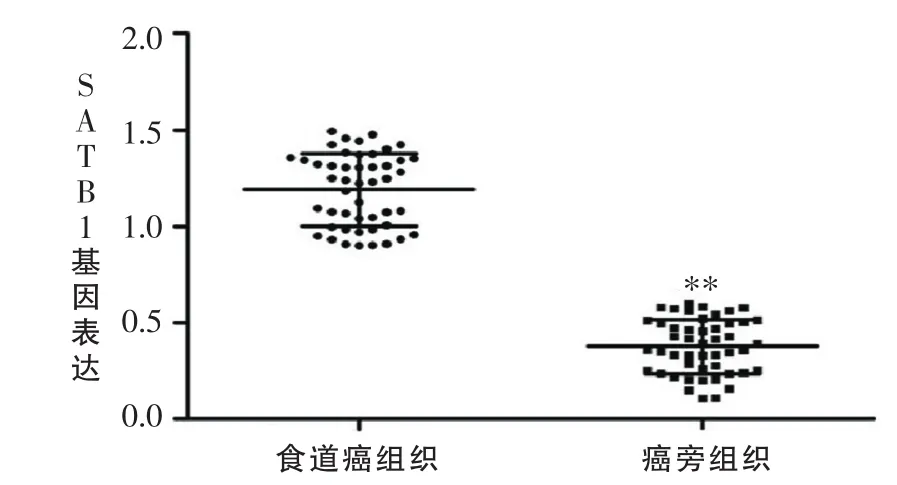
图2 荧光定量PCR检测SATB1基因在食管癌和癌旁组织中的表达情况
2008年,Han等[5]对乳腺癌的一项研究表明SATB1(special A-T rich sequence binding protein 1)蛋白是乳腺癌细胞获得转移性所必需的,其在具有侵袭性的乳腺癌细胞中有所表达,而在正常细胞中并不出现。SATB1表达上调与侵袭性肿瘤表型和患者存活时间下降相关。SATB1通过限定多个基因组的位点和补充染色质修饰酶来调节染色质的结构和基因表达。在有较强侵袭性的癌细胞中敲除SATB1可以改变基因表达,通过恢复癌细胞的极性来逆转肿瘤的发生,并且抑制在体肿瘤的生长和转移。在非侵袭性肿瘤细胞中SATB1的异位表达可以导致与侵袭性肿瘤表型相关的基因表达模式,从而使之获得转移的能力。SATB1起到基因组组织器的作用,构成了一个功能性的核结构,被称为SATB1调节的网状结构。比较SATB1移除前后几种转移性细胞型中基因表达图谱的变化,结果表明SATB1控制着1/4-1/3“预后不良基因”,包括控制黏附性、细胞周期、细胞外基质、数个信号通路、细胞间连接和凋亡的基因。因此SATB1通过染色质基因重排促进肿瘤的发生和转移,SATB1增量调节可能是肿瘤细胞转移必须基因簇的开关。
进一步的研究表明,SATB1在肝癌、子宫内膜癌和直肠癌中均为高表达[13-15],抑制 SATB1在相关肿瘤中的表达可以达到抑制肿瘤转移的作用。我们之前的研究也发现,SATB1基因在胃癌组织中均呈高表达,在正常组织中低表达或无表达[4]。但目前为止,SATB1与食管癌的关系如何,其在食管癌中的表达情况及调控机制等研究尚未见公开报道。
本研究结果表明,食管癌组织中 SATB1的mRNA及其蛋白的表达与癌旁组织比较明显增高,SATB1的表达与患者年龄、性别无关,但与肿瘤细胞分化程度、淋巴结转移和病理学分期等呈显著正相关,这提示SATB1可能在食管癌的发生、发展、转移过程中起到一定的作用,表明其可作为食管癌恶性程度及预后的重要参考指标,进一步提示其有可能作为食管癌生物治疗的重要靶点,为食管癌侵袭转移和治疗提供一个新的研究方向。
[1]辛亮.食管癌的治疗进展[J].山东医药,2014,54(2):97 -99.
[2]Uemura N,Kondo T.Current status of predictive biomarkers for neoadjuvant therapy in esophageal cancer[J].World J Gastrointest Pathophysiol,2014,5(3):322 -34.
[3]Cai S,Han HJ,Kohwi-Shigematsu T.Tissue-specific nuclear architecture and gene expression regulated by SATB1[J].Nat Genet,2003,34(1):42 -50.
[4]宋桂芹,刘康,白亦光,等.SATB1在胃癌细胞SGC-7901中表达的研究[J].中华全科医学,2014,12(1):21 -23.
[5]田东,贺巧,王洋,等.食管癌高发区农村居民饮食状况及对食管癌认知调查[J].川北医学院学报,2010,25(5):470 -473.
[6]白海鹏,孙维敏,康娜.食管癌及其治疗的研究进展[J].包头医学院学报,2014,30(3):134 -136.
[5]Han HJ,Russo J,Kohwi Y,et al.SATB1 reprogrammes gene expression to promote breast tumour growth and metastasis[J].Nature,2008,452(7184):187 -193.
[6]Zhang M,Zhou S,Zhang L,et al.Role of cancer-related inflammation in esophageal cancer[J].Crit Rev Eukaryot Gene Expr,2013,23(1):27-35.
[7]Li C,Yan Y,Ji W,Bao L,et al.OCT4 positively regulates Survivin expression to promote cancer cell proliferation and leads to poor prognosis in esophageal squamous cell carcinoma[J].PLoS One,2012,7(11):e49693.
[8]He H,Ding F,Li S,et al.Expression of migfilin is increased in esophageal cancer and represses the Akt-β-catenin activation[J].Am J Cancer Res,2014,4(3):270 -278.
[9]Wang F,Xia J,Wang N,et al.miR-145 inhibits proliferation and invasion of esophageal squamous cell carcinoma in part by targeting c-Myc[J].Onkologie,2013,36(12):754 - 758.
[10]Kwon J,Yoon HJ,Kim JH,et al.Cetuximab inhibits cisplatin-induced activation of EGFR signaling in esophageal squamous cell carcinoma[J].Oncol Rep,2014,32(3):1188 -1192.
[11]Jin Z,Feng X,Jian Q,et al.Aberrant methylation of the Ras-related associated with diabetes gene in human primary esophageal cancer[J].Anticancer Res,2013,33(11):5199 -5203.
[12]Xu R,Wang F,Wu L,et al.A systematic review of hypermethylation of p16 gene in esophageal cancer[J].Cancer Biomark,2013,13(4):215-226.
[13]Tu W,Luo M,Wang Z,et al.Upregulation of SATB1 promotes tumor growth and metastasis in liver cancer[J].Liver International,2012,32(7):1064 -1078.
[14]Mokhtar NM1,Ramzi NH,Yin-Ling W,et al.Laser capture microdissection with genome-wide expression profiling displayed gene expression signatures inendometrioid endometrial cancer[J].Cancer Invest,2012,30(2):156 - 164.
[15]杜超,成超,卢晓明,等.AT富集序列特异性结合蛋白1在直肠癌组织中的表达及其临床意义[J].中华实验外科杂志,2014,31(5):1120 -1122.
