中国人群CYP2D6的基因多态性与乳腺癌患者他莫昔芬及其代谢物血药浓度关系的Meta分析
2015-07-07熊萱张思超朱昶宇
熊萱,张思超,朱昶宇
(1.四川大学华西药学院 临床药学系,四川 成都 610041;2.四川省医学科学院 四川省人民医院 药学部,四川 成都 610072)
中国人群CYP2D6的基因多态性与乳腺癌患者他莫昔芬及其代谢物血药浓度关系的Meta分析
熊萱1,2,张思超2,朱昶宇2
(1.四川大学华西药学院 临床药学系,四川 成都 610041;2.四川省医学科学院 四川省人民医院 药学部,四川 成都 610072)
目的 系统评价CYP2D6基因型与乳腺癌患者他莫昔芬及其活性代谢物血药浓度的关系。方法 计算机检索Cochrane图书馆、PubMed、EMBase、CNKI、CBM、Weipu Data、Wanfang Data等数据库,并手工检索相关文献,查找关于CYP2D6基因型与他莫昔芬及其活性代谢物血药浓度的文献。检索时间1995年1月~2014年10月。采用RevMan5.3软件进行meta分析。结果 共纳入4篇文献,包含438例研究对象。Meta分析结果显示,携带CYP2D6*10/*10基因型患者的他莫昔芬活性代谢物(HTAM、endoxifen)血药浓度明显低于携带其他基因型患者(P<0.0001);携带CYP2D6*10/*10基因型患者的他莫昔芬血药浓度低于携带CYP2D6Wt/Wt基因型患者(P<0.05)。而CYP2D6Wt/Wt及CYP2D6Wt/*10基因型携带患者间,TAM及其活性代谢物血药浓度比较,差异无统计学意义。结论 中国人群CYP2D6的基因多态型对乳腺癌患者体内他莫西芬及其代谢物的浓度有影响。
他莫昔芬;CYP2D6;meta分析;系统评价
他莫昔芬是由化学合成的非甾体抗雌激素类抗癌药,临床主要用于治疗晚期乳腺癌,在国外将本药列为绝经期妇女晚期乳腺癌姑息疗法的一线药物。而现阶段我国乳腺癌的临床治疗中,仍主要将雌激素受体(progesterone receptor,PR)作为乳腺癌内分泌治疗和预后评估的用药依据,极少考虑基因型对药物治疗的影响[1]。近年来,随着药物基因组学的发展,各项研究已明确编码药物代谢酶的基因多态性和他莫昔芬药效学的相关性[2]。
4-羟基他莫昔芬(HTAM)及内昔芬(endoxifen)是他莫昔芬发挥抗肿瘤作用的主要活性代谢产物[3-4]。CYP2D6*9、*10、*17、*29、*36、*41位点突变会导致酶活性降低,大量研究表明,在中国人群中,主要突变为CYP2D6*10,其突变率约为 37%~47%[2,5]。随着大量的研究发现,在临床治疗中,CYP2D6基因多态型所导致的治疗结果差异甚为明显,不同基因型和疗效之间的差异引起了医务工作者的关注[5]。因此,扩大样本量,客观地评价CYP2D6基因多态型与TAM及其活性物质(HTAM、endoxifen)血药浓度关系,更能为广大医务工作者合理用药提供参考。
1 资料与方法
1.1 纳入和排除标准
① 研究类型:国内外有关中国人群乳腺癌患者他莫昔芬血药浓度与CYP2D6基因多态性的研究、队列研究;②研究对象:接受他莫昔芬治疗乳腺癌的ER阳性患者,患者年龄不限,性别限定为女性,需接受CYP2D6基因多态性检测,检测方法不限;③干预措施:将患者按基因分型结果分为CYP2D6Wt/Wt,CYP2D6*10/Wt,CYP2D6*10/*10;④结局指标:TAM及其活性代谢产物(HTAM、endoxifen)血药浓度;⑤语种限制为中文或英文。
1.2 检索策略 以“tamoxifen,breast cancer,CYP2D6,Cytochromes,Cytochrome P-450 enzyme system,Genotype, Genes,Polymorphism”为英文检索词,计算机检索1995年1月~2014年10月Cochrane,PubMed,EMBase;以“他莫昔芬、他莫西芬、细胞色素P450酶、CYP2D6、基因型、基因多态性”为中文检索词,检索1995年1月~2014年10月中国知网、中国生物医学文献、维普、万方数据库。通过文献追溯的方式检索他莫昔芬和CYP2D6的相关论著、刊物以及综述的参考文献。同时,查阅相关会议摘要,公司资料和专家讲稿以收集未发表的文献。
1.3 文献质量评价
① 通过阅读文献标题、摘要,排除不符合纳入标准的试验。
② 采用STREGA工具对纳入的研究进行质量评价,包括:样本量是否充足;诊断标准是否明确;分组匹配是否清晰;研究组间是否具有可比性;基因检测方法是否合理;数据是否充分。
1.4 资料提取 由2名评价员独立按照上述标准独立纳入文献和提取资料,而后交叉核对,意见不一致时通过讨论解决。
1.5 统计学方法 采用 Review Manager 5.3软件进行meta分析。首先,采用χ2检验进行异质性检验,若试验结果不存在异质性时(P>0.05,I2<50% ),采用固定效应模型进行数据合并分析;若P<0.1,I2>50%,则采用随机效应模型分析,并对产生异质性的原因作进一步分析。通过剔除可能对分析结果产生重要影响的相关研究进行敏感性分析,以观察合并结果是否发生明显变化,进而判断结果的稳定性和强度。如纳入数据不能进行meta分析时,则进行描述性分析。
2 结果
2.1 检索及文献筛查 初检出404篇文献。通过阅读文题、摘要,排除综述、评论、病例报告和会议摘要等,纳入18篇文献。通过进一步阅读全文后,排除重复文献,非RCT及不符合纳入标准的文献后,最终纳入4篇文献,其中3篇中文,1篇英文文献,共438例乳腺癌患者。
2.2 纳入研究的基本特征和质量评价纳入研究的质量评价见表1,基本特征见表2。
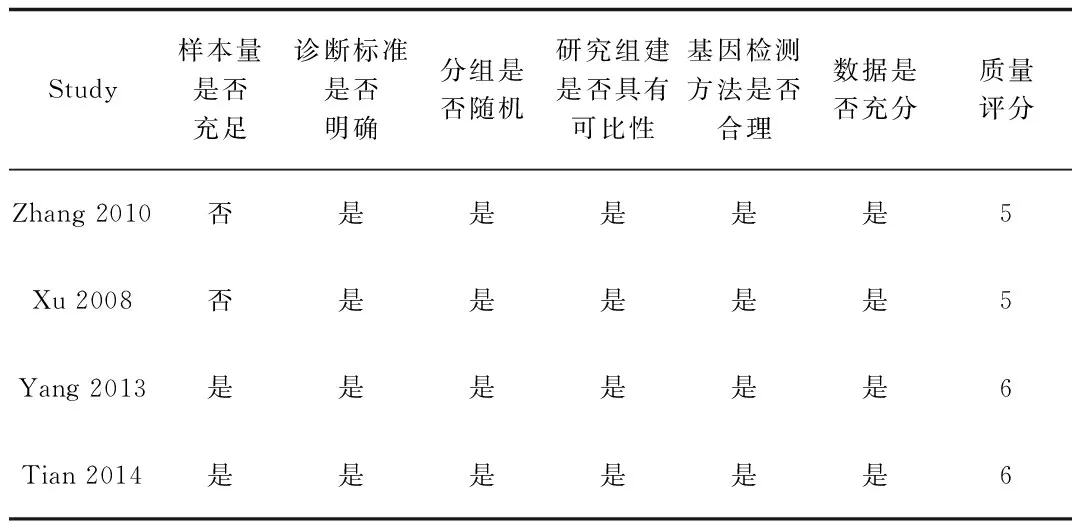
表1 纳入研究的质量评价Tab.1 Quality assessment of included studies

表2 纳入研究的基本特征Tab.2 Chatacteristics of included studies
2.3 Meta分析结果 不同CYP2D6基因型对乳腺癌患者他莫昔芬血药浓度关系的Meta分析结果见表3。
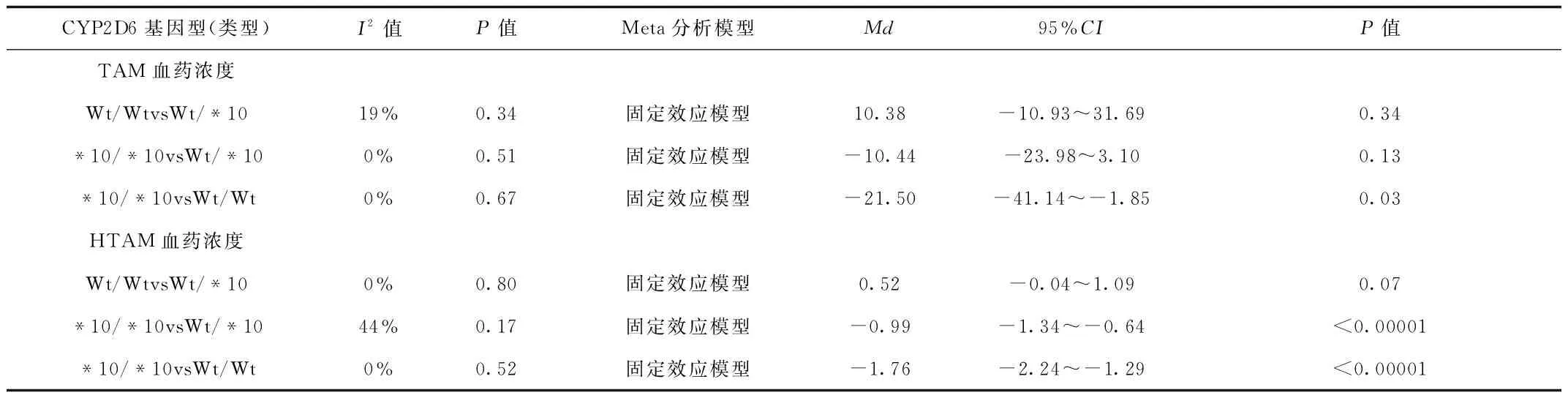
表3 不同CYP2D6基因型对乳腺癌患者他莫昔芬血药浓度关系的Meta分析Tab.3 Meta analysis of relationship between different CYP2D6 genotypes and concentration of tamoxifen in breast cancer patients
2.3.1 不同CYP2D6基因型对乳腺癌患者TAM血药浓度的关系:4篇[6-9]文献报道了CYP2D6基因型与TAM血药浓度的关系,共253例。异质性检验结果显示,各研究间差异无统计学意义,故采用固定效应模型进行meta分析。其结果显示:基因型Wt/WtvsWt/*10携带者,服用他莫昔芬后其TAM血药浓度差异无统计学意义,基因型*10/*10vsWt/*10携带者,服用他莫昔芬后其TAM血药浓度差异无统计学意义,基因型*10/*10vsWt/Wt携带者,服用他莫昔芬后其TAM血药浓度差异有统计学意义(P<0.05)。见图1。

图1 不同CYP2D6基因型对乳腺癌患者TAM血药浓度的关系的meta分析Fig.1 Meta analysis of relationship between different CYP2D6 genotypes and concentration of TAM in breast cancer patients
2.3.2 不同CYP2D6基因型对乳腺癌患者HTAM血药浓度的关系:3篇[6-9]文献报道了CYP2D6基因型与HTAM血药浓度的关系,共205例。异质性检验结果显示,各研究间不存在统计学差异,故采用固定效应模型进行meta分析。其结果显示:基因型Wt/WtvsWt/*10携带者,服用他莫昔芬后其血药浓度无显著性差异,基因型*10/*10与Wt/*10及Wt/Wt携带者相比,其服用他莫昔芬后,HTAM血药浓度差异显著,具有统计学意义(P<0.00001)。见图2、3。
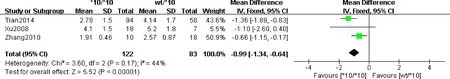
图2 CYP2D6*10/*10与CYP2D6 Wt/*10对乳腺癌患者HTAM血药浓度的关系的meta分析Fig.2 Meta analysis of relationship between CYP2D6*10/*10 and CYP2D6 Wt/*10and concentration of HTAM in breast cancer patients
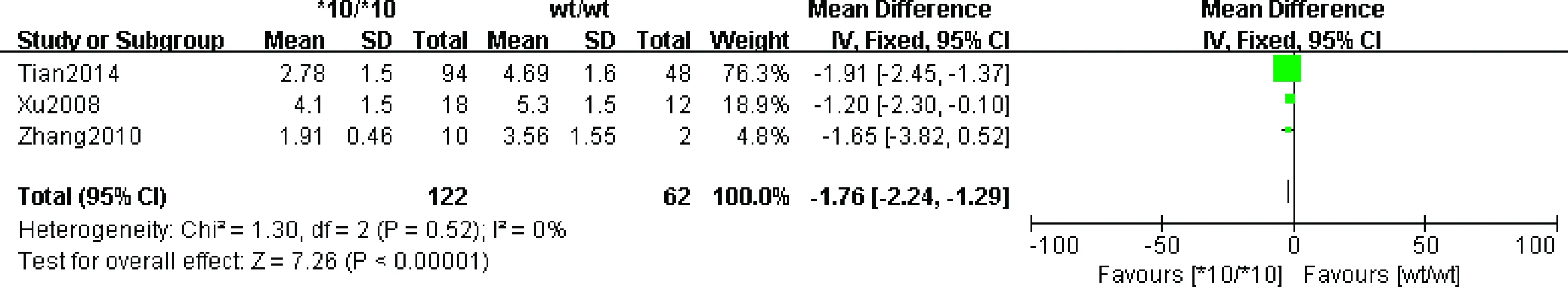
图3 CYP2D6*10/*10与CYP2D6 Wt/Wt对乳腺癌患者HTAM血药浓度的关系的meta分析Fig.3 Meta analysis of relationship between CYP2D6*10/*10 and CYP2D6 Wt/Wt and concentration of HTAM in breast cancer patients
2.3.3 不同CYP2D6基因型对乳腺癌患者endoxifen血药浓度的关系:仅1篇[9]文献报道了CYP2D6不同基因型乳腺癌患者Endoxifen血药浓度,由结果可知,CYP2D6*10/*10及CYP2D6Wt/*102组的血药浓度均明显低于CYP2D6Wt/Wt(P<0.01),但CYP2D6*10/*10vsCYP2D6Wt/*10之间的endoxifen血药浓度差异无统计学意义。
2.4 偏倚分析 以CYP2D6*10/*10vsWt/*10及CYP2D6*10/*10vsWt/Wt进行偏倚评估,漏斗图结果对称,提示发表偏倚较小,结果较为可靠。见图4、5。
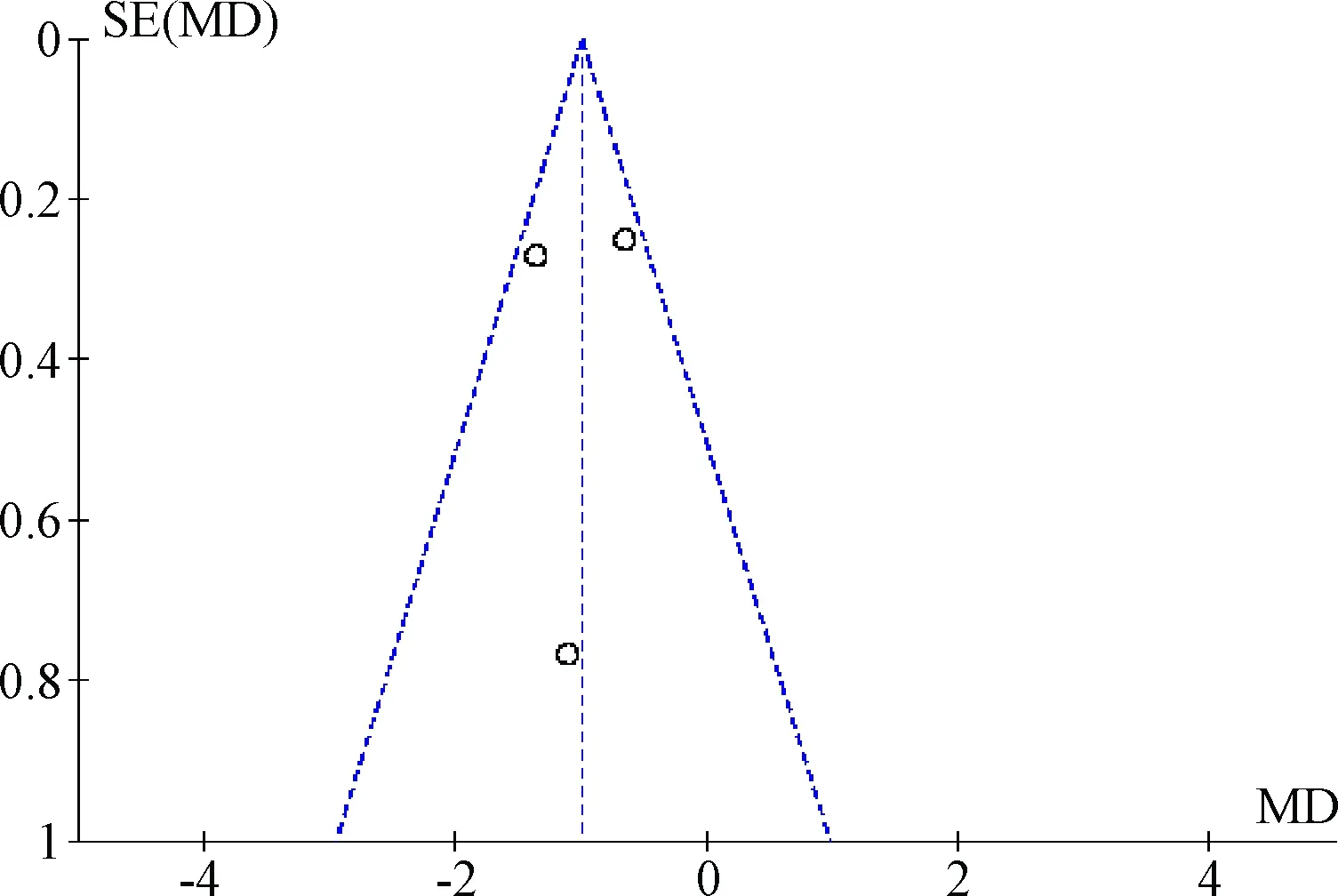
图4 CYP2D6*10/*10vsWt/*10发表偏倚评估的漏斗图Fig.4 Funnel plot for detecting publication bias of CYP2D6*10/*10vsWt/*10
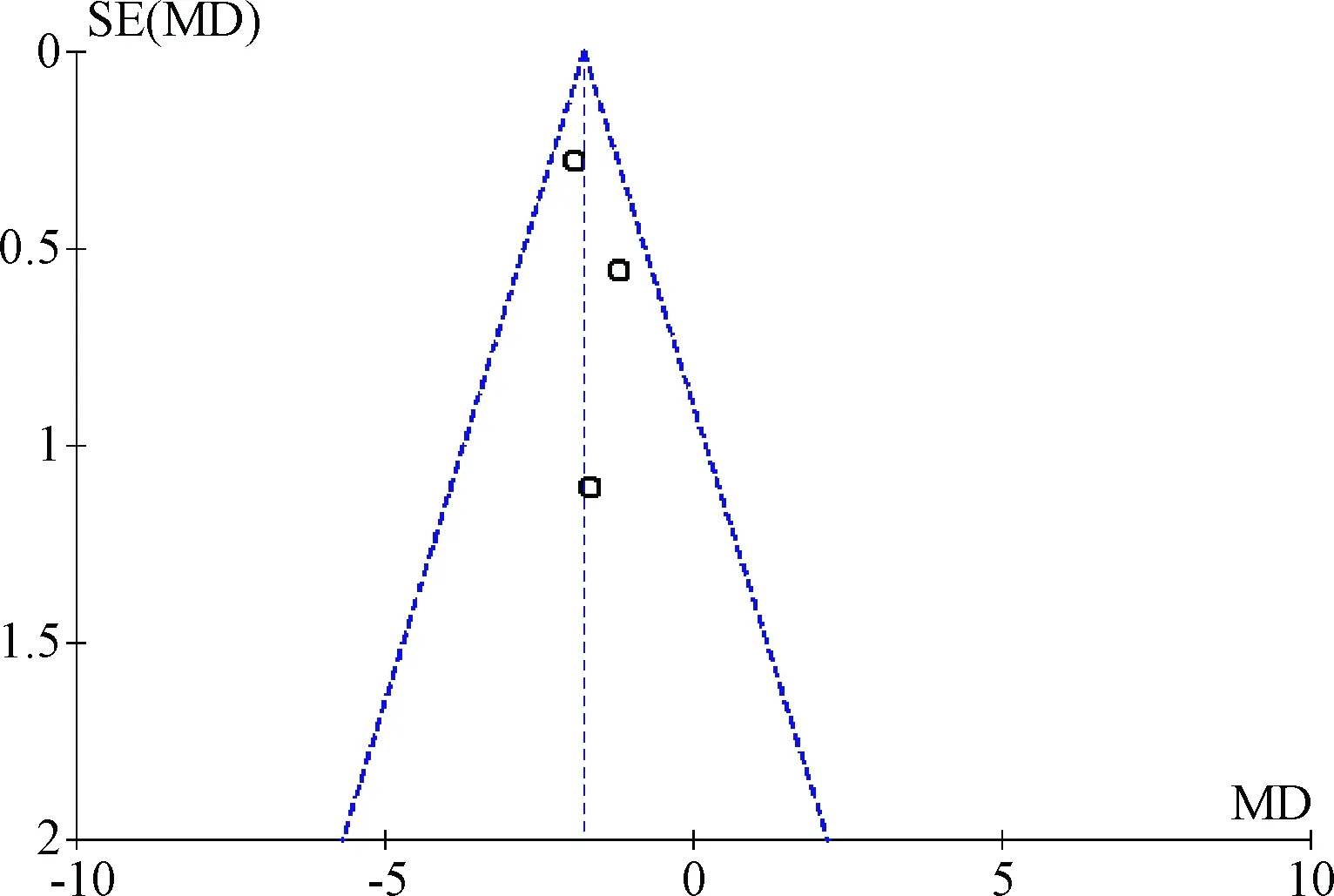
图5 CYP2D6*10/*10vsWt/Wt发表偏倚评估的漏斗图Fig.5 Funnel plot for detecting publication bias of CYP2D6*10/*10vsWt/Wt
3 讨论
他莫昔芬作为激素受体阳性乳腺癌的内分泌治疗“金标准”已经有30多年,其在人体内主要经过P450细胞色素酶4-羟基化和N-去甲基化。4-羟基化主要通过CYP2D6,生成的4-羟基化他莫昔芬(HTAM)的抗雌激素作用是他莫昔芬的30~100倍。另一主要代谢途径是他莫昔芬经CYP3A4、CYP3A5去甲基化,N-去甲基化使他莫昔芬进一步被CYP2D6氧化成为内昔芬(endoxifen),内昔芬与4-羟基他莫昔芬有相似的抗雌激素活性[5-6],所以,人体内代谢的HTAM及endoxifen的血药浓度与他莫昔芬的药效成正比,且均通过CYP2D6代谢。
本研究的结果提示,携带CYP2D6*10/*10基因分型的乳腺癌ER阳性患者,在进行他莫昔芬的内分泌治疗时,其体内代谢活性成分HTAM、endoxifen的血药浓度明显的较其他基因型携带患者低,同时TAM的血药浓度也低于野生基因型患者。*10 基因在国外相关文献中被定义为活性降低突变,抑制了CYP2D6酶的表达和活性[10]。但在携带1个*10的基因型中,CYP2D6酶的活性表达与野生基因型无统计学差异。
本研究存在一定的局限性:部分文献的样本量不够大,文献与文献间样本量差异较大;考虑*10基因型在中国人群中的分布特点,研究限制为中国人群,其余文献未被纳入,因此需要更多高质量、多中心、大样本的研究,以提供更高质量的结果;所有文献研究的结局指标未同时囊括2个活性成分,无法在相同样本中对其进行整体评价。
综上所述,目前的研究显示,在使用他莫昔芬治疗ER受体阳性的乳腺癌患者中,携带*10/*10基因型较携带Wt/Wt和Wt/*10基因型患者有较低的活性成分血药浓度。但本文仅分析了基因多态型与TAM及其活性代谢物HTAM、内昔芬血药浓度的关系,而药物疗效受到很多因素的影响,此仅为一个因素。而在一项多样本、多中心的荟萃分析[11]中,不同CYP2D6基因型乳腺癌患者服用他莫昔芬的DFS具有统计学意义的显著性差异,这与本研究结果较为一致。所以,临床工作者在运用他莫昔芬作为乳腺癌内分泌治疗药物时,对CYP2D6基因型检测可以作为个体化用药方案的依据,根据患者的遗传学情况使患者获得最大的药物疗效。
[1] Early Breast Cancer Trialists’ Collaborative Group (EBCTCG).Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival:an overview of the randomized trials[J].Lancet,2005,365( 9472) :1687-1717.
[2] Nowell SA,Ahn J,Rae JM,et al.Association of genetic variation in tamoxifen-metabolizing enzymes with overall survival and recurrence of disease in breast cancer patients[J].Cancer Res Treat,2005,91(3): 249-258.
[3] Dehal SS,Kupfer D.CYP2D6 catalyzes tamoxifen 4-hy-droxylation in human liver[J].Cancer Research,1997:3402-3406.
[4] 张磊,秦克旺.他莫西芬及其活性代谢物Endoxifen的研究进展[J].中华乳腺病杂志(电子版),2011,5(4):493-498.
[5] Schroth W,Antoniadou L,Fritz P,et al.Breast cancer treatment outcome with adjuvant tamoxifen relative to patient CYP2D6 and CYP2C19 genotypes[J].J Clin Oncol,2007,25(33):5187-5193.
[6] 张宇馨,李亚芬,陈冰,等.中国人CYP3A5和CYP2D6基因多态性与他莫昔芬及其活性代谢物血药浓度的相关性[J].中国药师,2010,13(9):1229-1232.
[7] 田超,杨义,李卉.CYP2D6基因多态性与他莫昔芬及4-羟基他莫昔芬血清浓度的相关性研究[J].四川医学,2014,35(1):4-6.
[8] Xu Y,Sun Y,Yao L,et al.Association between CYP2D6*10 genotype and survival of breast cancer patients receiving tamoxifen treatment[J].Ann Oncol,2008,19(8):1423-1429.
[9] 杨汐,罗波,吴斌.乳腺癌患者CYP2D6多态性与Endoxifen血药浓度的相关性分析[J].中华肿瘤防治杂志,2013,20(12):922-925.
[10] Kurose K,Sugiyama E,Saito Y.Population differences in majorfunctional polymorphisms of pharmacokinetics/pharmacodynam-ics-related genes in Eastern Asians and Europeans:implicationsin the clinical trials for novel drug development[J].Drug Metab Pharmacokinet,2012,27(1):9-54.
[11] Zeng Z,Liu Y,Liu Z,et al.CYP2D6 polymorphisms influence tamoxifen treatment outcomes in breast cancer patients:a meta-analysis[J].Cancer Chemother Pharmacol,2013,72(2):287-303.
(编校:王俨俨)
Meta-analysis of correlation between CYP2D6 polymorphisms and tamoxifen concentrations and its activity in Chinese breast cancer patients
XIONG Xuan1,2, ZHNAG Si-chao2, ZHU Chang-yu2
(1.Department of Clinical Pharmacy, West China School of Pharmacy Sichuan University, Chengdu 610041, China; 2.Department of Pharmacy, Sichuan Academy of Medical Sciences & Sichuan Provincial People’s Hospital, Chengdu 610072, China)
ObjectiveTo systematically review the correlation between polymorphisms of CYP2D6 genotypes and concentrations of tamoxifen and its activity in Chinese breast cancer patients.MethodsSuch databases as Cochrane Library, PubMed, EMBase, CNKI, CBM, WeipuData and WanfangDate,from January 1995 to October 2014 were searched on line for the studies about the correlation between polymorphisms of CYP2D6 genotypes concentrations of tamoxifen and its activity in Chinese breast cancer patients.And references about it were checked.The meta-analysis was performed with RevMan 5.3 software.ResultsA total of 4 articles involving 438 patients were included.The results of meta-analysis showed that,the concentrations of HTAM and endoxifen in patients who had CYP2D6*10/*10 genotypes were lower than the other genotypes(P<0.0001).The concentration of tamoxifen in patients who had CYP2D6*10/*10 genotypes was lower than CYP2D6Wt/Wt(P<0.05).There was no significant difference between CYP2D6Wt/Wt and CYP2D6Wt/*10.ConclusionWe concluded that CYP2D6 polymorphisms may influence concentrations of tamoxifen and its activity in Chinese breast cancer patients.
tamoxifen; CYP2D6; meta-analysis; systematic review
熊萱,女,硕士在读,研究方向:临床药学,E-mail:xiongyyx@163.com。
R968
A
1005-1678(2015)05-0077-04
