乌司他丁对悬浮红细胞储存期凋亡损伤的影响研究
2015-07-07刘定华姚允泰李立环黄春梅
刘定华,姚允泰,李立环,黄春梅
(1.重庆医科大学附属大学城医院 检验科,重庆 401331;2.中国医学科学院 北京协和医学院 国家心血管病中心阜外心血管病医院 麻醉科,北京 100037;3.中国医学科学院 北京协和医学院 北京协和医院 检验科,北京 100730)
乌司他丁对悬浮红细胞储存期凋亡损伤的影响研究
刘定华1,姚允泰2Δ,李立环2,黄春梅3
(1.重庆医科大学附属大学城医院 检验科,重庆 401331;2.中国医学科学院 北京协和医学院 国家心血管病中心阜外心血管病医院 麻醉科,北京 100037;3.中国医学科学院 北京协和医学院 北京协和医院 检验科,北京 100730)
目的 研究乌司他丁对储存期悬浮红细胞凋亡损伤的影响。方法 采集16名健康自愿者血液并按血库常规处理得悬浮红细胞,同一来源的4份悬浮红细胞中分别添加等量生理盐水(对照组)及5,000、10,000、50,000 U/mL的乌司他丁溶液(试验组C1、C2、C3),在储存0、7、14、21、28及35 d取样检测。使用流式细胞仪检测红细胞体积、磷脂酰丝氨酸(phosphatidylserine,PS)外翻率及细胞内Ca2+浓度。结果 各组红细胞PS外翻率均自14 d开始升高(P<0.05)。对照组及C1、C2组红细胞自21d开始明显缩小,而C3组红细胞体积直到28 d才明显缩小,但差异无统计学意义。对照组和C1组细胞内Ca2+浓度自35 d开始显著增高(t=16.33,t=14.66,P<0.05),而试验组细胞内Ca2+浓度均自14 d开始增高;而自21~35 d,C2及C3组细胞内Ca2+浓度与对照组相比,差异均无统计学意义。结论 在储存期内,悬浮红细胞发生凋亡损伤并随着时间延长而加剧,在储存液里添加适量乌司他丁可在一定程度上抑制凋亡损伤。
乌司他丁;悬浮红细胞;凋亡;储存
红细胞储存损伤是红细胞在储存期间受多种因素的影响而在形态、功能及生化特性等方面发生的有害变化,其会减低红细胞在受血者体内的存活率及运输和释放氧的能力、还可促进潜在的有害中间产物的产生,严重影响血液的质量及输注疗效,给临床输血带来安全隐患[1-2]。既往研究表明凋亡不仅见于有核细胞,还可见于成熟红细胞[3];红细胞在储存期间发生凋亡,也可能是红细胞储存损伤的原因之一[4-6]。
乌司他丁是从健康成年男性新鲜尿液中分离纯化出来的糖蛋白,具有广谱蛋白酶抑制活性[7],还可抑制溶酶体酶释放,清除氧自由基及抑制炎症介质释放。既往国外文献[8-11]报道,乌司他丁不仅对急性胰腺炎、休克等临床重症具有明确疗效,还可抑制悬浮红细胞在储存过程中发生溶血。然而,乌司他丁对红细胞凋亡损伤有无抑制或改善作用尚待研究。
本研究在悬浮红细胞储存液中添加适当浓度的乌司他丁,分析随储存时间延长红细胞凋亡损伤的发生情况,以探讨乌司他丁在临床输血安全方面的应用。
1 材料与方法
1.1 试剂和仪器 乌司他丁(广东天普生化医药股份有限公司);FITC -Annexin-V细胞凋亡检测试剂盒(美国Becton-Dickinson公司);Epics XL型流式细胞仪及配套荧光校准微球(美国Beckman-Coulter Immunotech公司);Fluo-3/AM钙离子荧光试剂、配制Fluo-3/AM工作液的二甲基亚砜(美国Sigma 公司)。
1.2 研究对象 征集16名健康自愿者,男9名,女7名,年龄23~42岁,采集每名自愿者血液200 mL,按照我国血站技术操作规程[12]采集、分离、处理血液得悬浮红细胞,同一来源红细胞分为4份(对照组及试验组),相应保存液中分别加入2.5 mL生理盐水及不同浓度乌司他丁生理盐水溶液,乌司他丁终浓度分别为5000 U/mL, 10000 U/mL及50000 U/mL(试验组C1、C2及C3)。所有悬浮红细胞均竖直储存于2 ℃~6 ℃,在储存期内于0、7、14、21、28及35 d等6个时点取样检测。以上均为无菌操作。本研究试验方案经阜外心血管病医院伦理委员会审查同意,按照赫尔辛基宣言和阜外心血管病医院人体研究指导原则,自愿者在采集血液前均签署知情同意书。
1.3 方法
1.3.1 红细胞PS外翻率及细胞大小:悬浮红细胞使用冷PBS洗涤2次后重悬于100 μL Annexin-V结合液,使细胞数为106个/mL。细胞悬液中加入5 μL FITC-Annexin-V,轻轻混匀后于室温避光放置15 min,最后加入400 μL Annexin-V结合液重悬后立即上机检测。流式细胞仪使用荧光微球校准光路,使其CV不超过2%,细胞悬液上机检测10,000个红细胞的前向散射光(forward scatter,FSC)及FL-1荧光信号(激发波长488 nm,发射波长525 nm),每管细胞悬液检测2次,取平均值,FSC代表红细胞体积,FL-1荧光信号代表PS外翻率。
1.3.2 细胞内Ca2+浓度:红细胞使用生理盐水洗涤2次后重悬于1 mL Ringer液,细胞浓度为106个/mL。细胞悬液中加入3 μL Fluo-3/AM工作液,充分混匀后于37 ℃避光放置15 min,再加入2 μL Fluo-3/AM 工作液,充分混匀后于37 ℃避光放置25 min,最后1,000 g、22 ℃离心5 min后,使用Ringer液洗涤2次并加入1 mL Ringer液重悬后立即上机检测。流式细胞仪使用荧光微球校准光路,使其CV不超过2%,细胞悬液上机检测10,000个红细胞的FL-1荧光信号,每管细胞悬液检测2次,取平均值。
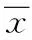
2 结果
2.1 悬浮红细胞PS外翻率 储存期各时点所取悬浮红细胞经流式细胞检测,PS外翻率随储存时间延长而增高,对照组PS外翻率由(0.11±0.01)%增高至(5.83±0.47)%。与0 d相比,对照组与各试验组均自14 d开始PS外翻率增高,差异有统计学意义(P<0.05)。对照组与C1、C2和C3组各时点PS外翻率差异均无统计学意义。见表1。

表1 储存期各时点红细胞PS外翻率(%,n=2)Tab.1 Analysis of storage-associated red blood cell PS exposure(%,n=2)
*P<0.05,同组内与时点0 d比较,compared with intra-group at day 0
2.2 悬浮红细胞体积 流式细胞术以FSC反映细胞体积大小。对照组悬浮红细胞FSC检测值自(539±22.5)降至(454.8±15.7),表明悬浮红细胞在储存期内体积逐渐缩小,但35 d与0 d相比,差异无统计学意义;C1、C2、C3组内比较,差异均无统计学意义。对照组与各试验组在储存期同一时点取样体积大小,差异无统计学意义。见表2。
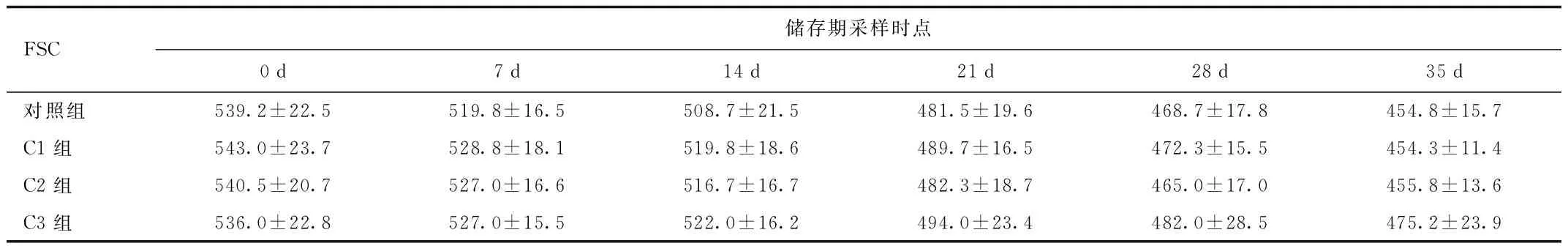
表2 储存期各时点红细胞体积大小(n=2)Tab.2 Analysis of storage-associated red blood cell volume(n=2)
2.3 悬浮红细胞胞内Ca2+浓度 Fluo-3/AM荧光阳性率与细胞内游离Ca2+浓度成正比,流式细胞检测结果,见表3。表3表明对照组悬浮红细胞胞内Ca2+浓度呈时间相关性增高(5.8±1.1)%增至(38.4±2.6)%,(t=16.33,P<0.05)。C1组悬浮红细胞胞内Ca2+浓度自35 d开始显著增高(t=14.66,P<0.05)。对照组与各试验组间的Ca2+浓度比较,差异无统计学意义。

表3 储存期各时点红细胞胞内Ca2+ 浓度(%,n=2)Tab.3 Analysis of storage-associated red blood cell intracellular Ca2+ concentration(%,n=2)
*P<0.05,同组内与时点0d比较,compared with day 0 (intra-group comparison)
3 讨论
悬浮红细胞是应用最为广泛的成分血液制品,用于补充血容量、改善器官组织缺氧、维持机体生命体征平稳。悬浮红细胞采集制备后常规储存期为35~42 d,随着储存时间的延长,红细胞发生一系列形态、生化特性及功能的有害改变,即红细胞储存损伤[3,13]。红细胞储存损伤可降低红细胞在受血者体内的存活率,可导致受血者急性肺损伤、多器官衰竭甚至死亡[1-2,13]。细胞凋亡是细胞主动的程序性死亡过程,长久以来凋亡被认为只发生于有核细胞,直到国外学者[3]提出与有核细胞有所区别的红细胞凋亡概念,其特征性改变为细胞皱缩、体积缩小及PS从细胞膜内侧翻转至外侧(即细胞膜表达PS)。红细胞凋亡可能是悬浮红细胞储存损伤的重要机制,但国内外对其的研究有限。
由于发生凋亡的红细胞膜PS外翻并且细胞体积缩小,因此检测红细胞膜PS外翻率及细胞FSC可反映红细胞凋亡率[14]。本研究利用FITC-Annexin-V荧光染色、使用流式细胞仪检测了不同储存时间悬浮红细胞体积及细胞膜PS外翻率,结果表明悬浮红细胞在储存期间发生凋亡性改变,细胞体积FSC由539.2±22.5降低至454.8±15.7,PS外翻率由(0.11±0.01)%增高至(5.83±0.47)%,储存早期凋亡不明显,储存中后期发生明显凋亡改变。此外,本研究检测了悬浮红细胞胞内Ca2+浓度,结果表明随着储存时间延长,悬浮红细胞胞内Ca2+浓度逐渐增高,由(5.8±1.1)%增高至(38.4±2.6)%,储存早期细胞内Ca2+浓度增高不明显,对照组和C1组的Ca2+浓度后期增高差异有统计学意义,其变化与悬浮红细胞储存期凋亡率增高表现出相似趋势。研究结果提示可能随着储存时间延长,红细胞氧化应激及细胞内ATP含量降低等因素导致红细胞Ca2+内流,进而刺激Ca2+敏感的K+通道,红细胞丢失K+后皱缩,而且红细胞内增多的Ca2+可刺激表达于细胞膜内侧的PS外翻至膜表面,致使红细胞膜磷脂成分不对称、细胞结构紊乱,终致红细胞进入凋亡程序[14-15]。由于PS外翻是细胞凋亡标志物,因此检测PS外翻率并结合FSC可对悬浮红细胞储存损伤进行有效评估[16]。
凋亡不仅可导致悬浮红细胞储存损伤,影响其结构及正常功能,而且输注红细胞由于外翻的PS被巨噬细胞表面PS受体识别而被吞噬清除,也降低了输注后红细胞存活率,因此本研究设想如果对悬浮红细胞凋亡进行干预,可能对红细胞储存损伤有所改善。乌司他丁是一种广谱的蛋白酶抑制剂,还可抑制溶酶体酶释放,清除氧自由基及抑制炎症介质释放,可抑制多种炎症前介质及细胞因子[7,17-18]。因其安全性及疗效,乌司他丁临床应用广泛,如改善手术刺激引起的免疫功能下降、蛋白代谢异常和肾功能降低,防止手术刺激引起的对内脏器官与细胞的损伤以及改善休克时的循环状态等[8-10]。此外,国外文献[11]报道在红细胞储存液中添加乌司他丁可抑制红细胞溶解。本研究在悬浮红细胞常规储存液中添加了不同浓度乌司他丁溶液,在不同储存时点取样检测红细胞膜PS外翻率、细胞大小及细胞内Ca2+浓度,结果表明储存中后期,对照组与C1,C2和C3组PS外翻率显著升高(P<0.05),而细胞体积在末期才明显缩小,各试验组细胞内Ca2+浓度改变均晚于对照组,对照组与C1组均自35 d开始,组内Ca2+浓度显著增高(t=16.33,t=14.66,P<0.05)。因此,在悬浮红细胞储存液中添加乌司他丁溶液可在一定程度上抑制红细胞凋亡、减少储存损伤,而乌司他丁添加量可能以终浓度50000 U/mL为宜。此外,乌司他丁是提取自人体尿液的糖蛋白,随悬浮红细胞输注入人体内应无毒害。
综上所述,悬浮红细胞体外储存期间发生凋亡损伤,其凋亡改变程度随储存时间延长而加剧,在悬浮红细胞常规储存液中添加适量的乌司他丁可在一定程度上抑制红细胞凋亡。本课题组将征集更多自愿者进一步研究红细胞凋亡机制及其与储存损伤的关系、乌司他丁最适宜的添加量及其效用机制,并开展动物体内实验进行验证。
[1] Isbister JP, Shander A, Spahn DR, et al. Adverse blood transfusion outcomes: establishing causation[J]. Transfus Med Rev,2011,25(2):89-101.
[2] Ho J, Sibbald WJ, Chin-Yee IH. Effects of storage on efficacy of red cell transfusion: when is it not safe[J].Crit Care Med,2003,31(2):S687-697.
[3] Lang F, Gulbins E, Lang PA, et al. Ceramide in suicidal death of erythrocytes[J]. Cell Physiol Biochem,2010, 26(1): 21-28.
[4] Lang KS, Lang PA, Bauer C, et al. Mechanisms of suicidal erythrocyte death[J]. Cell Physiol Biochem,2005,15(5):195-202.
[5] Kamel N, Goubran F, Ramsis N, et al. Effects of storage time and leucocyte burden of packed and buffy-coat depleted red blood cell units on red cell storage lesion[J]. Blood Transfus,2010, 8(4):260-266.
[6] Bosman GJ, Werre JM, Willekens FL, et al. Erythrocyte aging in vivo and in vitro: structural aspects and implications for transfusion[J]. Transfus Med, 2008,18(6):335-347.
[7] Karnad DR, Bhadade R, Verma PK, et al. Intravenous administration of ulinastatin (human urinary trypsin inhibitor) in severe sepsis: a multicenter randomized controlled study[J]. Intensive Care Med,2014,40(6):830-838.
[8] Chen S, Shi H, Zou X, et al. Role of ulinastatin in preventing post-endoscopic retrograde cholangiopancreatography pancreatitis: the Emperor’s New Clothes or Aladdin’s Magic Lamp[J].Pancreas,2010,39(8):1231-1237.
[9] Huang Y, Xie K, Zhang J, et al. Prospective clinical and experimental studies on the cardioprotective effect of ulinastatin following severe burns[J]. Burns,2008,34(5):674-680.
[10] Fang Y, Xu P, Gu C, et al. Ulinastatin improves pulmonary function in severe burn-induced acute lung injury by attenuating inflammatory response[J]. J Trauma,2011,71(5):1297-1304.
[11] Nishiyama T, Hanaoka K. Hemolysis in stored red blood cell concentrates: Modulation by haptoglobin or ulinastatin, a protease inhibitor[J]. Crit Care Med,2001,29(10):1979-1982.
[12] 中华人民共和国国家卫生和计划生育委员会,血站技术操作规程[M]. 2012:2-7.
[13] Doctor A, Spinella P. Effect of processing and storage on red blood cell function in vivo[J]. Semin Perinatol,2012,36(4):248-259.
[14] Kuypers FA, de Jong K. The role of phosphatidylserine in recognition and removal of erythrocytes[J]. Cell Mol Biol,2004,50(2):147-158.
[15] Fadok VA, Bratton DL, Rose DM, et al. A receptor for phosphatidylserine-specific clearance of apoptotic cells[J]. Nature,2000,405(6782):85-90.
[16] Bosman GJ, Cluitmans JC, Groenen YA, et al. Susceptibility to hyperosmotic stress-induced phosphatidylserine exposure increases during red blood cell storage[J]. Transfusion,2011,51(5):1072-1078.
[17] Zhang Y, Chen H, Li YM, et al. Thymosin alpha1- and ulinastatin-based immunomodulatory strategy for sepsis arising from intra-abdominal infection due to carbapenem-resistant bacteria[J]. J Infect Dis,2008,198(5):723-730.
[18] Nakanishi K, Takeda S, Sakamoto A, et al. Effects of ulinastatin treatment on the cardiopulmonary bypass-induced hemodynamic instability and pulmonary dysfunction[J]. Crit Care Med,2006,34(5):1351-1357.
(编校:王冬梅)
Effects of ulinastatin on storage-associated eryptosis of suspended erythrocytes
LIU Ding-hua1, YAO Yun-tai2Δ, LI Li-huan2, HUANG Chun-mei3
(1.Department of Clinical Laboratory, University-Town Hospital of Chongqing Medical University, Chongqing 401331, China; 2.Department of Anesthesiology, State Key Laboratory of Cardiovascular Diseases, Fuwai Hospital, National Center for Cardiovascular Diseases, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100037, China; 3.Department of Clinical Laboratory, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100730, China)
ObjectiveTo investigate influence of ulinastation in storage period on apoptosis of suspended erythrocyte.MethodsRBCs were treated with saline (control group) and different doses of ulinastatin (5,000, 10,000 and 50,000 U/mL in group C1, C2 and C3, respectively).samples were detected when stored at 0,7,14,21,28,35 d,respectively. Indicators of corpuscular volume,phosphatidylserine extroversion rate and intracellular Ca2+concentration were analyzed by flow cytometer.ResultsThe phosphatidylserine (PS)-exposure levels of 4 groups started to increase on 14 day(P<0.05). Cells of the control group, group C1 and C2 began to shrink remarkably on day 21, while that of Group C3 on 28 day. The intracellular Ca2+levels of the control group and group C1 started to increase significantly on day 35, (t=16.33,t=14.66,P<0.05).one Ca2+levels of group C1,C2 and C3 increased on day 14. From 21 to 35 day, the intracellular Ca2+levels of group C2 and C3 were no significant compared with control group.ConclusionDuring the storage period, suspended erythrocyteapoptosis increase with time prolonged, adding suitable amount of ulinastatin in stock solution can inhibit apoptosis in damage at some level.
ulinastatin; suspended erythrocyte; apoptosis; storage
国家自然科学基金(81200109);高校博士点教师基金(20121106120008);天普研究基金(01201012)
刘定华,女,硕士,助理研究员,研究方向:临床检验及应用,E-mail:dinghua_liu@126.com;姚允泰,通讯作者,男,博士,副主任医师,研究方向:血液保护、器官保护及临床麻醉,E-mail:yuntaiyao@126.com。
R333.1
A
1005-1678(2015)05-0021-04
