鸦葱总黄酮保肝作用的体内外研究
2015-07-07张天文谢扬张志王广树
张天文,谢扬,张志,王广树
(吉林大学 药学院,吉林 长春 130021)
鸦葱总黄酮保肝作用的体内外研究
张天文,谢扬,张志,王广树Δ
(吉林大学 药学院,吉林 长春 130021)
目的 探索鸦葱总黄酮在体内、体外的保肝作用。 方法 体内实验:ICR小鼠随机分为空白组、模型组、阳性药组、鸦葱总黄酮低、中、高剂量组,采用四氯化碳(CCl4)诱导急性化学性肝损伤模型和卡介苗+脂多糖诱导急性免疫性肝损伤模型,检测各组血清中天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、乳酸脱氢酶(lactate dehydrogenase,LDH)含量,光镜下观察肝脏结构变化。体外实验:原位胶原酶消化法提取分离Wistar大鼠肝细胞,采用四氯化碳诱导肝脏细胞损伤,鸦葱黄酮溶液干预培养细胞4 h后检测上清培养液中AST、ALT、LDH、一氧化氮(nitric oxide,NO)、超氧化物歧化酶(superoxide dismutase,SOD)和肝细胞丙二醛(malondialdehyde,MDA)含量。结果 在四氯化碳诱导急性化学性肝损伤和卡介苗+脂多糖诱导急性免疫性肝损伤2组模型中,HE肝脏病理切片显示鸦葱总黄酮组的肝损伤明显轻于模型组,模型组AST、ALT、LDH活性均显著高于空白组(P<0.01);阳性药组上述指标活性均显著低于模型组(P<0.01,P<0.05);鸦葱总黄酮低、中、高剂量组上述指标活性均显著低于模型组(P<0.01,P<0.05)。在四氯化碳诱导大鼠肝细胞损伤体外实验中,模型组AST、ALT、LDH、MDA、NO活性均显著高于空白组(P<0.01),SOD活性显著低于空白组(P<0.01);阳性药组AST、ALT、LDH、MDA、NO活性均显著低于模型组(P<0.05,P<0.01),SOD活性均显著高于模型组(P<0.01);鸦葱总黄酮低、中、高剂量组AST、ALT、LDH、MDA、NO活性均显著低于模型组 (P<0.05,P<0.01),SOD活性均显著高于模型组(P<0.05,P<0.01)。 结论 鸦葱总黄酮对四氯化碳诱导的小鼠化学性肝损伤、卡介苗+脂多糖诱导的小鼠免疫性肝损伤和大鼠肝细胞损伤有显著的保护作用,为开发和利用鸦葱资源、研制保肝新药提供了实验依据。
鸦葱;黄酮;肝损伤
鸦葱ScorzoneraaustriacaWild,菊科多年生草本植物,分布于中国的西北,东北地区。全草入药,具有清热解毒,活血消肿的功效。外用治疔疮,痈疽,毒蛇咬伤,蚊虫叮咬,乳腺炎等[1]。鸦葱中的主要化学成分有:黄酮、倍半萜、三萜、香豆素类化合物[2-8]。现代药理学研究表明鸦葱具有抗腹泻、抗炎、治疗由带状疱疹病毒引起的带状疱疹系水痘,治疗妊娠恶阻等作用[9-11]。民间鸦葱用来治疗肝炎,具有良好的效果。为开发和利用鸦葱药用资源,本课题组就鸦葱总黄酮的肝脏保护作用进行了探讨。
1 材料与方法
1.1 材料
1.1.1 实验动物:ICR小鼠144只,清洁级,28~30日龄,18~22 g,雌雄各半,由吉林大学白求恩医学院动物实验中心提供,合格证号:SCXK(吉)-2007-0003。雌性Wistar大鼠2只,清洁级,6~8周龄,150~180 g,由吉林大学白求恩医学院动物实验中心提供,合格证号:SCXK(吉)-2007-0003。本实验遵循《实验动物保护条例》。
1.1.2 药材:鸦葱药材采自于吉林省四平地区,经吉林大学药学院生药教研室张静敏教授鉴定为鸦葱ScorzoneraaustriacaWild。
1.1.3 主要药品及试剂: D-101型大孔树脂、D-4020型大孔树脂(天津农药股份有限公司树脂分公司);ALT、AST、SOD、MAD、SOD、NO试剂盒、HE染色试剂盒( 南京建成生物工程研究所);脂多糖、IV型胶原酶、台盼蓝(Sigma公司);卡介苗(长春生物制品所);联苯双酯(北京协和制药厂);1640培养液(hyclone公司);PBS(gibco公司);四季青胎牛血清(杭州天杭生物科技有限公司)。
1.1.4 实验仪器: TGL-16C离心机(上海安亭科学仪器厂;DNM-9602酶标仪(北京普朗有限公司);二氧化碳培养箱、无菌超净台(上海新苗医疗器械制造有限公司);BX51光学显微镜(日本OLYMPUS)。
1.2 方法
1.2.1 鸦葱总黄酮(total flavonoids in Scorzonera austriaca Wild,TFSA)的制备[2-3]:鸦葱全草5.4 kg,用70%的乙醇浸泡,共3次,每次7 d,收集鸦葱浸泡提取液,减压回收乙醇,然后上D-101大孔树脂色谱柱,先用水洗脱,除去色素、水溶性蛋白、糖类等杂质,用60%的乙醇溶液洗脱,收集洗脱液,减压回收乙醇,干燥,得鸦葱粗制黄酮提取物145 g。将粗制总黄酮上样到预先处理好的D4020大孔树脂色谱柱上,逐步用水、5%乙醇洗脱除去杂质,再用10%乙醇洗脱收集洗脱液,薄层色谱板监测,至出现黄酮时在10%~30%之间逐步加大乙醇的百分含量洗脱,薄层色谱板监测,洗脱至无黄酮出现为止,收集洗脱液,减压浓缩,干燥,得到精制鸦葱总黄酮71.5 g。
1.2.2 ICR小鼠四氯化碳诱导急性化学性肝损伤模型[12]:取ICR小鼠60只,随机分组空白组、模型组、阳性药组、鸦葱总黄酮低剂量组、中剂量组和高剂量组。鸦葱总黄酮低中高3组的灌胃剂量分别为:60、100、140 mg/kg,用0.5%的羧甲基纤维素钠水溶液配制。联苯双酯灌胃剂量为100 mg/kg。空白组和模型组用0.5%的羧甲基纤维素钠水溶液5 mL/kg灌胃,其余各组按给定剂量灌胃,每天1次,连续7 d。除空白组外,各组末次灌胃给药2 h后按照10 ml/kg腹腔注射0.1% CCl4橄榄油溶液,空白组腹腔注射橄榄油,复制急性四氯化碳小鼠肝损伤模型。以小鼠血清中AST、ALT的活性为评价指标,与空白组相比模型组显著升高,与模型组相比阳性药组显著降低为造模成功标准,差异性愈显著造模效果愈好,本实验造模成功率91%。
腹腔注射造模后禁食不禁水,待16 h后摘除眼球取血,于1.5 mL离心管中37 ℃水浴锅水浴30 min,5000 r/min离心10 min,吸取血清至无菌的1.5 mL离心管,根据试剂盒说明书检测小鼠血清中的AST、ALT、LDH的活性。
处死小鼠解剖分离其肝脏,将其放入预先配制好的10%的福尔马林溶液中固定,经梯度脱水、浸透、包埋、切片、染色、脱水透明等处理后在光学显微镜下观察并拍照。
1.2.3 ICR小鼠卡介苗+脂多糖诱导急性免疫性肝损伤模型[13-14]:实验分组同1.2.2。鸦葱总黄酮低、中、高3组的灌胃剂量分别为:80、160、240 mg/kg,用0.5%的羧甲基纤维素钠水溶液配制。阳性药组联苯双酯灌胃剂量为150 mg/kg。除空白组外,其余各组于首次灌胃给药前3 h尾静脉注射卡介苗2.5 mg/只(含5×106个菌),空白组尾静脉注射等同体积的生理盐水。空白组和模型组用0.5%的羧甲基纤维素钠水溶液5 mL/kg灌胃,其余各组按给定剂量灌胃,每天1次,连续12 d。除空白组外,其余各组末次灌胃给药2 h后按照10 μg/只的剂量尾静脉注射脂多糖,空白组尾静脉注射生理盐水,复制卡介苗+脂多糖诱导的小鼠免疫性肝损伤模型。
AST、ALT、LDH检查方法及HE染色切片同上。
1.2.4 四氯化碳诱导的体外大鼠肝细胞损伤模型:采用原位胶原酶消化法[15-17]分离肝细胞。Wistar大鼠禁食不禁水24 h,用2%的戊巴比妥钠溶液按照40 mg/kg的剂量腹腔注射麻醉,同时腹腔注射肝素钠溶液200 U/kg,消毒,仰卧位固定大鼠于固定板上,打开腹腔,游离出门静脉,用一次性输液器针头(1.2×19TWLB)插入门静脉,固定插入针头,连接无菌37 ℃预热的PBS溶液,剪断下腔静脉,以30 mL/min的速度灌流10 min至肝脏呈米黄色,以20 mL/min 0.05%的IV型胶原酶(PBS配制,浓度0.5 mg/mL)灌流10 min至肝脏松软无弹性,剪切肝脏周围的血管韧带分离出完整的肝脏于无菌平皿中,用PBS清洗肝脏表面3次,撕去肝包膜,轻轻震荡肝脏和平皿,肝细胞散落到4 ℃预冷的PBS溶液中,100目筛网过滤,得到肝细胞悬液,600 r/min离心肝细胞悬液1次,500 r/min离心肝细胞悬液2次,以洗去残余的红细胞,用培养液重悬肝细胞,台盼蓝排斥法测分离的肝细胞活力,最后用含10%胎牛血清和1%双抗(100000 U/L青霉素、100 mg/L链霉素)的1640完全培养液在平皿中培养。
肝细胞培养4 h后,换液,调整肝细胞密度为8×106个/mL,100 μL/孔接种到48孔板中,同时鸦葱总黄酮低、中、高3组和阳性药组分别加入药液100 μL,使鸦葱总黄酮低、中、高3组的终浓度分别为0.1、0.05、0.01 mg/mL,阳性药物联苯双酯的终浓度为0.01 mg/mL,空白组和模型组加入含10%胎牛血清的1640完全培养液100 μL,培养2 h。除空白组外各孔加入含CCl490 mmol/L的培养液100 μL使其终浓度为30 mmol/L,空白组加入100 μL 1640完全培养液,继续培养4 h。
收集各孔上清细胞培养液,4000 r/min离心5 min,取上清液按各自试剂盒说明书测定AST、ALT、LDH、NO、SOD的活性。
弃去细胞培养上清液,用细胞刮将细胞刮下,将细胞转移到无菌离心管,加提取液0.5 mL,混匀2 min,把细胞破碎制成悬液,按试剂盒说明书测定肝细胞中MDA含量。
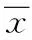
2 结果
2.1 ICR小鼠四氯化碳诱导急性化学性肝损伤和卡介苗+脂多糖诱导急性免疫性肝损伤中AST、ALT、LDH活性的测定结果 在2组模型中,与空白组相比,模型组AST、ALT、LDH活性均显著升高(P<0.01);与模型组相比阳性药组AST、ALT、LDH活性均显著降低(P<0.01,P<0.05),表明模型复制成功。与模型组相比,鸦葱总黄酮低、中、高剂量组AST、ALT、LDH活性均显著降低(P<0.01,P<0.05),说明鸦葱总黄酮对ICR小鼠四氯化碳诱导急性化学性肝损伤和卡介苗+脂多糖诱导急性免疫性肝损伤均有保护作用。见表1。
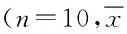
表1 鸦葱总黄酮对CCl4诱导及卡介苗+脂多糖诱导急性化学性肝损伤小鼠血清肝功能酶活性的影响±s,U/L)Tab.1 Effect of total flavonoids in Scorzonera austriaca Wild on serum ALT, AST and LDH after CCl4-and BCG+LPS-induced acute chemical liver injury in ±s,U/L)
*P<0.01,与空白组比较,compared with control group;#P<0.05,##P<0.01,与模型组比较,compared with
2.2 光镜下鸦葱总黄酮对ICR小鼠四氯化碳诱导急性化学性肝损伤和卡介苗+脂多糖诱导急性免疫性肝损伤的影响 空白组ICR小鼠肝小叶组织结构清晰,肝窦和肝细胞索排列整齐有序,肝细胞胞浆红染,核呈圆形居中,汇管区三管结构清晰可见,呈正常肝组织结构。
在ICR小鼠四氯化碳诱导急性化学性肝损伤模型中,模型组ICR小鼠个别肝细胞浊肿,大部分肝细胞呈坏死改变,细胞结构模糊不清,着色深浅不一,细胞核浓缩碎裂。阳性药组中央静脉周围的部分肝细胞浊肿,表现为细胞肿胀呈圆形,胞质着色浅,浊肿的肝细胞内可见大小数量不等的圆形空泡,应为脂肪变性所致。鸦葱总黄酮低剂量组中央静脉周围的肝细胞浊肿,表现为细胞肿胀呈圆形,胞质着色浅。鸦葱总黄酮中剂量组中央静脉周围的部分肝细胞浊肿,表现为细胞肿胀呈圆形,胞质着色浅,肝组织内单核细胞浸润多见。鸦葱总黄酮高剂量组中央静脉周围的部分肝细胞轻度浊肿,表现为细胞肿胀呈圆形,胞质着色浅,肝组织内单核细胞浸润多见。见图1。
在卡介苗+脂多糖诱导急性免疫性肝损伤模型中,模型组个别肝细胞肿大,细胞内有不规则无色区,为轻度水肿所致。阳性药组个别肝细胞肿大,细胞内有不规则无色区,为轻度水肿所致。鸦葱总黄酮低、中、高剂量组均与空白组一致。见图1

图1 鸦葱总黄酮对CCl4及卡介苗+脂多糖诱导急性化学性肝损伤小鼠肝脏组织结构的影响(HE染色,×200)Fig.1 The morphological changes of CCl4-and BCG+LPS-induced acute chemical hepatic injury (HE staining,×200)
2.3 鸦葱总黄酮对四氯化碳诱导的体外大鼠肝细胞损伤的保护作用 与空白组相比,模型组AST、ALT、LDH、MDA、NO活性均显著升高(P<0.01),SOD活性均显著降低(P<0.01);与模型组相比,阳性药组AST、ALT、LDH、MDA、NO活性均显著降低(P<0.05,P<0.01),SOD活性均显著升高(P<0.01),表明模型复制成功。与模型组相比,鸦葱总黄酮低、中、高剂量组AST、ALT、LDH、MDA、NO活性均显著降低(P<0.05,P<0.01),SOD活性均显著升高(P<0.05,P<0.01),说明鸦葱总黄酮对四氯化碳诱导的体外大鼠肝细胞损伤有保护作用。见表2。
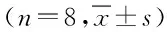
表2 鸦葱总黄酮对CCl4诱导大鼠肝细胞中AST、ALT、LDH、MDA、NO、SOD的影响Tab.2 Effect of total flavonoids in Scorzonera austriaca Wild on ALT, AST, LDH, MDA, NO, SOD in CCl4-induced rat hepatocyte injury ±s)
*P<0.01,与空白组比较,compared with control group;#P<0.05,##P<0.01,与模型组比较,compared with model group
3 讨论
本研究通过CCl4诱导小鼠化学性急性肝损伤、卡介苗+脂多糖诱导小鼠免疫性肝损伤等体内模型和大鼠肝细胞损伤体外模型,考察鸦葱总黄酮对肝脏的保护作用。在体内实验中,鸦葱总黄酮低、中、高剂量组小鼠血清中AST、ALT、LDH活力明显低于模型组(P<0.05,P<0.01),说明鸦葱总黄酮对四氯化碳造成的ICR小鼠化学性急性肝损伤和卡介苗+脂多糖诱导小鼠免疫性肝损伤均有良好的保护作用。在CCl4诱导小鼠化学性急性肝损伤模型中,HE肝脏病理切片显示鸦葱总黄酮组的肝损伤明显轻于模型组,表明鸦葱总黄酮对小鼠化学性急性肝损伤具有良好的保护作用;而在介苗+脂多糖诱导小鼠免疫性肝损伤模型中,HE肝脏病理切片显示鸦葱总黄酮组的肝肝已经恢复到同空白对照一样的状态,表明鸦葱总黄酮对小鼠免疫性肝损伤有显著的保护作用。本实验成功提取并培养了大鼠原代肝细胞,实验结果表明鸦葱总黄酮能显著降低CCl4损伤的肝细胞细胞培养液中AST、ALT、LDH、NO、MDA的含量(P<0.05,P<0.01),抑制培养液中SOD活力的降低(P<0.05,P<0.01)说明鸦葱总黄酮对CCl4诱导的体外大鼠肝细胞损伤有显著的保护作用。
肝损伤多数是由于外界或体内的有毒物质聚集于肝脏,对肝脏的功能造成一定的损伤,严重的情况下会导致肝纤维化甚至肝癌的发生。肝损伤可分为化学性损伤机制和免疫性损伤机制2大类。化学性损伤主要由外来的一些有毒物质或者药物导致机体内的自由基过多,进而造成脂质过氧化,损伤细胞膜结构;免疫反应在肝损伤发病机制中起着十分重要的作用特别是乙肝病毒导致的肝功损害和自身免疫性肝细胞损伤[18]。本实验采用CCl4诱导小鼠化学性急性肝损伤模型和体外大鼠肝细胞损伤模型,初步证明了鸦葱总黄酮对肝脏化学性损伤的保护作用。卡介苗+脂多糖诱导小鼠免疫性肝损伤模型与人类慢性肝炎的病理过程相似,以肉芽肿性炎症侵润、弥漫性肝细胞炎性反应甚至坏死为病理特征,是一种典型的免疫性肝损伤,与人类免疫紊乱导致的肝损伤相似,同时在一定程度上还可以反映乙肝病毒HBV导致的肝细胞损伤机制[19-21]。实验结果表明鸦葱总黄酮对免疫性肝损伤有显著的改善作用。本实验从化学性肝损伤和免疫性肝损伤2方面初步证明了鸦葱总黄酮保肝作用,在研制治疗肝炎的新药方面具有重要意义。
[1] 国家中医药管理局《中华本草》编委会.中华本草[M].第一版.上海:上海科学技术出版社,1999:4,939.
[2] 李泉妙,王广树.鸦葱中黄酮苷类成分的提取分离与结构鉴定[J].吉林大学学报(医学版),2010,36(1):10-12.
[3] 何琭.鸦葱中黄酮类化合物的研究[D].吉林大学,2012.
[4] Jiang TF,Wang,YH,Lv ZH,et al.Determination of kava lactones and flavonoid glycoside in Scorzonera austriaca by capillary zone electrophoresis[J].J Pharm Biomed Anal,2007,43(3):854-858.
[5] Wu QX,Su YB,Zhu Y.Triterpenes and steroids from the roots of Scorzonera austriaca[J].Fitoterapia,2011,82(3):493-496.
[6] Zhu Y,Hu PZ,He ZW,et al.Sesquiterpene Lactones from Scorzonera austriaca[J].J Nat Prod,2010,73(2):237-241.
[7] Zhu Y,Wu QX,Hu PZ,et al.Biguaiascorzolides A and B:Two novel dimeric guaianolides with a rare skeleton,from Scorzonera austriaca[J].Food Chem,2009,114(4):1316-1320.
[8] Li J,Wu QX,Shi YP,et al.A new sesquiterpene lactone from Scorzonera austriaca [J].Chin Chem Lett,2004,15(11):1309-1310.
[9] 李佩珍,胡慧娟,吴文庆.鸦葱对肠炎的影响[J].中国药科大学学报,1992,23(6):357-360.
[10] 田宝俊,许红,马艳峰.鸦葱白汁外敷治疗带状疱疹28例[J].中国民间疗法,2004,12(4):21.
[11] 李玉景,邵明贤,赵成春.鸦葱治疗妊娠恶阻88例[J].中国民间疗法,1997,4:13.
[12] 王煜,张爱芸,张旭,等.水飞蓟宾磷脂酰胆碱复合物与水飞蓟宾对四氯化碳所致的小鼠肝损伤的保护作用比较[J].中国生化药物杂志,2015,35(1):71-73.
[13] Xin XL,Yang WJ,Yasen M,et al.The mechanism of hepatoprotective effect of sesquiterpene rich fraction from Cichorum glandulosum Boiss.et Huet on immune reaction-induced liver injury in mice [J].J Ethnopharmacol,2014,155(2):1068-1075.
[14] Hong T,Dong M,Gao Y,et al.Hepato-protective Effect of Polysaccharides Extracted from Inula Britannica Flower for Mice[J].Chem Res Chin Univ,2012,28(6):1026-1030.
[15] Lee JH,Park JH,Park HJ,et al.Cryopreservation of Immobilized Rat Hepatocytes for the Development of a Bioartificial Liver System[J].Transplant Proc,2012,44(4):1005-1008.
[16] Papeleu P,Vanhaecke T,Henkens T,et al.Isolation of rat hepatocytes[J].Methods Mol Biol(Clifton,N.J.),2006,320:229-237.
[17] Seglen PO.Preparation of rat liver cells.Ⅲ.Enzymatic requirement for tissue dispersion[J].Exp Cell Res,1973,82(2):391.
[18] 田梦曦,刘文兰.肝损伤中药治疗研究进展[J].辽宁中医药大学学报,2015,17(4):125-129.
[19] 郭凤霞,曾阳,陈振宁,等.丝毛飞廉总黄酮对小鼠免疫性肝损伤的保护作用[J].华西药学杂志,2012,27(3):292-294.
[20] 项瑞望,李颖,张春,等.卡介苗和脂多糖致小鼠免疫性肝损伤时血清GST的变化规律[J].武汉大学学报:医学版,2002,23(4):331.
[21] 黄兰蔚,徐列明.细胞自噬在肝脏疾病中的作用[J].临床肝胆病杂志,2014,30(2):186-188.
(编校:王俨俨,谭玲)
Study on hepatoprotective effects of total flavonoids inScorzoneraaustriacaWild in vivo and in vitro
ZHANG Tian-wen, XIE Yang, ZHANG Zhi, WANG Guang-shuΔ
(School of Pharmaceutical Sciences, Jilin University, Changchun 130021, China)
ObjectiveTo investigate the hepatoprotective effects of total flavonoids inScorzoneraaustriacaWild (TFSA) in vivo and in vitro.MethodsIn vivo, ICR mice were randomly divided into negative, model, positive, TFSA’s low-dose, medium-dose and high-dose groups,and acute chemical liver injury models were constructed with CCl4and acute autoimmune liver injury models with Bacillus Calmette-Guerin vaccine (BCG ) and lipopolysaccharide (LPS).The activity of serum aspartate aminotransferase (AST), alanine aminotransferase (ALT), lactate dehydrogenase (LDH) was detected and liver tissue was used as biopsy.In vitro, liver cells of Wistar rat were extracted and isolated by orthotopic collagenase digestion method, and liver cell damage was induced with CCl4.Then the liver cells were cultured with TFSA solution and the contents of AST, ALT, LDH, nitric oxide (NO), superoxide dismutase (SOD) in the supernatant and malondialdehyde (MDA) in rat hepatocyte were detected.ResultsThe results of CCl4-and BCG+LPS-induced acute chemical liver injury models in mice showed that there were less microstructures damage of liver tissue in TFSA groups compared with model group in liver pathological sections (HE), AST, ALT and LDH levels in model group were significantly higher than those in negative group (P<0.01), the above indexes in positive drug group were significantly lower than those in negative group (P<0.01,P<0.05), and the above indexes in TFSA’s low-dose, medium-dose and high-dose groups were significantly lower than those in model group(P<0.01,P<0.05). The results of CCl4-induced rat hepatocyte injury in vitro showed that AST, ALT, LDH, MDA and NO levels were significantly higher and SOD level was lower in model group than those in negative group (P<0.01), AST, ALT, LDH, MDA and NO levels were significantly lower and SOD level was higher in positive drug group than those in model group (P<0.01,P<0.05), and AST, ALT, LDH, MDA and NO levels were significantly lower and SOD level was higher in TFSA’s low-dose, medium-dose and high-dose groups were significantly lower than those in model group(P<0.01,P<0.05).ConclusionTFSA have hepatoprotective effects on CCl4-induced chemical liver injury and BCG+LPS-induced immune liver injury in mice, and rat hepatocyte damage.This study provides experimental data for the development and utilization ofScorzoneraaustriacaWild resources and new hepatoprotective medicines.
ScorzoneraaustriacaWild; flavonoids; liver damage
国家科技重大专项重大新药创制(2013ZX09103002-007)
张天文,男,硕士,研究方向:中草药有效成分的研究,E-mail:UFOzhangtianwen@163.com;王广树,通讯作者,男,博士,教授,博士生导师,研究方向:中草药有效成分的研究,E-mail:wgs@jlu.edu.cn。
R944.9
A
1005-1678(2015)05-0006-05
