乳腺癌细胞蛋白质O-GlcNAc糖基化水平与紫杉醇抗肿瘤作用的关系研究
2015-07-07张肖冰李慧王凤山师以康
张肖冰,李慧,王凤山,师以康
(山东大学 药学院/国家糖工程技术研究中心,山东 济南 250012)
乳腺癌细胞蛋白质O-GlcNAc糖基化水平与紫杉醇抗肿瘤作用的关系研究
张肖冰,李慧,王凤山,师以康Δ
(山东大学 药学院/国家糖工程技术研究中心,山东 济南 250012)
目的 研究紫杉醇对乳腺瘤细胞蛋白质O-GlcNAc糖基化水平的影响及其机制,探讨蛋白质O-GlcNAc糖基化水平变化对紫杉醇抗肿瘤活性的影响。方法 使用Western blot检测紫杉醇对乳腺癌细胞蛋白质O-GlcNAc糖基化水平及多种相关酶蛋白表达水平的影响;RT-qPCR检测紫杉醇对N-乙酰氨基葡萄糖苷酶(β-N-acetylglucosaminidase, OGA)和N-乙酰氨基葡萄糖转移酶(β-N-acetylglucosaminyltrans-fevase,OGT)mRNA水平的影响;采用OGA/OGT抑制剂PUGNAc/alloxan改变蛋白质O-GlcNAc糖基化水平,磺基罗丹明B法测定紫杉醇对肿瘤细胞增殖的影响。结果 紫杉醇可诱导乳腺癌细胞MDA-MB-231蛋白质O-GlcNAc糖基化水平升高(P<0.05),且具有时间和浓度依赖性;紫杉醇还可同时诱导OGA和OGT mRNA和蛋白水平的升高(P<0.05),且具有浓度依赖性;采用OGA的抑制剂PUGNAc提高蛋白质O-GlcNAc糖基化水平后,细胞对紫杉醇的敏感性升高;采用OGT的抑制剂alloxan降低蛋白质O-GlcNAc糖基化水平后,细胞对紫杉醇的敏感性降低。结论 紫杉醇可诱导蛋白质O-GlcNAc糖基化水平升高,蛋白质O-GlcNAc糖基化水平的改变也会影响乳腺癌细胞对紫杉醇的药物敏感性。
O-GlcNAc糖基化;紫杉醇;N-乙酰氨基葡萄糖苷酶;N-乙酰氨基葡萄糖转移酶
糖基化的蛋白质按照糖与氨基酸的连接方式主要分为以下几种:N-糖基化、O-糖基化、GPI锚定连接、糖胺聚糖以及 O-GlcNAc 糖基化。O-GlcNAc糖基化蛋白质分布于细胞质和细胞核,其他几个种类的糖基化蛋白质主要分布于细胞膜上。O-GlcNAc糖基化修饰是指单个的N-乙酰氨基葡萄糖胺(N-acetylglucosamine,GlcNAc)以O-糖苷键连接在蛋白质的丝氨酸或苏氨酸的羟基氧原子上。蛋白质O-GlcNAc糖基化生物过程是由N-乙酰氨基葡萄糖苷酶(β-N-acetylglucosaminidase,OGA)和N-乙酰氨基葡萄糖转移酶(β-N-acetylglucosaminyltransferase,OGT)共同调控来完成的。蛋白质O-GlcNAc糖基化广泛参与细胞的基因转录、蛋白翻译及加工、信号传导、细胞应激反应等多种生命活动[1]。肿瘤组织中蛋白质O-GlcNAc糖基化水平显著升高,O-GlcNAc糖基化水平和肿瘤的发生、进展和预后密切相关[2-3]。然而,细胞毒类药物对蛋白质O-GlcNAc糖基化水平是否产生影响及改变蛋白质O-GlcNAc糖基化水平是否影响肿瘤细胞对药物的敏感性等,国内外尚未见报道。本研究旨在通过阐述O-GlcNAc糖基化和紫杉醇的相互作用,以期为提高紫杉醇的抗肿瘤活性提供新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞:乳腺癌细胞株MDA-MB-231为本实验室保存。
1.1.2 主要试剂:逆转录试剂盒和Real time PCR Master Mix(SYBR Green)购自上海东洋纺(TOYOBO)生物科技有限公司。Trizol购自Invitrogen公司。GADPH、OGA和OGT的引物均由上海Invitrogen公司合成。O-GlcNAc糖基化蛋白抗体CTD110.6、OGA抗体、OGT抗体、HRP标记的抗鸡IgY抗体、HRP标记的抗小鼠IgM、OGT抑制剂alloxan、OGA抑制剂PUGNAc均购自美国Sigma公司。己糖激酶(HK2)抗体和丙酮酸激酶(PKM2)抗体均购自CST。谷氨酰胺6-磷酸果糖氨基转移酶1(GFAT1)抗体、6-磷酸果糖激酶1(PFK1)抗体、葡萄糖转运蛋白(GLUT1)抗体和actin抗体购自Santa Cruz公司。HRP标记的抗兔IgG购自北京中杉金桥生物有限公司。蛋白Marker购自Thermo公司。
1.2 方法
1.2.1 细胞培养:MDA-MB-231细胞采用含10%胎牛血清的RPMI1640培养基常规培养并传代。
1.2.2 Western blot法检测不同浓度紫杉醇和不同处理时间对细胞蛋白质O-GlcNAc糖基化修饰水平及其合成相关酶表达:取对数生长期的乳腺癌细胞MDA-MB-231,以4×105个/皿接种于60 mm的细胞培养皿中,培养24h后,分别加入浓度为0.1、1、10 μM的紫杉醇,每组共设3个平行孔,以完全培养基(0 μM紫杉醇)为空白对照,于37 ℃、5%CO2条件下培养48 h后提取细胞总蛋白;或者均加入1 μM的紫杉醇,分别于加药后3、6、12、24、48、72 h提取细胞总蛋白(以0 h为空白对照)。采用BCA蛋白定量试剂盒测定蛋白浓度。进行聚丙烯酰胺凝胶电泳,恒压180 V电转100 min将蛋白质转移到PVDF膜上,5%脱脂奶粉封闭2 h,加入各指标相应的抗体,4℃孵育过夜,TBST洗膜后,加入相应HRP标记的二抗,37 ℃孵育1 h,TBST洗膜,化学发光法显色。采用同样的方法测定添加不同浓度OGA抑制剂PUGNAc(10、50、100 μM)或者OGT抑制剂alloxan(1、5、10 mM)对乳腺癌细胞蛋白质O-GlcNAc糖基化水平的影响。Western blot测定的蛋白质O-GlcNAc糖基化是样品中所有O-GlcNAc糖蛋白的总体水平,其灰度值代表所有糖基化蛋白质O-GlcNAc修饰的总体程度。蛋白条带的灰度值使用Alph Ease FC软件进行处理获得。
1.2.3 RT-qPCR法检测细胞OGA和OGT的mRNA水平:取对数生长期的乳腺癌细胞MDA-MB-231,以1×105个/皿接种于6孔板中,培养24 h后,分别加入浓度为0.1、1、10 μM的紫杉醇,每组共设3个平行孔,以完全培养基(0 μM紫杉醇)为空白对照。于37 ℃、5%CO2条件下培养24 h后,通过Trizol法提取每组细胞的总RNA。按照逆转录试剂盒和Real time PCR Master Mix(SYBR Green)试剂盒说明书进行逆转录和PCR扩增。OGA、OGT及GADPH基因的引物分别如下:OGA上游引物:5′-GAAGGAGAGTCAAG-CGACGTT-3′,OGA下游引物:5′-TCCATAACCCAAGGTCTTCCAT-3′;OGT上游引物:5′-TCCTGATTTGGTACTGTGTTCGC-3′,OGT下游引物:5′-AAGC-TACTGCAAAGTTCGGTT-3′;GADPH上游引物:5′-GGAG-CGAGATCCCTCCAAAAT-3′,GADPH下游引物:5′-GGCTGTTGT-CATACTTCTCATGG-3′。qPCR反应程序:95 ℃,30 s;PCR循环(×40循环):95 ℃,5 s;57 ℃,10 s;72 ℃,15 s。
1.2.4 磺基罗丹明B(SRB)法检测紫杉醇对细胞的增殖抑制作用:取对数期生长的乳腺癌细胞,以2000个/孔接种到96孔板中,每孔中加入200 μL细胞培养基。培养24 h后,分别加入不同浓度的紫杉醇(0.1、1.0、10 μM)处理,每组共设3个平行孔,以完全培养基(0 μM紫杉醇)为空白对照,加药处理48 h后,用三氯乙酸固定、0.4%SRB溶液、100mM Tris(pH 10.5)处理,酶标仪检测OD540值,计算细胞存活率。采用同样方法测定添加不同浓度OGA抑制剂PUGNAc(10、50、100 μM)或OGT抑制剂alloxan(1、5、10 mM)对肿瘤细胞增殖抑制的影响。
2 结果
2.1 紫杉醇对乳腺癌细胞蛋白质O-GlcNAc糖基化水平及其合成相关酶表达水平的影响 Western blot结果显示,紫杉醇诱导蛋白质O-GlcNAc糖基化水平升高,并具有浓度依赖性(P<0.01);OGA和OGT的表达随紫杉醇浓度升高明显升高(P<0.01);HK2和GFAT1表达也明显升高(P<0.01);PFK1、PKM2和GLUT1蛋白表达差异无统计学意义,见图1。使用1.0 μM的紫杉醇处理MDA-MB-231细胞不同时间,结果显示蛋白质O-GlcNAc糖基化水平不断升高(P<0.05,P<0.01),具有时间依赖性。紫杉醇诱导72 h后OGA和OGT仍处于最高表达水平(P<0.01);HK2和GFAT1表达随时间明显升高(P<0.01),PFK1、PKM2和GLUT1的蛋白表达水平随时间差异无统计学意义,见图2。

图1 不同浓度紫杉醇对MDA-MB-231细胞蛋白质O-GlcNAc糖基化及其合成相关酶表达水平的影响(n=3)*P<0.01,与0 μM Taxol处理组比较Fig.1 Effects of different Taxol concentrations on the expressions of protein O-GlcNAcylation and enzymes related to its biosysthesis in breast cancer cell MDA-MB-231(n=3)*P<0.01, compared with 0 μM Taxol treatment group
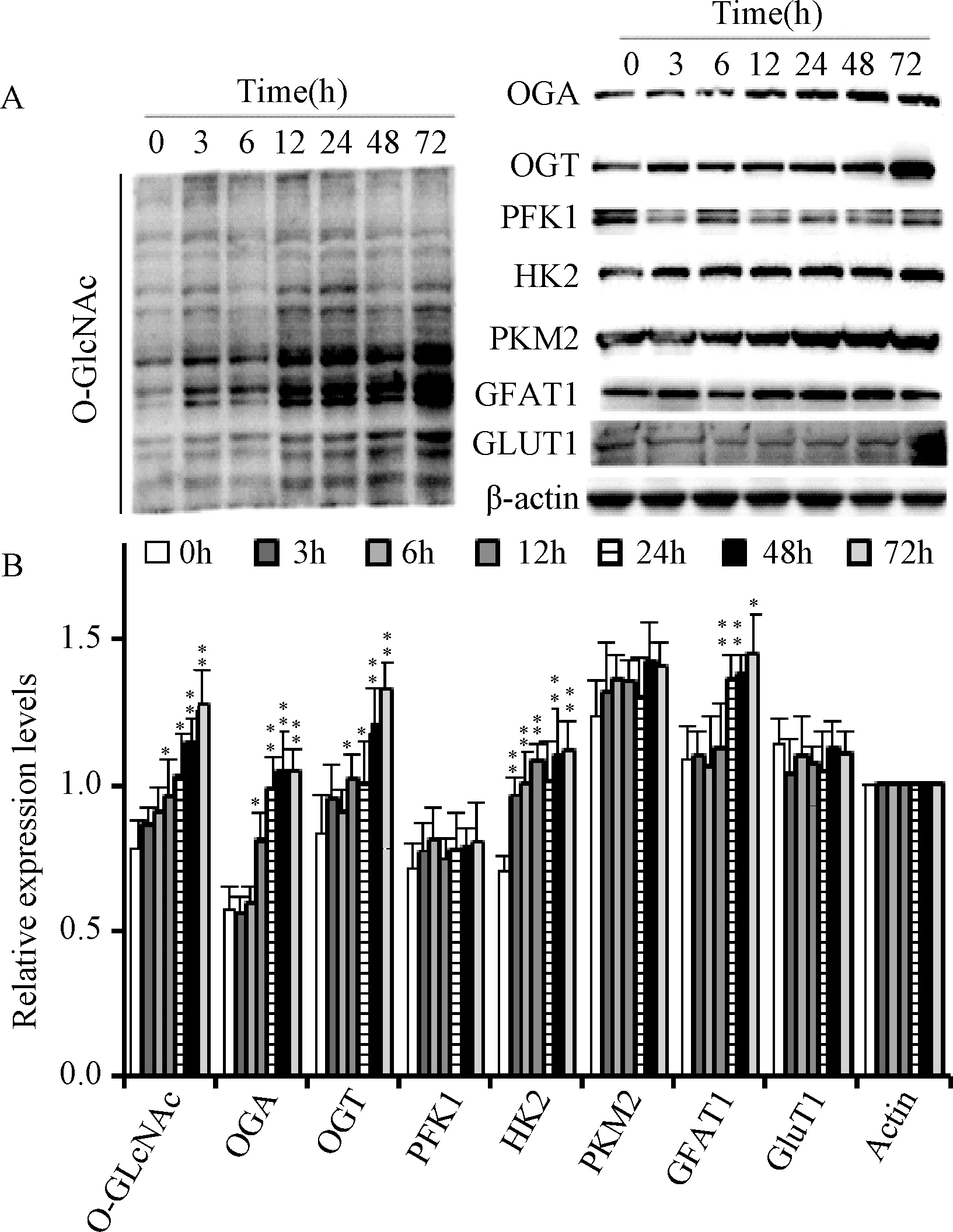
图2 紫杉醇处理不同时间对MDA-MB-231细胞蛋白质O-GlcNAc糖基化及其合成相关酶表达水平的影响(n=3)*P<0.05,**P<0.01,与0 h处理组比较Fig.2 The time-course effect of Taxol on the expressions of protein O-GlcNAcylation and enzymes related to its biosysthesis in breast cancer cell MDA-MB-231(n=3)*P<0.05,**P<0.01,compared with 0h Taxol treatment group
2.2 不同浓度紫杉醇对OGA和OGT mRNA水平的影响 RT-qPCR结果显示,不同浓度紫杉醇处理MDA-MB-231细胞 24 h 后,OGA和OGT的mRNA水平均逐渐升高,具有浓度依赖性;且OGA mRNA升高的程度明显高于OGT(P<0.05),见图3。

图3 不同浓度紫杉醇对MDA-MB-231细胞OGA和OGT mRNA水平的影响(n=3)*P<0.05,与同组OGT比较Fig.3 Effects of Taxol on OGT and OGA mRNA levels in breast cancer cell MDA-MB-231(n=3)*P<0.05,compared with OGT
2.3 蛋白质O-GlcNAc糖基化水平升高对紫杉醇抗肿瘤细胞增殖的影响 Western结果显示:随着OGA抑制剂PUGNAc浓度的升高,乳腺癌细胞蛋白质O-GlcNAc糖基化水平逐渐升高(P<0.05,见图4A)。SRB结果显示: 随着紫杉醇浓度升高, 乳腺癌细胞存活率不断降低;不同浓度OGA抑制剂PUGNAc对细胞增殖无影响。将不同浓度的PUGNAc和不同浓度的紫杉醇联合,同时处理MDA-MB-231细胞48 h,发现PUGNAc可提高紫杉醇的抗细胞增殖活性,但差异无统计学意义(结果未显示)。先用不同浓度的PUGNAc处理MDA-MB-231细胞24 h,再加入不同浓度的紫杉醇处理48 h,结果显示PUGNAc提前处理细胞可导致紫杉醇的抗肿瘤活性明显增强(P<0.05,P<0.01,见图4B)。表明PUGNAc导致的蛋白质O-GlcNAc糖基化水平升高可引起细胞对紫杉醇的药物敏感性增强。

图4 不同浓度OGA抑制剂PUGNAc和不同浓度紫杉醇对蛋白质O-GlcNAc糖基化水平(A)和细胞增殖抑制(B)的影响(n=3)A:*P<0.05;B:*P<0.05,**P<0.01,与单独Taxol处理组比较Fig. 4 Effects of the combined treatment of OGA inhibitor with Taxol on protein O-GlcNAcylation levels (A) and cell growth (B)(n=3)A:*P<0.05;B:*P<0.05,**P<0.01, compared with Taxol treatment alone
2.4 蛋白质O-GlcNAc糖基化水平降低对紫杉醇抗增殖活性的影响 Western结果显示:随着OGT抑制剂alloxan浓度的升高,蛋白质O-GlcNAc糖基化水平逐渐降低(P<0.05,P<0.01,见图5A)。SRB结果显示:不同浓度alloxan处理MDA-MB-231细胞对细胞增殖无明显影响。将不同浓度alloxan和不同浓度的紫杉醇联合同时处理MDA-MB-231细胞48 h,发现alloxan对紫杉醇的抗肿瘤活性没有显著影响(结果未显示)。先用不同浓度alloxan处理MDA-MB-231细胞24 h,再加入不同浓度的紫杉醇处理48 h,结果显示alloxan提前处理细胞导致紫杉醇的抗肿瘤活性显著降低(P<0.05,见图5B)。表明,alloxan导致的蛋白质O-GlcNAc糖基化水平降低可引起细胞对紫杉醇的药物敏感性降低。

图5 不同浓度OGT抑制剂alloxan和不同浓度紫杉醇联合处理对蛋白质O-GlcNAc糖基化水平(A)和细胞增殖抑制(B)的影响(n=3)A:*P<0.05,**P<0.01,与alloxan 0 μM组比较;B:*P<0.05,与单独Taxol处理组比较Fig.5 Effects of the combined treatment of OGT inhibitor alloxan with Taxol on protein O-GlcNAcylation (A) and cell growth (B)(n=3)A:*P<0.05, **P<0.01, compared with alloxan 0 μM group;B:*P<0.05,compared with Taxol treatment alone
3 讨论
与正常组织相比较,肿瘤组织中糖蛋白的糖链会发生明显改变,常见的有N-糖链的分支增多,O-糖链的长度变短,糖链岩藻糖修饰、唾液酸修饰增加,O-GlcNAc糖基化增加等。糖链的变化影响肿瘤细胞的增殖、凋亡、侵袭和转移,影响药物的抗肿瘤活性[4-5]。大量文献证实N-糖基化或者O-糖基化的改变会影响药物或者放疗的抗肿瘤作用,如在肿瘤细胞中α2,6-唾液酸转移酶(ST6Gal1)高表达,导致糖链的α2,6-唾液酸化修饰增加,可引起肿瘤细胞对顺铂(cisplatin)和吉非替尼(gefitinib)的药物敏感性降低[6-8]。肿瘤细胞中MGAT5基因高表达,可导致蛋白质 N-糖链多形成一个β1-6 GlcNAc连接的分支,研究MGAT5基因敲除的荷瘤小鼠(糖蛋白N-糖链的β1-6分支缺失),发现小鼠肿瘤组织对VEGF抗体的药物敏感性增强[9]。抗肿瘤药物对肿瘤细胞的糖蛋白或糖链也产生影响。如接受多西他赛(docetaxel)和伊马替尼(imatinibmesylate)联合治疗的卵巢癌患者,治疗前后的血浆蛋白N-糖链含量水平存在差异[10]。但有关蛋白质 O-GlcNAc 糖基化和药物相互作用关系的研究尚未见报道。
蛋白质O-GlcNAc糖基化在多种生命活动中发挥重要作用,目前已发现4000种以上的蛋白质是O-GlcNAc修饰的,但对于糖基化位点的鉴定目前还存在技术上的困难[11]。蛋白质 O-GlcNAc 糖基化分别通过和OGA和OGT这2种酶进行去除或添加;UDP-GlcNAc是唯一的糖基供体,UDP-GlcNAc的合成是己糖胺合成途径(HBP)的最后产物,谷氨酰胺6-磷酸果糖氨基转移酶(GFAT)是唯一的限速酶;同时,UDP-GlcNAc的合成和糖酵解途径密切相关[1,12]。在葡萄糖转运蛋白(GLUT)的作用下葡萄糖进入细胞浆内,大约有2%~5%的葡萄糖进入HBP途径,最终生成UDP-GlcNAc;其它大量的葡萄糖进入糖酵解途径,糖酵解存在己糖激酶(HK)、6-磷酸果糖激酶(PFK)和丙酮酸激酶(PKM)3种关键酶。在肿瘤细胞中,GFAT1、GLUT1、HK2、PFK1和PKM2是上述几种酶的主要存在形式。
紫杉醇诱导和促进细胞微管蛋白聚合,抑制细胞分裂,被广泛用于乳腺癌、肺癌等多种肿瘤的治疗,然而,细胞对紫杉醇的耐药性降低了其临床治疗效果[13]。本文通过研究蛋白质 O-GlcNAc 糖基化和紫杉醇的相互关系,发现紫杉醇在乳腺癌细胞MDA-MB-231中可诱导蛋白质O-GlcNAc糖基化水平升高,且这种升高现象在另外2种乳腺癌细胞MCF-7和SKBR3中同样存在(结果未显示),表明这种现象不是细胞依赖性的。为进一步探讨紫杉醇诱导的蛋白质糖基化水平升高的机制,测定了与蛋白质O-GlcNAc糖基化合成相关的多种酶的蛋白表达水平。结果显示紫杉醇可诱导糖苷酶OGA的mRNA和蛋白表达水平升高;但其也可同时诱导糖基转移酶OGT的mRNA和蛋白表达水平升高。紫杉醇促进OGA和OGT蛋白水平同时升高,且升高的程度差异无统计学意义,表明OGA和OGT可能不是紫杉醇诱导的O-GlcNAc糖基化升高的主要原因。紫杉醇可诱导细胞HK2表达水平升高,HK2的功能是把葡萄糖转化为葡萄糖-6-磷酸,接着转化为果糖6-磷酸,部分的果糖6-磷酸进入HBP途径,最终生成UDP-GlcNAc;紫杉醇还可诱导GFAT1表达水平升高,而GFAT1是HBP途径的唯一限速酶,因而推测,HK2和GFAT1参与了紫杉醇诱导的蛋白质O-GlcNAc糖基化水平升高,但还需要进一步的验证。紫杉醇对GLUT1、PFK1和PKM2的蛋白表达水平影响不大,表明这3种酶并未参与紫杉醇诱导的蛋白质O-GlcNAc糖基化水平升高。
PUGNAc是OGA的抑制剂,可通过抑制O-GlcNAc从糖基化蛋白质上解离下来,从而升高蛋白质O-GlcNAc的糖基化水平[14]。0.1、1.0、10μM的PUGNAc均可明显升高蛋白质 O-GlcNAc 糖基化水平。PUGNAc和紫杉醇同时处理MDA-MB-231细胞,对紫杉醇的抗肿瘤活性影响不大;但PUGNAc处理细胞24h后再加入紫杉醇,紫杉醇的抗细胞增殖活性明显增强,表明蛋白质O-GlcNAc糖基化水平升高促进了紫杉醇的抗肿瘤活性。
Alloxan是OGT的抑制剂,本研究结果显示使用不同浓度的alloxan并不能抑制MDA-MB-231细胞的增殖,但可以降低蛋白质O-GlcNAc糖基化水平,这和文献报道的一致[15]。Alloxan和紫杉醇同时处理MDA-MB-231细胞,对紫杉醇的抗肿瘤活性影响不大;但alloxan处理细胞24 h后再加入紫杉醇,紫杉醇的抗细胞增殖活性明显降低,表明蛋白质O-GlcNAc糖基化水平下降抑制了紫杉醇的抗肿瘤活性。
综上所述,紫杉醇可诱导乳腺癌细胞蛋白质O-GlcNAc糖基化水平升高,OGA和OGT的蛋白和mRNA水平都随着紫杉醇的浓度升高而升高,改变蛋白质O-GlcNAc糖基化水平影响细胞对紫杉醇的药物敏感性,进一步研究其中的分子机制,对提高紫杉醇的抗肿瘤活性具有重要意义。
[1] Bond MR,Hanover JA.A little sugar goes a long way: the cell biology of O-GlcNAc [J].J Cell Biol,2015,208(7):869-880.
[2] deQueiroz RM,Carvalho E,Dias WB.O-GlcNAcylation: the sweet side of the cancer[J].Front Oncol,2014,4:00132.
[3] Ma Z,Vosseller K.O-GlcNAc in cancer biology[J].Amino Acids,2013,45(4):719-733.
[4] Christiansen MN,Chik J,Lee L,et al.Cell surface protein glycosylation in cancer[J].Proteomics,2014,14(4-5):525-546.
[5] Lange T,Samatov TR,Tonevitsky AG,et al.Importance of altered glycoprotein-boundN- andO-glycans for epithelial-to-mesenchymal transition and adhesion of cancer cells[J].Carbohydr Res,2014,389:39-45.
[6] Büll C,Stoel MA,denBrok MH,et al.Sialic acids sweeten a tumor’s life[J].Cancer Res,2014,74(12):3199-3204.
[7] Park JJ,Lee M.Increasing the α 2,6 sialylation of glycoproteins may contribute to metastatic spread and therapeutic resistance in colorectal cancer[J].Gut Liver,2013,7(6):629-641.
[8] Park JJ,Yi JY,JinYB,et al.Sialylation of epidermal growth factor receptor regulates receptor activity and chemosensitivity to gefitinib in colon cancer cells[J].Biochem Pharmacol,2012,83(7):849-857.
[9] Croci DO,Cerliani JP,Dalotto-Moreno T,et al.Glycosylation-Dependent Lectin-Receptor Interactions Preserve Angiogenesis in Anti-VEGF Refractory Tumors[J].Cell,2014,156(4):744-758.
[10] Han YY,Liu HY,Han DJ,et al.Role of glycosylation in the anticancer activity of antibacterial peptides against breast cancer cells[J].Biochem Pharmacol,2013, 86(9):1254-1262.
[11] Ma J,Hart GW.O-GlcNAcprofiling:from proteins to proteomes[J].Clin Proteomics,2014,11(1):8.
[12] 邓瑞萍,郭书娟,陶生策.O-GlcNAc糖基化功能研究最新进展[J].生命科学,2013,25(5):502-510.
[13] Dostál V,Libusová L.Microtubuledrugs:action, selectivity, and resistance across the kingdoms of life[J].Protoplasma,2014,251(5):991-1005.
[14] Banerjee PS,Hart GW,Cho JW.Chemical approaches to study O-GlcNAcylation[J].Chem Soc Rev,2013,42(10):4345-4357.
[15] Lee TN,Alborn WE,Knierman MD,et al.Alloxan is an inhibitor of O-GlcNAc-selective N-acetyl-β-d-glucosaminidase[J].Biochem Biophys Res Commun,2006,350(4):1038-1043.
(编校:吴茜)
Relationship of protein O-GlcNAcylation levels with antitumor effect of Taxol in breast cancer
ZHANG Xiao-bing, LI Hui, WANG Feng-shan, SHI Yi-kangΔ
(School of Pharmaceutical Sciences/National Glycoengineering Research Center, Shandong University, Ji′nan 250012, China)
ObjectiveTo study effect of Taxol on protein O-GlcNAcylation levels and investigate whether protein O-GlcNAcylation levels can affect the sensitivity of breast cancer cells to Taxol.MethodsWestern blot analysis was performed to examine protein O-GlcNAcylation levels and the expression of enzymes related to O-GlcNAcylation biosynthesis in Taxol treated breast cancer cells. RT-qPCR was used to analyze the effects of Taxol on OGA and OGT mRNA expression in cancer cells. The sulforhodamine B colorimetric assay was used to determine the effect of alteration of protein O-GlcNAcylation on the anti-proliferation of Taxol in breast cancer cells by adding OGA inhibitor and OGT inhibitor, respectively.ResultsTaxol treatment enhanced protein O-GlcNAcylation levels in dose- and time-dependent manners in breast cancer cell MDA-MB-231(P<0.05). Taxol increased the mRNA levels of OGT and OGA after MDA-MB-231 cells were treated for 24 h(P<0.05). As OGA inhibitors increased protein O-GlcNAcylation levels, the sensitivity of MDA-MB-231 to Taxol was increased. As OGT inhibitor decreased protein O-GlcNAcylation levels, the sensitivity of MDA-MB-231 to Taxol was reduced.ConclusionTaxol treatment can enhance protein O-GlcNAcylation levels and the changes of O-GlcNAcylation levels alter the sensitivity of breast cancer cell MDA-MB-231 to Taxol.
O-Glycosylation;Taxol;β-N-acetylglucosaminidase; β-N-acetylglucosaminyltransferase
国家自然科学基金(81272208);山东省自然科学基金(ZR2009CM046)
张肖冰,女,硕士,研究方向:微生物与生化药学,E-mail:2532928372@qq.com;师以康,通讯作者,男,博士,副教授,研究方向:微生物与生化药学,E-mail:shiyikang@sdu.edu.cn。
R966
A
1005-1678(2015)05-0001-05
