ɑ-硫辛酸对缺氧缺血性脑损伤新生大鼠氧化应激水平及脑水肿的影响
2015-07-07庞国象陈广斌麦水强王瑞华黄梅英
庞国象,陈广斌,麦水强Δ,王瑞华,黄梅英
(1.深圳市龙岗区人民医院 新生儿科,广东 深圳 518172;2.深圳市第三人民医院 药剂科临床药学室,广东 深圳 518112)
ɑ-硫辛酸对缺氧缺血性脑损伤新生大鼠氧化应激水平及脑水肿的影响
庞国象1,陈广斌2,麦水强1Δ,王瑞华1,黄梅英1
(1.深圳市龙岗区人民医院 新生儿科,广东 深圳 518172;2.深圳市第三人民医院 药剂科临床药学室,广东 深圳 518112)
目的 观察ɑ-硫辛酸(alpha-lipoic acid,ALA)对缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)新生大鼠脑组织氧化应激指标超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)及脑水肿的影响,探讨ɑ-硫辛酸对新生大鼠缺氧缺血性脑损伤的保护作用。方法 随机将7日龄Wistar大鼠108只分为3组,假手术组(n=36);缺氧缺血模型组(HIBD,n=36);ALA治疗组(n=36);根据造模后处死时间,各组又分1、3、7 d亚组,每亚组各12只。按RICE法制备新生大鼠HIBD模型。治疗组分别于造模后即开始腹腔注射ALA 100 mg/kg,每天2次,连续5d;假手术组及HIBD模型组于相应时点腹腔注射等量生理盐水。造模后1、3、7 d断头处死取脑,采用干湿质量法测定脑组织含水量,采用比色法检测脑组织匀浆SOD、MDA和GSH-PX的含量。结果 HIBD组与假手术组比较,各时间点脑组织匀浆SOD、GSH-PX降低、MDA升高,脑组织含水量升高(P<0.05)。治疗组与 HIBD 组比较,各时间点脑组织匀浆GSH-PX回升,脑组织含水量回降(P<0.05)。治疗组与 HIBD 组比较,造模后1 d时,SOD、MDA差异无统计学意义,造模后3、7 d时,SOD回升,MDA回降(P<0.05)。结论 ɑ-硫辛酸对新生大鼠缺氧缺血性脑损伤有保护作用,可减轻缺氧缺血性脑损伤后脑水肿,而其机制之一可能是ɑ-硫辛酸能减轻缺氧缺血所致的脑组织氧化应激损伤。
ɑ-硫辛酸;缺氧缺血性脑损伤;新生大鼠;脑水肿;氧化应激
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是新生儿期常见病、多发病。目前为止,对HIE尚无特效治疗方法[1]。HIE的发病机制复杂,其早期病理生理改变以血脑屏障通透性增加引起的脑水肿为主。研究认为,缺血/再灌注损伤过程中引起的氧自由基连锁反应是脑组织缺氧缺血后脑水肿和神经元损伤的核心病理机制[2-4]。ɑ-硫辛酸(alpha-lipoic acid,ALA)具备抗氧化性,是已知抗氧化剂中最强的一种,被称为“万能抗氧化剂”[5]。近年研究表明,ALA对脑缺血再灌注损伤具有神经保护作用[6-7]。关于ALA用于新生儿缺氧缺血性脑病的研究尚罕见报道,本实验试图探讨ɑ-硫辛酸对缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)新生大鼠脑组织氧化应激指标超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)及脑水肿的影响,探讨其对缺氧缺血性脑损伤新生大鼠的神经保护作用。
1 材料与方法
1.1 实验动物分组 清洁级新生7日龄Wistar大鼠108只,体质量11~16 g,雌雄不限,由广东医学院动物实验中心提供。随机分为3组,假手术组(sham,n=36);缺氧缺血模型组(HIBD,n=36);ALA治疗组(n=36)。根据造模后处死时间,各组又分3个亚组:1、3、7 d亚组,每亚组各12只。所有动物实验均符合《实验动物保护和使用管理条例》。
1.2 动物实验 按经典RICE法[8]制备新生大鼠HIBD模型。HIBD模型组及ALA治疗组新生大鼠以乙醚吸入麻醉,取一带盖塑料盒,内置乙醚棉球,放入新生大鼠,待新生大鼠活动明显减少至停止,即取出,取仰卧位,四肢固定于手术板,取颈正中切口,分离并以丝线永久双线结扎左颈总动脉,整个手术过程不超过5 min,缝合切口后将术后新生鼠放回母鼠身边休息1 h后置2 L密闭容器,控制在(36±1) ℃温度中,以2~3 L/min的速度输入8%的氧气和92%的氮气的混合气体,持续2 h后将鼠取出放回母鼠身边喂养。假手术组予分离左颈总动脉但不结扎血管及缺氧。
[6],治疗组分别于造模后即开始腹腔注射ALA 100 mg/kg(批号:81526,STADA Arznei-mittel AG公司,德国),每天2次,连续5 d。计算好每只新生鼠用药量后,吸取已用无菌生理盐水溶解配制成200 mg/mL的ALA注射液。假手术组及HIBD模型组于相对应时点腹腔注射等量生理盐水。动物分别在造模后1、3、7 d断头处死取脑。随机分2组,一组(n=6)测定全脑组织含水量,另一组(n=6)速取实验侧大脑半球,称重后置于冰浸的生理盐水中冲洗2次,用玻璃匀浆器制备匀浆,用生理盐水配制成10%匀浆,4000 r/min离心5 min,取上清液贮于-4 ℃备测。
1.3 检测方法 上述样本均在24 h内完成测定。采用干湿质量法测定脑组织含水量,于相应时间点断头处死大鼠,开颅取脑,去除嗅球、小脑和低位脑干,立即称大脑湿重,然后置于110 ℃恒温干燥箱内干燥24 h至恒重,称干重后按Elliot公式计算脑含水量:脑含水量=(脑湿重-脑干重)/脑湿重×100%。SOD采用黄嘌呤氧化酶法测定,MDA用硫代巴比妥酸法测定,GSH-PX用二硫代二硝基苯甲酸法测定。S0D、MDA和GSH-PX试剂盒购自南京建成生物科技公司,实验步骤严格按照说明书操作。
2 结果
2.1 脑组织大体形态学观察 假手术组新生大鼠大脑无水肿或出血,左右大脑半球对称。HIBD组新生大鼠结扎侧大脑半球造模1 d后出现苍白、水肿,体积稍大于对侧,3 d时脑水肿程度持续加剧,体积明显大于对侧,脑回增宽,脑沟变浅,7 d时脑组织肿胀有所好转。ɑ-硫辛酸治疗组各时间点新生大鼠脑水肿程度较HIBD组减轻。
2.2 各组新生大鼠脑组织含水量的动态变化 HIBD组脑组织含水量在缺氧缺血后1 d开始升高,3 d达高峰,各时间点均高于假手术组,差异有统计学意义;治疗组各时间点与HIBD组比较脑组织含水量明显下降,差异有统计学意义(1 d:q=4.41,P<0.01;3 d:q=4.56,P<0.01;7 d:q=2.91,P<0.05)。见表1。

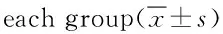
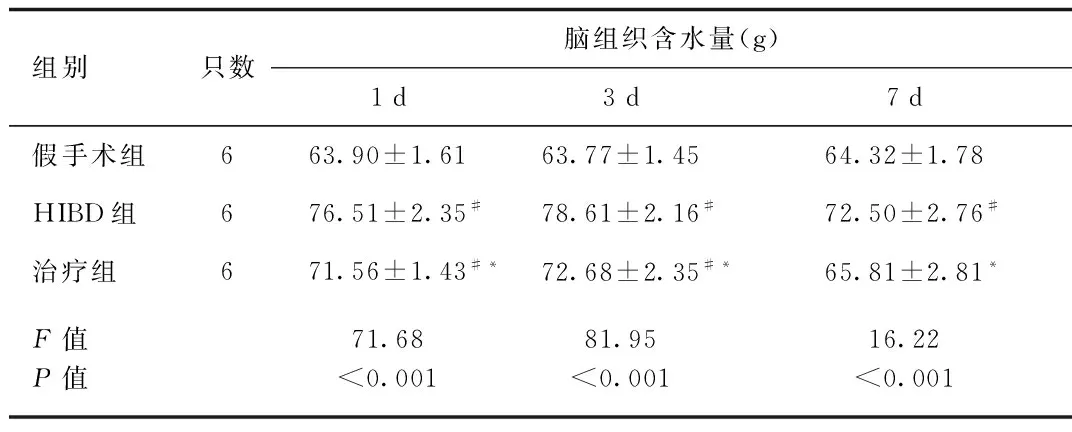
组别只数脑组织含水量(g)1d3d7d假手术组663.90±1.6163.77±1.4564.32±1.78HIBD组676.51±2.35#78.61±2.16#72.50±2.76#治疗组671.56±1.43#*72.68±2.35#*65.81±2.81*F值P值71.68<0.00181.95<0.00116.22<0.001
#P<0.05,与假手术组同时间点比较,compared with sham group at the same time point;*P<0.05,与HIBD组同时间点比较,compared with HIBD group at the same time point
2.3 各组新生大鼠脑组织SOD、MDA、GSH-PX测定结果 HIBD组与假手术组比较,各时间点脑组织匀浆SOD、GSH-PX降低(SOD:1 d时,q=12.47,P<0.001;3 d时,q=10.09,P<0.001;7 d时q=8.28,P<0.001。GSH-PX:1 d时,q=11.26,P<0.001;3 d时,q=9.97,P<0.001;7 d时q=9.88,P<0.001),MDA升高(1 d时,q=11.67,P<0.001;3 d时,q=10.62,P<0.001;7 d时q=11.24,P<0.001)。治疗组与 HIBD 组比较,各时间点脑组织匀浆GSH-PX回升(1 d时,q=3.70,P<0.01;3 d时,q=5.69,P<0.001;7 d时,q=6.41,P<0.001);治疗组与HIBD组比较,造模后1 d时,SOD、MDA差异无统计学意义(SOD:q=1.33,P=0.213;MDA:q=0.40,P=0.7008)。造模后3 d和7 d时,SOD回升,MDA回降(SOD:3 d时,q=3.09,P<0.05;7 d时,q=4.43,P<0.01。MDA:3 d时,q=2.80,P<0.05;7 d时,q=6.41,P<0.001)。见表2、表3和表4。

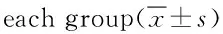
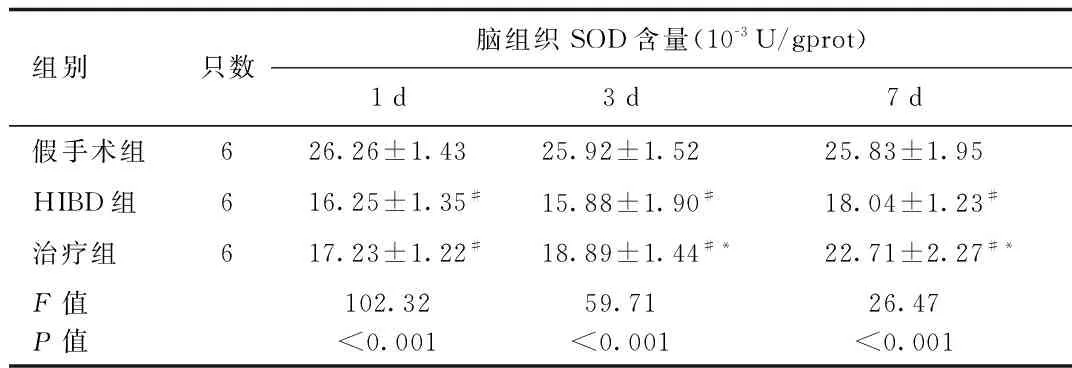
组别只数脑组织SOD含量(10-3U/gprot)1d3d7d假手术组626.26±1.4325.92±1.5225.83±1.95HIBD组616.25±1.35#15.88±1.90#18.04±1.23#治疗组617.23±1.22#18.89±1.44#*22.71±2.27#*F值P值102.32<0.00159.71<0.00126.47<0.001
#P<0.05,与假手术组同时间点比较,compared with sham group at the same time point;*P<0.05,与HIBD组同时间点比较,compared with HIBD group at the same time point

表3 各组新生大鼠脑组织MDA测定结果±s)Tab.3 Comparison of MDA levels in newborn rats brain among each ±s)
#P<0.05,与假手术组同时间点比较,compared with sham group at the same time point;*P<0.05,与HIBD组同时间点比较,compared with HIBD group at the same time point

表4 各组新生大鼠脑组织GSH-PX测定结果±s)Tab.4 Comparison of GSH-PX levels in newborn rats brain among each ±s)
#P<0.05,与假手术组同时间点比较,compared with sham group at the same time point;*P<0.05,与HIBD组同时间点比较,compared with HIBD group at the same time point
3 讨论
新生儿缺氧缺血性脑病是造成新生儿早期死亡及智能发育障碍、脑性瘫痪和癫痫等中枢神经系统后遗症的最常见原因之一。由于目前治疗上除对症支持措施外,无特效治疗药物。因此寻找更为有效的HIE治疗药物一直是新生儿领域的研究热点。
氧化应激损伤在新生儿HIBD病理生理过程中的作用近年越来越受到重视。SOD、GSH-PX是机体主要抗氧化酶,MDA是脂质过氧化物,它们是反映机体氧化应激状态的重要生化指标[9-10]。本研究显示,新生大鼠经手术缺氧缺血造模1 d后,SOD、GSH-PX降低,MDA升高,结扎侧大脑半球出现苍白、水肿,含水量升高,说明造模成功并符合文献报道改变[8,11],提示HIBD时,氧化与抗氧化系统失衡,清除自由基的能力降低,机体产生氧化应激损伤。也提示氧化应激是缺氧缺血性脑损伤所致脑水肿的原因之一。本研究结果还显示,缺氧缺血造模3d后,SOD、GSH-PX降低、MDA升高最明显,较造模7 d时明显,提示在缺氧缺血早期即应开始应用减轻氧化应激水平的治疗措施。
ɑ-硫辛酸(alpha-lipoic acid,ALA)由Reed等于1951年首次从猪肝中分离出来,是一种天然存在的、人体也可以合成的化合物,也是已知天然抗氧化剂中效果最强的一种。ALA具有水溶性及脂溶性双重特性,分子量小,易于通过血脑屏障,能清除活性氧和自由基,螯合金属离子,再生体内的抗氧化剂,从而减弱氧化应激,因此,ALA具备一般抗氧化剂所不能及的抗氧化性[5]。长期以来,ALA 的神经保护作用一直备受关注[12-14]。Toklu等[15]研究发现,ALA可通过减轻氧化应激,保护创伤性脑损伤大鼠的血脑屏障稳定性及降低脑水肿。国内外研究均证实,ALA对脑缺血再灌注损伤具有神经保护作用[6-7]。研究还发现[16],ALA可通过增强氧自由基清除剂的活性而减轻氧自由基损伤,抑制缺血再灌注脑神经元调亡。ALA目前已广泛应用于多种神经系统疾病如阿尔茨海默病、帕金森氏症、糖尿病神经病变等的临床治疗并取得良好疗效。本研究结果显示,ALA治疗组与HIBD组比较,各时间点脑组织匀浆GSH-PX回升,脑组织含水量回降(P<0.05);造模后1 d时,SOD、MDA差异无统计学意义;造模后3、7 d时,SOD回升,MDA回降(P<0.05)。提示ALA可减轻缺氧缺血性脑损伤后脑水肿,而其机制之一可能是减轻缺氧缺血所致的氧化应激。本研究证实,ALA对新生大鼠缺氧缺血性脑损伤有神经保护作用,值得进一步研究。
参考文献
[1] 邵肖梅,叶鸿帽,丘小汕.实用新生儿学(第3版)[M].北京:人民卫生出版社,2011:699-706.
[2] Honda HM,Korge P,Weiss JN.Mitochondria and ischemia/reperfusion injury[J].Ann NY Acad Sci,2005,1047:248-258.
[3] 邓笑梅,龙隽,孙琴,等.氧化应激与新生儿脑损伤[J].中国新生儿科杂志,2010,25:50-52.
[4] Houde V,Grenier D,Chandad F.Protective effects of grape seed proanthocyanidins against oxidative stress induced by lipopolysaccharides of periodontopathogens[J].J Periodontol,2006,77(8):1371-1379.
[5] Goraca A,Huk-Kolega H,Piechota A,et al.Lipoic acid-biological activity and therapeutic potential[J].Pharmacol Rep,2011,63(4):849-858.
[6] 刘学忠,崔旭,卞建春,等.硫辛酸在大鼠全脑缺血再灌注损伤中的神经保护作用[J].中国兽医学报,2004,24(4):388-390.
[7] Connell BJ,Saleh M,Khan BV,et al.Lipoic acid protects against reperfusion injury in the early stages of cerebral ischemia[J].Brain Res,2011,1375:128-136.
[8] Rice JE,Vannucci RC,Brierley JB.The influence of immaturity on hypoxic- ischemic brain damage in the rat[J].Ann Neurol,1981,9(2):131-141.
[9] Ikeda T,Xia YX,Kaneko M,et al.Effect of the free radical scavenger,3-methyl-1-phenyl-2-pyrazolin-5-one(MCI-186),on hypoxia-ischemia-induced brain injury in neonatal rats[J].Neurosci Lett,2002,329(1):33-36.
[10] Trevisan M,Browne R,Ram M,et al.Correlates of markers of oxidative status in the general population[J].Am J Epidemiol,2001,154(4):348-356.
[11] 李维超,初桂兰.1,6-二磷酸果糖对新生鼠缺氧缺血性脑损伤的保护机制研究[J].国际儿科学杂志,2009,36(5):446-447.
[12] 车千红,孟艳,郭佳琦,等.ɑ-硫辛酸对大鼠脑氧化损伤保护作用[J].中国公共卫生,2009,25(6):764-765.
[13] Ersahin M,Toklu HZ,Cetinel S,et al.Alpha lipoic acid alleviates oxidative stress and preserves blood brain permeability in rats with subarachnoid hemorrhage[J].Neurochem Res,2010,35(3):418-428.
[14] Connell BJ, Saleh MC, Khan BV,et al.UPEI-100,a conjugate of lipoic acid and apocynin,mediates neuroprotection in a rat model of ischemia/reperfusion[J].Am J Physiol Regul Integr Comp Physiol,2012,302(7):R886-R895.
[15] Toklu HZ, Hakan T,Biber N,et al.The protective effect of alpha lipoic acid against traumatic brain injury in rats[J].Free Radic Res,2009,43(7):658-667.
[16] 尹志圭,郑斌,崔旭,等.ɑ-硫辛酸对缺血再灌注脑神经元调亡的作用[J].山东医药,2005,45(23):18-19.
(编校:王俨俨)
Effect of alpha-lipoic acid on oxidative stress and cerebral edema after hypoxic-ischemic brain damage in neonatal rats
PANG Guo-xiang1, CHEN Guang-bin2, MAI Shui-qiang1Δ, WANG Rui-hua1, HUANG Mei-ying1
(1.Department of Pediatrics, People’s Hospital of Longgang District, Shenzhen 518172, China; 2.Department of Pharmacy, The Third People’s Hospital of Shenzhen, Shenzhen 518112, China)
ObjectiveTo investigate the effect of alpha-lipoic acid on oxidative stress and cerebral edema after hypoxic-ischemic brain damage(HIBD)in neonatal rats.MethodsA total of 108 neonatal 7-day-old Wistar rats were randomly divided into 3 groups: sham-operated group(sham,n=36), HIBD group(HIBD,n=36) and alpha-lipoic acid-treated group (treated group,n=36).Each group was divided into 3 sub-groups (n=12, per sub-group) based on different time points after HIBD (1 d, 3 d, 7 d).HIBD rat models were established by ligating the left common carotid artery,The sham-operated group and the HIBD group were treated with normal sodium injection intraperitoneally; treated group were treated with alpha-lipoic acid 100 mg/kg every 12 hours in 5 days.Animals were sacrificed at different time points.Changes of brain water content were determined by dry-wet weight method.And the levels of SOD,MDA,GSH-PX were measured.ResultsHIBD group showed an upward trend in brain water content and the level of MDA after HIBD, were higher than that of sham-operated group at each time point (P<0.05).Meanwhile, the levels of SOD and GSH-PX showed the downward trend in HIBD group.The levels of brain water content and the level of MDA in treated group were significantly lower than HIBD group at each time point (P<0.05).And the levels of SOD and GSH-PX in treated group were significantly higher than HIBD group at 3 d and 7 d.on the contrary, the level of MDA in treated group was significantly lower than HIBD group at 3 d and 7 d.ConclusionAlpha-lipoic acid can amiliorate cerebral edema, so it can prevent HIBD.The neuronal protective mechanism might be reverse oxidative imbalance in the brain of neonatal rats with HIBD.
alpha-lipoic acid; hypoxic-ischemic brain damage; neonatal rats; cerebral edema; oxidative stress
深圳市科技计划项目(201203328);深圳市龙岗区科技计划项目(20140609300101)
庞国象,男,硕士,主任医师,研究方向:小儿神经系统疾病,E-mail:pangcyh@163.com;麦水强,通讯作者,男,硕士,主任医师,研究方向:小儿危重症医学,E-mail:maisq@sina.com。
R722.1
A
1005-1678(2015)05-0044-04
