靶向沉默CXCR4表达逆转肺癌细胞吉西他滨耐药性的作用研究
2015-07-07王立文沈晓洁俞茹云林莉莉
王立文,沈晓洁,俞茹云,林莉莉
(无锡卫生高等职业技术学校 康复系,江苏 无锡 214028)
靶向沉默CXCR4表达逆转肺癌细胞吉西他滨耐药性的作用研究
王立文Δ,沈晓洁,俞茹云,林莉莉
(无锡卫生高等职业技术学校 康复系,江苏 无锡 214028)
目的 观察靶向沉默CXCR4基因表达对非小细胞肺癌吉西他滨耐药株(A549/Gem)逆转作用的影响。方法 采用体外浓度梯度递增的诱导方法建立非小细胞肺癌吉西他滨耐(Gemcitabine)获得性耐药细胞株(A549/Gem)。通过Quantitative RT-PCR(RT-qPCR)检测A549与A549/Gem细胞中CXCR4的表达量。通过体外转染CXCR4 shRNA干扰载体到A549/Gem细胞,RT-qPCR及蛋白质印迹法(Western blot)验证shRNA对CXCR4基因的靶向沉默效率。进而采用MTT法检测A549、A549/Gem和CXCR4沉默表达细胞株(A549/Gem-CXCR4)对Gemcitabine的半数抑制浓度(50% inhibitory concentration,IC50)和耐药指数(resistance index,RI);最后采用Western blot法检测A549、A549/Gem和A549/Gem-CXCR4细胞中JNK、p38和ERK1/2磷酸化蛋白的表达水平的变化。 结果 通过体外浓度梯度递增的诱导方法成功建立A549/Gem细胞株(P<0.05)。A549/Gem细胞株中CXCR4的表达量明显高于A549细胞株。体外转染CXCR4 shRNA可明显下调A549/Gem细胞株中CXCR4表达。MTT法检测A549,A549/Gem和A549/Gem-CXCR4对Gemcitabine的IC50分别为(0.08±0.01)μmol/L,(14.01±0.21)μmol/L和(1.84±0.61)μmol/L。A549/Gem细胞株对Gemcitabine的耐药指数(RI)是(127.12±12.28),远高于A549/Gem-CXCR4对Gemcitabine的耐药指数(RI)(0.27±0.08);Western blot结果显示A549/Gem-CXCR4细胞株中JNK、p38和ERK1/2磷酸化蛋白的表达量较A549/Gem细胞株明显下调。 结论 A549/Gem细胞株中CXCR4的表达明显上调。靶向沉默CXCR4表达能够逆转肺癌细胞吉西他滨耐药性,提示CXCR4是肺癌临床放射治疗相关的有效分子靶点。
非小细胞肺癌;吉西他滨;CXCR4;耐药性
肺癌是世界范围内肿瘤死亡的首要原因,我国肺癌在城市人口肿瘤患者死亡原因中由原来的第四位上升为第一位,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占了85%左右[l-2]。目前研究报道,只有14%的患者在确诊肺癌后能生存五年或以上[3]。在诊断为晚期肺癌的患者中,研究发现吉西他滨可明显提高患者的生存率,其联合任何一种抗癌药物,如紫杉醇、铂类、长春瑞滨等均被认为是晚期肺癌一线治疗方案。尽管多样的化疗方案可以改善患者的预后,但由于耐药及不可避免的药物毒性导致大多数患者最终结果仍然是治疗的失败[4]。大量实验和临床研究已经证明一系列分泌性趋化因子与NSCLC发展的病理机制有密切关系,特别是基质源性细胞因子1(stromalcell-deriredfactor-1,SDF-1)与其受体CXCR4在NSCLC转移中扮演重要角色[5-6]。最新研究表明,CXCR4在肝癌组织中异常高表达,并且与肝癌预后明确相关[7]。本研究拟通过RNA干扰技术,靶向沉默CXCR4基因的表达,观察其对吉西他滨耐药NSCLC细胞株A549逆转作用的影响。
1 材料与方法
1.1 材料
1.1.1 实验材料 聚偏二氟乙烯膜(PVDF膜)购自 Milliproe公司。DMEM培养液和胎牛血清购自美国Hyclone公司;二甲基亚砜(DMSO)、四甲基偶氮唑盐(MTT)和碘化丙啶(PI)均购自美国Sigma公司。人非小细胞肺癌细胞株A549购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。盐酸吉西他滨购(Gemcitabine)自南京正大天晴制药有限公司。转染试剂LipofectamineTM 2000购自Invitrogen公司,G418购自Gibico公司。RNA干扰载体CXCR4-shRNA及阴性对照载体(negative control)购自由本上海Genechem公司。兔抗人CXCR4抗体及ACTIN抗体购自Santa Cruz公司。JNK、p38和ERK1/2磷酸化抗体均购自美国CST公司。HRP标记山羊抗兔或鼠IgG二抗购自北京中衫金桥公司。PCR引物合成于北京鼎国生物公司,RT-qPCR试剂体系购自日本TaKaRa公司。
1.1.2 仪器 5810R冷冻离心机购自德国eppendorf公司;5415D台式离心机购自德国eppendorf公司;Heλiosγ紫外分光光度计购自美国Thermo公司;TS-2脱色摇床购自江苏其林贝尔公司;TS-8转移脱色摇床购自江苏其林贝尔公司;EPS-300电泳仪购自上海天能公司;VE-180微型垂直电泳槽购自上海天能公司;VE-186转移电泳槽购自上海天能公司;微量加样器购自德国eppendorf公司;SW-CJ-1FD超净工作台购自日本AIR TECH公司;TP600梯度PCR仪购自日本TaKaRa公司;TP800Real time PCR仪购自日本TaKaRa公司;Elx800型自动酶标仪购自美国BioTek公司。
1.2 方法
1.2.1 细胞培养:A549细胞培养于含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养液,培养于 37 ℃、5%CO2的恒温培养箱中,倒置显微镜下观察细胞形态及生长状态,每1~2 d传代一次,取对数生长期细胞进行实验。
1.2.2 耐药细胞株的建立:采用体外逐步递增浓度方法诱导。取对数生长期的A549细胞加入含吉西他滨的培养液,吉西他滨从低浓度10 nmol/L浓度开始处理,作用24 h,敏感细胞逐渐死亡,弃去培养液,用PBS缓冲液洗3遍,换新鲜培养液,耐药细胞在不含药物的培养液中继续培养至对数期,逐渐提高吉西他滨的浓度,如此反复诱导,换液传代,直至该细胞株能够在2.0 μmol/L 吉西他滨浓度下稳定生长。历时8个月,最终得到耐受吉西他滨 2.0 μmol/L的细胞株A549/Gem。
1.2.3 RNA反转录及RT-qPCR检测:用Trizol提取各组细胞总RNA。取1 μg按反转录试剂盒说明反转录为cDNA。以cDNA为模板PCR扩增CXCR4,按照TaKaRau荧光定量试剂盒说明书,以cDNA为模版在LightCycler480Ⅱ荧光定量 PCR 仪上进行RT-qPCR反应。实验反应体系为:模版cDNA 1 μL,SYBR premix Ex TaqTMⅡ PCR Mix 10 μL,正、反向引物(20 μmol)共1.6 μL,CXCR4上游引物为 5′- CAATGACTTGTGGGTGGTTGTG -3′,下游引物为5′- AGGATGACTGTGGTCTTGAGGG -3′;以β-ACTIN为内参,β-ACTIN上游引物为 5′- GACTTAGTTGCGTTAC-ACCCTTTCT -3′,下游引物为5′- ACTGCTGTCACCTTCACCGTTC -3′,加RNase-free water 7.4 μL至总体积20 μL。反应条件为:95 ℃ 30 s,随后95 ℃ 10 s,55 ℃ 30 s,72 ℃ 20 s,共45 个循环。
1.2.4 细胞转染干扰载体CXCR4 shRNA(5’- CCAAUGACUUGUGGGUGGUUG:UGUU -3’)及阴性对照载体(negative control)(5’- CAGUACUUUUGUGUAGUACAA -3’)均购自上海Genechem公司。参照LipofectamineTM2000转染试剂盒说明书进行转染。转染前取对数生长期的A549细胞进行消化,细胞计数板计数,用含10 FBS无抗生素的DMEM培养基调整细胞数为6×106个/mL,以2×104个/mL于24孔培养板培养过夜,当细胞培养达到75% 左右融合后进行转染。瞬时转染48 h后消化细胞,按1:6接种于6孔板,用无抗生素的DMEM培养基培养。
1.2.5 细胞分组:实验中共分为3组:正常非小细胞肺癌细胞株(A549);吉西他滨耐药肺癌细胞株(A549/Gem);靶向沉默CXCR4后的吉西他滨耐药肺癌细胞株(A549/Gem- CXCR4)。
1.2.6 MTT法检测不同细胞株耐药指数(resistance index,RI)及对Gemcitabine的半数抑制浓度(50% inhibitory concentration,IC50) 取对数生长期的细胞,用胰酶消化,制成单细胞悬液,并调整细胞浓度至3.5×104个/mL,接种于96孔板,每孔接种100 μL,置于恒温培养箱中,孵育过夜,吸出原培养液,加入用培养液稀释的不同浓度各种药物200 μL,记为实验组。每个药物浓度设置6个复孔,同时设置空白对照组(仅含培养基)、细胞对照组(仅含细胞和培养液不含药物)。培养72 h后,加入5 mg/mL MTT溶液20 μL,置于培养箱中培养4 h,用移液枪洗出培养基,加入150 μL DMSO,震荡10 min使结晶溶解,酶标仪490 nm波长处测定吸光度值(OD),计算生长抑制率。生长抑制率=[(细胞对照组OD值-实验组OD值)/(细胞对照组OD值-空白对照组OD值)]×100%。根据生长抑制率计算药物半数抑制浓度(IC50)。IR=耐药细胞IC50/亲本细胞IC50。
1.2.7 Western blot检测:研究发现p38,JNK1/2及ERK1/2磷酸化蛋白表达水平与肿瘤化疗敏感性密切相关[8-10]。为进一步探究A549/Gem-CXCR4逆转Gemcitabine耐药的分子机制,本研究使用与Western blot技术检测试验各组p38,JNK1/2,ERK1/2磷酸化蛋白表达水平,选择生长良好的细胞1×107个,细胞裂解液裂解细胞,提取细胞总蛋白。BCA法测定蛋白浓度。SDS-PAGE凝胶电泳,半干转膜法转至PVDF膜。5%脱脂牛奶室温封闭1 h。加一抗稀释液(兔抗人CXCR4抗体1:500,兔抗人β-ACTIN抗体1:5000,抗phospho-p38抗体1:800,抗phospho-JNK1/2抗体1:500,抗phospho-ERK1/2抗体 1:400)4 ℃孵育过夜。TBST缓冲液洗膜后加相应二抗稀释液室温孵育1 h。ECL化学发光,暗室显影。胶片成像系统扫描记录,全自动凝胶成像系统对结果进行分析并拍照。蛋白表达以光密度表示,Quantity One软件进行灰度分析,以目的蛋白/内参蛋白β-ACTIN表示蛋白的相对表达量。

2 结果
2.1 CXCR4在A549与A549/Gem细胞株的表达特征 通过 2-ΔΔCT计算 CXCR4 表达量在A549/Gem相对A549细胞株倍数并作图。CXCR4在A549/Gem细胞株中的相对表达量为(6.3±0.56)要明显高于在A549细胞株中的相对表达量(1.10±0.37)(P<0. 01),见图1A。同样,Western blot结果显示,A549/Gem细胞株中CXCR4的表达量(灰度值为3218761±78311)要明显高于在A549细胞株中的相对表达量(灰度值为820064±53121)(P<0. 01),见图1B。

图1 CXCR4在A549与A549/Gem细胞株的表达特征(n=3) A:mRNA;B:蛋白**P<0. 01,与A549比较Fig.1 Expressions of CXCR4 in both A549 and A549/Gem cell lines(n=3) A:mRNA;B:protein**P<0. 01,compared with A549
2.2 CXCR4 shRNA对A549/Gem细胞株CXCR4表达的影响 经RT-qPCR检测,与正常阴性对照组细胞株(A549/Gem)相比,CXCR4 shRNA组A549/Gem细胞株(A549/Gem-CXCR4)细胞中CXCR4 mRNA表达受到了明显的抑制,其抑制率高达70%。CXCR4在A549/Gem-CXCR4细胞株中的相对表达量为(0.28±0.04)要明显低于在A549/Gem细胞株中的相对表达量(1.00±0.07)(P<0.05),见图2A。同样,Western blot检测提示,A549/Gem-CXCR4细胞株中CXCR4的表达量(灰度值为306417±38311)要明显低于在A549/Gem细胞株中的相对表达量(灰度值为2710994±63121)(P<0.05),见图2B。

图2 CXCR4 shRNA对A549/Gem细胞株CXCR4表达的影响(n=3)A:mRNA;B:蛋白**P<0. 01,与A549比较Fig.2 The effect of CXCR4 shRNA in A549/Gem cell lines(n=3)A:mRNA;B:protein**P<0. 01,compared with A549
2.3 MTT法检测A549,A549/Gem及A549/Gem-CXCR4细胞株对Gemcitabine的耐药浓度(IC50)及耐药指数(RI)分析 经MTT试验发现A549,A549/Gem和A549/Gem-CXCR4细胞株对Gemcitabine的IC50分别为(0.08±0.01)μmol/L,(14.01±0.21)μmol/L和(1.84±0.61)μmol/L,差异均有统计学意义(P<0. 05)。A549/Gem细胞株对Gemcitabine的RI是(127.12±12.28),远高于A549/Gem-CXCR4对Gemcitabine的RI值(27.3±0.98),(P<0. 05)。
2.4 Western blot法测定A549 A549/Gem及A549/Gem-CXCR4细胞株中p38,JNK1/2,ERK1/2磷酸化蛋白表达水平结果显示,与正常A549/Gem细胞株相比,CXCR4靶向沉默的A549/Gem-CXCR4 细胞株中ERK1/2,JNK1/2,p38的磷酸化受到了明显的抑制,见图3。Quantity One软件进行灰度分析Western blot检测条带的光密度,以β-ACTIN表达量作为蛋白定量分析内参,每组实验重复3次。与A549细胞株相比,A549/Gem细胞中p38的表达量以及JNK1/2和ERK1/2的磷酸化水平显著升高(P<0.05)。见表1。与A549/Gem相比,A549/Gem-CXCR4细胞株中p38的表达量以及JNK1/2和ERK1/2的磷酸化水平显著升高(P<0.05)。见表1。
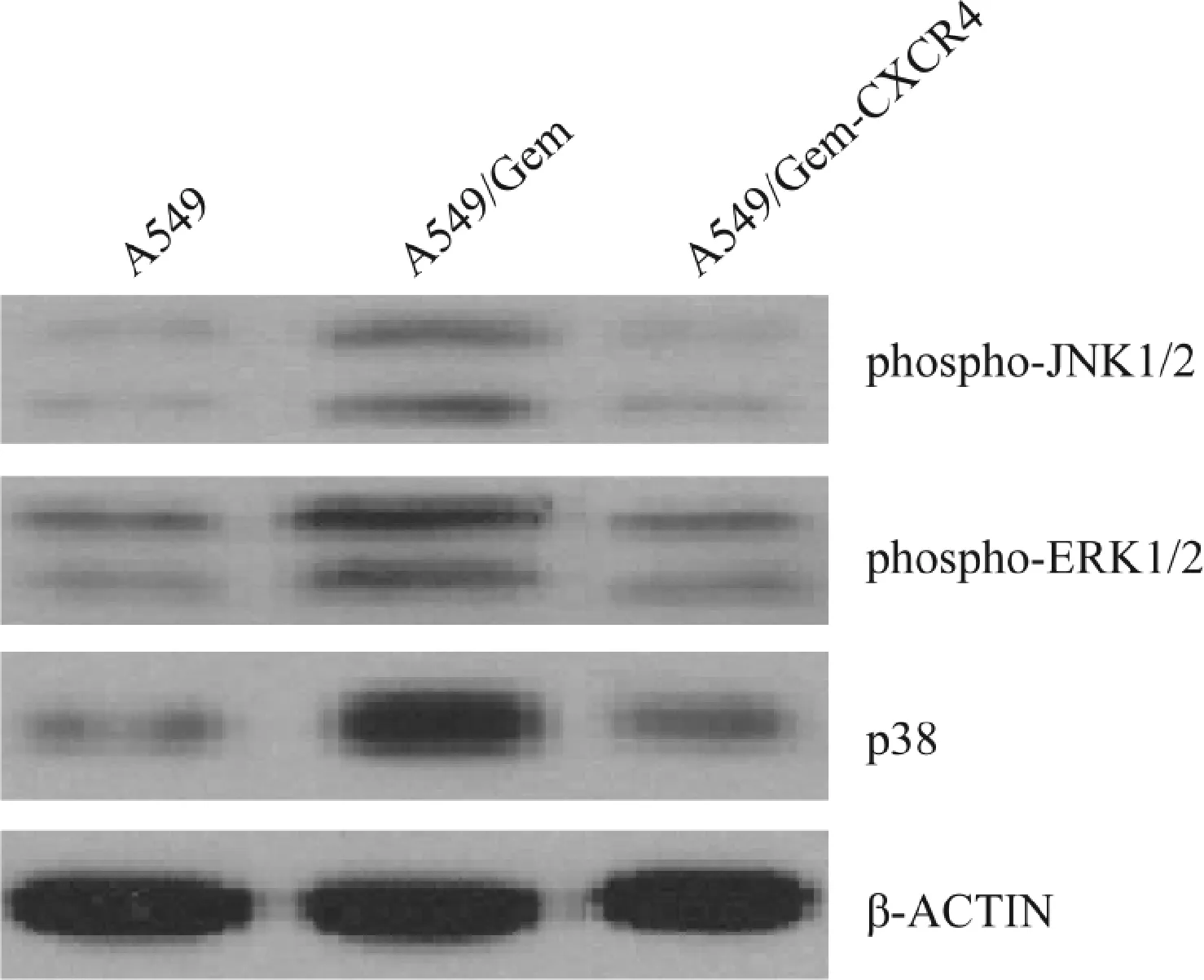
图3 A549,A549/Gem及A549/Gem-CXCR4细胞株中p38,JNK1/2,ERK1/2磷酸化蛋白表达变化(n=3)Fig.3 Expressions of p38, phosphor-JNK1/2 and phosphor-ERK1/2 in A549, A549/Gem and A549/Gem-CXCR4 cell lines(n=3)

组别p38phospho-ERK1/2phospho-JNK1/2β-actinA549934440±125688 603116±148758 198266±138248 4247626±237218 A549/Gem3794874±879348*1850118±133968*939474±137218*4146450±223778*A549/Gem-CX-CR41064940±231637△603116±142138△401540±124698△4345231±245718△
*P<0.01,与A549组相比,compared with A549;△P<0.01,与A549/Gem相比,compared with A549/Gem
3 讨论
大部分肿瘤细胞都表达趋化因子及趋化因子受体,在肿瘤的发生发展过程中趋化因子及其受体表现出关键的作用。因此,以趋化因子及其受体分子为靶点,通过抑制或拮抗趋化因子受体的信号传导来控制趋化因子系统的功能,可望用于有效防止恶性肿瘤的转移或复发,具有潜在的临床应用前景。CXCR4是组织表达最为广泛的细胞趋化因子受体之一,对多种恶性肿瘤细胞的生长和转移都具有重要的调节作用[11]。
本研究为了探究靶向沉默CXCR4的表达对吉西他滨耐药的影响,首先在体外实验构建了Gemcitabine耐药的肺癌细胞模型A549/Gem,通过现代生物学技术发现CXCR4的表达量在耐药肺癌细胞株A549/Gem明显升高,提示CXCR4可能与吉西他滨的耐药性有关;为了进一步验证本猜想,本研究构建了CXCR4靶向沉默的吉西他滨耐药细胞株A549/Gem-CXCR4,并探究A549/Gem-CXCR4细胞株对Gemcitabine耐药实验。结果发现,与A549/Gem相比,A549/Gem-CXCR4对Gemcitabine的敏感性明显提高,其耐药程度降低。为了进一步探究CXCR4的逆转耐药机理,本研究还考察了CXCR4对p38,phosphor-JNK1/2和phosphor-ERK1/2的表达量的影响。
c-Jun氨基末端激酶(c-Jun NH2-terminal kinase,JNK)是促分裂原活化蛋白激酶的一个亚群,为细胞凋亡信号传导中的重要介质。JNK包括了至少10种亚型,由JNK1、JNK2、JNK3基因编码[12]。研究表明JNK磷酸化蛋白的失活和肿瘤细胞化疗耐药性密切相关,JNK磷酸化蛋白的激活可以明显增加NSCLC对化疗和放疗的敏感性[13]。Teraishi等[12]对NSCLC耐Gemcitabine细胞株(H1299-GR)及其亲本细胞株(H1299)进行体外研究,结果发现H1299细胞株中JNK磷酸化蛋白被激活,而Gemcitabine诱导的H1299-GR细胞株中的JNK磷酸化蛋白始终未被激活。此外Teraishi等还在H1299细胞中通过一种特殊的JNK磷酸化蛋白阻断剂SP600125来阻滞JNK磷酸化蛋白的正常信号传导,结果表明Gemcitabine介导的细胞凋亡显著减少。另外对JNK1-JNK2融合蛋白的瞬时转染可以部分逆转H1299-GR对Gemcitabine的耐药。上述结果充分表明JNK在吉西他滨介导对NSCLC细胞毒过程中有着重要作用,同时JNK磷酸化蛋白活性的减少和Gemcitabine耐药密切相关[14]。
p38为一个38kDa的酪氨酸磷酸化蛋白激酶,在各种细胞外刺激作用下,p38三肽基区的苏氨酸、酪氨酸被双磷酸化而被激活。近年研究表明p38在全身炎症反应、休克、细胞迁移、心血管疾病等方面具有重要作用[15]。最新研究发现p38的活化与肺癌的耐药呈明显负相关[16-17]。ERK1/2对肿瘤的作用主要体现在促增殖方面,活化的ERK激酶可激活或灭活其他信号转导途径的关键效应分子(如NF-κB,Akt,CREB 等)以及重要的转录因子(Ets,Ap-1,C-myc),并能调节细胞周期相关因子(cyclin D,p21)和凋亡分子(bcl-2,bcl-XI,FasI)的表达,其持续活化最终促进细胞增殖和恶性转化[18]。研究提示,ERK磷酸化蛋白活化,亦可增加肿瘤的化疗敏感性[19]。进一步探究发现靶向沉默CXCR4后A549/Gem-CXCR4细胞株中p38,JNK和ERK1/2的磷酸化蛋白活化减少。
上述实验结果表明,靶向沉默CXCR4表达能够逆转肺癌细胞吉西他滨耐药性,提示CXCR4是肺癌临床放射治疗相关的有效分子靶点。该研究不仅为非小细胞癌吉西他滨耐药机制提供了依据,也为联合检测CXCR4可能有助于评估肺癌的预后,并可为以此为靶点的肿瘤治疗新药的开发研究提供理论依据。
[1] 钱桂生.为提高我国呼吸系统疾病的诊治水平而努力[J/CD].中华肺部疾病杂志:电子版,2012,5(1):1-3.
[2] 李羲,钱桂生.从已知危险因素人手降低肺癌发病率『J/ CD].中华肺部疾病杂志:电子版,2012,5(6):490492.
[3] Azzoli CG,Baker S Jr,Temin S,et a1.American Society of Clinical Oncology Clinical Practice Guideline update on chemotherapy for stage 1V non-small-cell lung cancer[J].J Clin Oncol,2009,27 (36):6251-6266.
[4] 史文超,刘晓民.吉西他滨治疗非小细胞肺癌耐药机制的研究进展[J].中华肺部疾病杂志:电子版,2013,6(6):63-65.
[5] 李磊,石学涛.SDF-1/CXCR4与肝细胞肝癌淋巴结转移的关系[J].中华肿瘤防治杂志,2011,18(9):737-740.
[6] 张建波,仲伟霞.胰腺癌CXCL12/CXCR4通路研究进展[J].中华肿瘤防治杂志,2012,19(8):634-637.
[7] 向作林,曾昭冲,唐钊猷,等.趋化因子受体4核阳性及血管内皮生长因子C和细胞角蛋白19的表达水平与肝细胞癌淋巴结转移风险的关系[J].中华肿瘤杂志,2010,32(5):344-349.
[8] Judde J G, Rebucci M, Vogt N, et al.Gefitinib and Chemotherapy Combination Studies in Five Novel Human Non Small Cell Lung Cancer Xenografts. Evidence Linking Egfr Signaling to Gefitinib Antitumor Response[J]. Int J Cancer,2007(120):1579-1590.
[9] Li J, Liang X, and Yang X, Ursolic Acid Inhibits Growth and Induces Apoptosis in Gemcitabine-Resistant Human Pancreatic Cancer Via the Jnk and Pi3k/Akt/Nf-Kappab Pathways[J]. Oncol Rep,2012(28):501-510.
[10] Zheng C, Jiao X, Jiang Y, et al.Erk1/2 Activity Contributes to Gemcitabine Resistance in Pancreatic Cancer Cells[J]. J Int Med Res,2013(41):300-306.
[11] 常远鸿,李汀,阴俊,等.靶向沉默CXCR4基因抑制肝胞癌侵袭体外研究[J].中华肿瘤防治杂志,2013,20(20):1569-1579.
[12] Teraishi F,Zhang L,Guo W,et a1.Activation of c-Jun NH2-terminal kinase is required for gemcitabine’s cytotoxic effect in human lung cancer H1299 cells[J].FEBS Lett,2005,579(29):6681-6687.
[13] Vicent S,Garayoa M,López-Picazo JM,et al.Mitogen-activated protein kinase phosphatase-1 is overexpressed in non-small cell lung cancer and is an independent predictor of outcome in patients[J].Clin Cancer Res,2004,10(11):3639-3649.
[14] 胡南均,干惠珠,卢振霞.非小细胞肺癌吉西他滨化疗耐药相关酶[J].国际肿瘤学杂志,2009,36(8):604-606.
[15] Lin HH,Chen JH.Huang CC,et al.Apoptotic effect of 3,4-dihydroxy-benzoic acid on human gastric carcinoma cells involving JNK/p38 MAPK signaling activation[J].Int J Cancer,2007,120(11):2306-2316.
[16] Yan HQ, Huang XB, Ke SZ, et al., Interleukin 6 Augments Lung Cancer Chemotherapeutic Resistance Via Ataxia-Telangiectasia Mutated/Nf-Kappab Pathway Activation[J]. Cancer Sci,2014(105):1220-1227.
[17] Kim YJ, Choi WI, Jeon BN, et al., Stereospecific Effects of Ginsenoside 20-Rg3 Inhibits Tgf-Beta1-Induced Epithelial-Mesenchymal Transition and Suppresses Lung Cancer Migration, Invasion and Anoikis Resistance[J].Toxicology,2014(322):23-33.
[18] 梁佳,包翠芬,魏嘉,等.P38和ERK1/2在肝细胞癌中的表达及意义[J].中国组织化学与细胞化学杂志,2009,18(2):202-205.
[19] Chen TJ, Zhou YF, Ning JJ, et al., Nbm-T-Bmx-Os01, an Osthole Derivative, Sensitizes Human Lung Cancer A549 Cells to Cisplatin through Ampk-Dependent Inhibition of Erk and Akt Pathway[J].Cell Physiol Biochem,2015(36):893-906.
(编校:谭玲)
Study on the reversion effect of targeting silence CXCR4 gene on Gemcitabine-resistance in non-small cell lung cancer
WANG Li-wenΔ, SHEN Xiao-jie, YU Ru-yun, LIN Li-li
(Department of Rehabilitation,Wuxi Technical Vocational College, Wuxi 214028, China)
ObjectiveTo explore the reversion effect of Gemcitabine-resistance A549 cell (A549/Gem) by silencing CXCR4.MethodsA549 cell was induced by continuous stepwise exposure to Gemcitabine in order to obtain Gemcitabine-resistance A549 cell (A549/Gem) in vitro. The CXCR4 expressions level of A549 and A549/Gem were detected by Quantitative RT-PCR (RT-qPCR) and Western blot analyses. The CXCR4 shRNA vector was transfected into the A549/Gem cell by targeting silence CXCR4. Furthermore, MTT assay was used to explore the IC50and RI in A549, A549/Gem and A549/Gem-CXCR4 cells. Moreover, Western blot analysis was performed to detect the expressions of phospho-JNK, phospho-p38 and phospho-ERK 1/2 in A549, A549/Gem and A549/Gem-CXCR4 cells.ResultsGemcitabine-resistance A549 cell (A549/Gem) was successful constructed by using continuous stepwise exposure to Gemcitabine in vitro. The expression level of CXCR4 was up-regulated in A549/Gem cell than in A549 cell. The CXCR4 shRNA vector could significantly decrease CXCR4 expression in A549/Gem cell. The IC50 values of Gemcitabine in A549, A549/Gem and A549/Gem-CXCR4 cell were (0.08±0.01) μmol/L, (14.01±0.21)μmol/L and (1.84±0.61)μmol/L, respectively. The RI value of Gemcitabine was (127.12±12.28) in A549/Gem cells, while the value of RI was (27.3±0.98) in A549/Gem-CXCR4 cells. The expression level of phospho-JNK, phospho-p38 and phospho-ERK 1/2 were also markedly inhibited in A549/Gem-CXCR4 cell than in A549/Gem cell. ConclusionCXCR4 is up-regulated in A549/Gem cell. Targeting silence CXCR4 can successfully reverse drug-resistance of Gemcitabine in A549/Gem cells, which hints CXCR4 is associated with lung cancer radiation therapy as an effective molecular target.
non-small cell lung cancer; Gemcitabine; CXCR4; drug-resistance
无锡市医院管理中心科研项目 (YGZXM14021)
王立文,通信作者, 男,硕士,副教授,研究方向:康复治疗技术研发,E-mail: wangliwen0310@163.com。
R734.2
A
1005-1678(2015)12-0024-05
