siRNA抑制survivin基因表达对类风湿关节炎滑膜成纤维细胞增殖与凋亡的影响
2015-07-07马莎林俊晋松李芹张虹于亮
马莎,林俊Δ,晋松,李芹,张虹,于亮
(1.云南省第一人民医院 风湿免疫科,云南 昆明 650032;2.中国医学科学院 医学生物学研究所遗传室,云南 昆明 650118)
siRNA抑制survivin基因表达对类风湿关节炎滑膜成纤维细胞增殖与凋亡的影响
马莎1,林俊1Δ,晋松1,李芹1,张虹1,于亮2
(1.云南省第一人民医院 风湿免疫科,云南 昆明 650032;2.中国医学科学院 医学生物学研究所遗传室,云南 昆明 650118)
目的 研究靶向存活素(survivin)的小干扰RNA(small interfering RNA,siRNA)抑制survivin基因表达对类风湿关节炎滑膜成纤维细胞(rheumatoid arthritis synovial fibroblasts,RASFs)增殖与凋亡的影响。方法 体外分离培养RA患者滑膜成纤维细胞(RASFs),设计合成靶向survivin的siRNA及阴性对照,用脂质体法转染RASFs细胞;实时定量聚合酶链反应和蛋白印迹法检测RASFs中survivin的mRNA表达及蛋白水平。四甲基偶氮唑蓝法检测细胞增殖;TUNEL法检测细胞凋亡。结果 实验组与阴性对照siRNA组及空白对照组相比,转染48h后滑膜成纤维细胞survivin的mRNA及蛋白表达水平明显下降(P<0.05)。 实验组与阴性对照siRNA组及空白对照组相比,转染后的滑膜成纤维细胞增殖能力明显下降(P<0.05)。实验组转染后24h、48h、72h生长抑制率分别为(11.5±2.6)%、(26.2±3.4)%、(47.6±4.1)%,于转染后72小时最为显著。实验组凋亡率为(23.87±1.6)%,显著高于阴性对照组(9.72±1.15)%和空白对照组(8.70±1.09) %(均P<0.05)。结论 靶向survivin的siRNA通过下调survivin表达水平,抑制滑膜成纤维细胞增殖并促进其凋亡。
存活素;类风湿关节炎;滑膜成纤维样细胞; siRNA;凋亡
类风湿关节炎(rheumatoid arthritis,RA)是以关节滑膜组织炎性增生、新生血管形成及关节破坏为主要特征的慢性、进行性、自身免疫性疾病[1]。RA滑膜成纤维细胞(RA synovial fibroblasts,RASFs)是介导滑膜炎症反应、血管翳形成和关节破坏的主要效应细胞[2]。
近年来,研究发现滑膜细胞凋亡障碍是RA发病的主要机制之一[3]。机体内存活素 (survivin)作为凋亡抑制蛋白(inhibitor of apoptosis of protein ,IAP)家族成员,不仅具有调控细胞凋亡细胞周期的双重功能,而且可促进细胞转化并且参与细胞的有丝分裂、血管的生成等[4]。已有研究表明,在类风湿性关节炎患者的滑膜组织,甚至成纤维样滑膜细胞、滑液以及外周血中均发现有survivin异常高表达,且与关节侵蚀程度呈正相关[5-6]。Bokarewa等人发现血清中的survivn抗体能减缓这种侵袭过程,用survivin反义寡核苷酸下调survivin表达可以导致IL-6水平下降,从而减轻炎症反应。深入认识和揭示survivin在RA滑膜凋亡异常及RA发病机制中的作用对寻找RA的基因靶向治疗的方法具有重要意义。
本实验旨在验通过构建靶向survivin的小干扰RNA(small interfering RNA,siRNA)转染RASFs,观察抑制survivin对RASFs增殖及凋亡的影响,为类风湿关节炎基因靶向治疗提供新的思路。
1 材料与方法
1.1 材料:滑膜组织取材自云南省第一人民医院风湿免疫科关节镜下3例行部分切除膝关节滑膜手术的RA患者,其均符合2009年由美国风湿病学会修订RA的诊断标准[7],并排除其它自身免疫性疾病、感染、肿瘤等关节相关疾病。所有患者均签署知情同意书。
主要试剂:澳洲胎牛血清FBS、DMEM高糖培养基、0.25%胰蛋白酶(美国Gibco公司),噻唑蓝(MTT)、二甲基亚砜(DMSO)、II型胶原酶(美国Sigma),survivin兔抗人单克隆抗体(Abcam公司),GAPDH鼠抗人单克隆抗体(上海abmart公司),SYBR Green Master(Roch公司),Lipofectamine2000(Invitrogen公司),小干扰RNA(siRNA)序列由上海吉玛制药技术有限公司合成。实时荧光定量PCR引物(Invitrogen公司),cDNA第一链合成试剂盒(北京全式金),RI-PA裂解液、蛋白浓度测定试剂盒、TUNEL细胞凋亡检测试剂盒显色法(碧云天生物技术公司)。
1.2 方法
1.2.1 培养RA滑膜成纤维细胞:在无菌术室条件之下,关节镜手术获取RA患者的滑膜组织,一次性平皿中PBS冲洗组织4~5次,眼科剪充分剪碎至糊状,加入约30倍体积的Ⅱ型胶原酶(1 mg/mL)于37 ℃含5%CO2细胞培养箱内消化4 h,每15 min取出振摇一次,对其进行1000 r/min离心,在5 min之后,去除其中胶原酶,并添加PBS液洗进行3次离心操作,并应用细胞筛除去组织中存在的碎块,适量加入15%胎牛血清高糖DMEM培养液(含青链霉素双抗)后,用巴氏细胞吸管反复吹打后转移至细胞培养瓶放入培养箱,每过3 d后更换1次培养液,并除去其中未贴壁的细胞,2周之后,成纤维细胞贴壁生长密度可以达到85%~90%,并可按1:3比例设置,培养传代细胞。对于本实验中,将应用3~7代滑膜成纤维细胞。
1.2.2 siRNA转染滑膜成纤维细胞:转染前24 h选择对数生长期RASFs细胞,按照4×105个/孔密度接种至6孔板,每孔使用2 mL不含抗生素10%FBS的高糖DMEM培养基培养,融合密度达80%时进行转染,设空白对照组(加入DMEM高糖培养基)、阴性对照组(加入阴性对照序列siRNA)、实验组(加入合成的survivin-siRNA),按照转染试剂Lipofectamine2000说明进行实验。实验组siRNA-survivin靶序列5’-GAAGCAGTT-TGAAGAATTA-3’NT391~409,阴性对照siRNA 5’-TTCTCCG-AACGTGTCACGT-3’。
1.2.3 实时荧光定量PCR检测:可根据PCR检测survivin mRNA的表达情况,收集转染48 h后的细胞,依据Trizol方法提取转染细胞中的总RNA,并应用紫外分光光度计检测其纯度和浓度。采用合格的RNA标本,每组总RNA各2 μg,按北京全式金cDNA第一链合成试剂盒说明书合成cDNA。以cDNA作为模板,采用SYBR荧光染料法进行实时定量PCR检测各组mRNA表达,反应体系为25 μL,每个样品分别设计3个重复。survivin上游引物:“5’-GACCACCGCATCTCTACATTC-3’ ”,下游引物:“5’-TGCTTTTTATGTTCCTCTATGGG-3’ ”;GAPDH上游引物为:“5’-ACCACAGTCCATGCCATCAC-3’ ”,下游的引物为:“5’-CCACCACCCTGTTGCTGTAG-3’ ”;实时定量PCR仪循环设置:95 ℃10 min预变性,95 ℃ 15 s,58 ℃30 s,进行40个循环。用相对定量方法2-△△Ct值[8]表示目的基因mRNA的表达水平。
1.2.4 检测survivin蛋白表达水平:转染48h后收集细胞并提取蛋白,BCA法检测蛋白浓度。将定量后的蛋白(30 μg)用15%的十二烷基硫酸钠一聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离胶进行电泳分离,并转移至聚偏二氟乙烯(poly vinylidenefluoride,PVDF)膜,然后用5%的脱脂奶粉进行封闭1 h,孵育survivin一抗(1:2000稀释)、和内参GAPDH一抗(1:10000稀释),4 ℃孵育过夜。TBST洗膜3次,每次10 min,用特异性辣根过氧化物酶去标记二抗( 稀释比例1:7000),在室温内孵育1 h,应用TBST3次洗膜,每次10 min。最后用化学发光试剂(chemiluminescence,ECL)显色并于暗室曝光。标准化的数值由survivin目的条带和GAPDH内参条带的比值来确定。用Bio-Rad凝胶成像分析系统对电泳条带进行密度扫描,用Scion-Image软件对图像进行分析,测目标蛋白和内对照GAPDH蛋白二者电泳条的灰度值,以其得出的比值来表示目标蛋白的相对表达量。每个样本设2个复孔,实验重复3次。表达抑制率=(1-实验组蛋白相对表达量/空白对照组蛋白相对表达量)×100%
1.2.5 四甲基偶氮唑蓝(methyl thiazoly tetrazolium,MTT法)检测抑制survivin表达对RASFs增殖的影响:取对数生长期的RASFs,转染前24 h按5×103个/孔的比例将细胞接种到96孔板上,并根据上述分组,依照96孔板的参数说明规则进行转染操作,在转染6 h之后,完全更换其培养基,并在隔段培养24 h、48 h、72 h过程中,均在每孔中加入5 mg/mL浓度的MTT30 μL,37 ℃作用4 h,PBS轻微洗涤2次后每孔加入150 μL DMSO,室温避光振摇15 min。每组细胞设3个复孔,测定490 nm波长下的吸光度(A)值。实验重复3次。细胞生长抑制率(%)=(1-实验组A值/空白对照组A值)×100%。
1.2.6 细胞凋亡分析:采用TUNEL法检测细胞凋亡。接种细胞至爬片后按上述方法转染及分组,培养48 h后收集细胞爬片,按照试剂盒说明书进行操作。可在光镜下去观察细胞的染色情况,对于细胞核中,若是出现棕黄色颗粒,就表示是阳性细胞,也就是凋亡的细胞。对于每张爬片中,应用5个高倍镜视野( 400×)计数其凋亡阳性细胞核数以及总细胞核数,则细胞凋亡率 = 阳性细胞核数/总细胞核数×100%,可取其平均值。

2 结果
2.1 Western blot检测survivin蛋白表达 对于转染48h之后,在实验组以及阴性对照组与空白对照组中,其survivin蛋白的相对表达量是0.11±0.03、0.63±0.09、0.66±0.09(图1),实验组显著低于空白对照组和阴性对照组(F=68.13,P<0.05),在阴性对照组和空白对照组之间,其差异无统计学意义。与空白对照组比较,实验组survivin蛋白表达明显下降,表达抑制率为83.3%。Western blot的结果与荧光实时定量PCR的结果一致,与阴性对照组和空白对照组相比较,转染survivin- siRNA的实验组RASFs细胞中,survivin蛋白被显著抑制。见表1。

表1 转染48 h后各组结果比较Tab.1 Comparison of the results after transfection 48 ±s)
*P<0.05,与阴性对照组比较,compared with the negative control group;#P<0.05,与空白对照组比较,compared with the blank control group
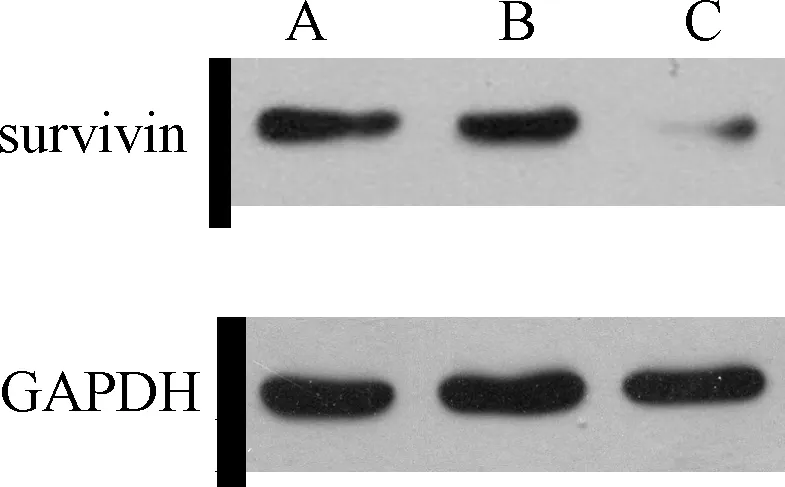
图1 各组滑膜细胞survivin的蛋白表达量A:空白对照组;B:阴性对照组;C:实验组Fig.1 The protein expression of Survivin in synovial cells of each groupA: Blank control group, B: Negative control group, C: Experimental group
2.2 survivin mRNA表达的实时荧光定量PCR检测结果 在转染48 h之后,在实验组、阴性对照组以及空白对照组中,其survivin mRNA相对表达量分别是(21.0±2.6)%、(95.3±3.5)%、100%,实验组显著低于空白对照组以及阴性对照组(F=914.6,P<0.05),同时,对比阴性对照组与空白对照组,其差异无统计学意义(F=0.065,P>0.05)。见表1。
2.3 survivin-siRNA干扰RASFs细胞后对其凋亡的影响 转染48 h后,实验组细胞凋亡率为(23.87±1.6)%,与空白对照组(8.70±1.09)%和阴性对照组(9.72±1.15)%比较,实验组细胞凋亡率明显增加(F=167.10,P<0.05 )。在阴性对照组和空白对照组中的细胞凋亡率,差异无统计学意义(F=0.30,P>0.05),提示干扰survivin基因表达后促进了RASFs细胞的凋亡。见表1。
2.4 MTT法检测各组细胞增殖活性 转染24 h后实验组细胞生长速度较空白对照组和阴性对照组减慢(F=18.58,P<0.05),生长抑制率为(11.5±2.6)%,转染48 h后细胞增殖能力较空白组和阴性对照组受到明显抑制(F=112.44,P<0.05),生长抑制率为(26.2±3.4)%。转染72 h后,实验组细胞生长抑制率为(47.6±4.1)%,与对阴性照组比较,实验组细胞的生长抑制则更为明显 (P<0.05);在阴性对照组与空白对照组中,在转染后各个时点中,其细胞生长抑制率差异无统计学意义。见表2。
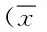

组别24h48h72h空白对照组0.159±0.0070.170±0.0040.185±0.007实验组0.136±0.006*#0.126±0.005*0.097±0.005*阴性对照组0.156±0.0050.167±0.0050.186±0.004F值18.58112.44340.23p值0.0010.0010.001
*P<0.05,同一转染时间与阴性对照组比较,compared with the negative control group at the same transfection time;#P<0.05,同一转染时间与空白对照组比较,compared with the blank control group at the same transfection time
3 讨论
正常的滑膜组织仅由1~2层细胞构成,而RA可增至8~10层,这些过度增殖的滑膜细胞向关节软骨及骨组织浸润性生长,最后导致关节畸形及功能障碍[9]。RA滑膜成纤维细胞凋亡异常在RA的疾病发展中起到关键作用,最终导致滑膜病理性增生、关节软骨破坏等一系列病理生理改变[3]。在Ahn JK等人研究中,应用免疫组化的方法,发现在RA关节滑膜成纤维细胞中,survivin表达的水平高于正常人,认为滑膜成纤维细胞是形成产生survivin的一个重要来源;在凋亡抑制蛋白(inhibitor of apoptosis proteins,IAP)家族中,survivin是具有可以抑制细胞发生凋亡,在其研究中表明,在常见的恶性肿瘤中亦可发现survivin的高表达[11]。对于RA患者中,可发现在滑膜细胞、滑液以及外周血中,均有survivin高表达发生,而对于正常成熟滑膜细胞以及骨骼组织之中,则无survivin表达异常,且survivin的表达与RA病情活动及骨侵蚀程度呈正相关,而抗Survivin抗体与关节侵蚀呈负相关,同时发现,RA患者经抗风湿药物(DMARS)治疗后,以及对于改善病情的RA患者,其滑膜细胞中的Survivin高表达水平有明显降低趋势;临床中,应用Survivin反义寡核昔酸,也可下调IL-6炎性因子,这些研究使得survivin靶向治疗类风湿关节炎成为可能[4-7]。
RNA干扰(RNA interference RNAi),就是在短双链RNA诱导以及同源mRNA之间的降解过程中,能够对基因沉默,运用RNAi干扰技术,可以在细胞基因转录后,抑制基因水平表达,可研究控制基因功能[12]。本研究合成靶向survivin的siRNA,转染RA滑膜成纤维细胞,48h后滑膜成纤维细胞survivin的mRNA及蛋白表达水平明显下降。实验组survivin基因mRNA相对表达量为(21.0±2.6)%,蛋白的相对表达量为(0.11±0.03),与阴性对照组以及空白对照组进行比较,P<0.05,细胞凋亡在阴性对照组和空白对照组中进行比较,则差异无统计学意义,进一步证实转染特异性survivin-siRNA在一定程度抑制了RA滑膜成纤维细胞survivin基因mRNA及蛋白水平的表达,而阴性序列siRNA对survivin的表达无影响。转染后24 h、48 h、72 h实验组细胞与阴性对照与空白对照组进行比较,其细胞的增殖能力产生下降,其差异有统计意义(P<0.05),细胞增殖的抑制效应于转染24 h后出现,随着时间的增加抑制效应递增。细胞凋亡检测证明转染48h后实验组凋亡率为(23.87±1.6)%,较阴性对照组和空白对照组显著增加(P<0.05),证明下调survivin基因的表达可促进RASFs细胞凋亡。
综上所述,本研究证实了靶向沉默survivin表达有抑制RA滑膜成纤维细胞增殖及促进其凋亡的作用,提示survivin可能在RA滑膜病理性增生的调控中具有重要作用,从而具有作为基因靶点治疗RA的潜能。
[1] Woods JM,Katschke KJ Jr, Tokuhira M, et al. Reduction of inflammatory cytokines and prostaglandin E2 by IL-13 gene therapy in rheumatoid arthritis synovial [J].J Immunol, 2000, 165(5): 2755-2756.
[2] Firestein GS. Evolving concepts of rheumatoid arthritis[J].Nature,2003,423(6837):356-361.
[3] Baftok B,Firestein GS. Fibroblast-like synoviocytes: key effector cells in rheumatoid arthritis[J].Immunol Rev,2010, 233(1):233-235.
[4] Kelly RJ, Lopez Chavez A, Citrin D, et al. Impacting tumor cell fate by targeting the inhibitor of apoptosis protein survivin[J].Mol Cancer, 2011(10):35.
[5] Svensson B, Hafstrom L, Forslind K, et al. Increased expression of proto-oncogene survivin predicts Joint destruction and persistent disease activity in early rheumatoid arthritis[J].Ann Med, 2010, 42 (1): 45-54.
[6] Ahn JK, Oh JM, Lee J, et al. Increased extracellular survivin in the synovial fluid of rheumatoid arthritis patients: fibroblast-like synoviocytes as a potential source of extracellular survivin[J].Inflammation, 2010, 33(6): 381-388.
[7] 赵金霞,王志敏,栗占国. 以抗环瓜氨酸肽抗体改进对1987年美国风湿病学会关于类风湿关节炎分类标准的探讨[J].中华风湿病学杂志,2009,13(4):236-239.
[8] Schmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative C(T) method[J].Nat Protoc 2008,3(6):1101-1108.
[9] Hoss EH,Brenner MB.The role and therapeutic implications of fibroblast-like synoviocytes in inflammation and cartilage erosion in rheumatoid arthritis[J].Immunol Rev, 2008(223):252-270.
[10] Ahn JK, Oh JM, Lee J, et al. Increased extracellular survivin in the synovial fluid of rheumatoid arthritis patients: fibroblast-like synoviocytes as a potential source of extracellular survivin[J].Inflammation, 2010, 33(6): 381-388.
[11] Szafer-Glusman E, Fuller MT, Giansanti MG.Role of survivin in cytokinesis revealed by a separation-of-function allele[J].Mol Biol Cell,2011,22(20):3779-3790.
[12] Goyal BR, Patel MM, Soni MK,et al. Therapeutic opportunities of small interfering RNA[J].Fundam Clin Pharmcol, 2009,23(4):367-386.
(编校:谭玲)
siRNA inhibition of survivin gene expression in rheumatoid arthritis synovial fibroblast proliferation and apoptosis
MA Sha1, LIN Jun1Δ, JIN Song1, LI Qin1, ZHANG Hong1, YU Liang2
(1. Department of Rheumatism and Immunology, Yunnan First People’s Hospital, Kunming 650032, China; 2.Institute of Medical Biology, Chinese Academy of Medical Genetics, Kunming 650118, China)
ObjectiveTo study the targeting survivin small interfering RNA (siRNA) to inhibit proliferation and apoptosis survivin gene expression in rheumatoid arthritis synovial fibroblasts (RASFs).MethodsRA patients were isolated and cultured in vitro synovial fibroblasts (RASFs), designed and synthesized siRNA targeting survivin and negative control, by liposome transfection RASFs cell; real-time quantitative polymerase chain reaction (PCR) and Western blot RASFs detect mRNA expression and protein levels of survivin. Tetrazolium blue (MTT) assay of cell proliferation; TUNEL assay apoptosis.ResultsThe experimental group compared with the negative control siRNA group and control group, 48h after transfection of synovial fibroblasts survivin mRNA and protein expression levels were significantly decreased(P<0.05). The experimental group compared with the negative control siRNA group and control group, synovial fibroblast proliferation after transfection significantly decreased(P<0.05). After the experimental group transfected 24h, 48h, 72h growth inhibition rates were (11.5±2.6)%, (26.2±3.4)%, (47.6±4.1)%, at 72 hours after transfection most significant. The rate of apoptosis in experimental group (23.87±1.6)%, significantly higher than the negative control group (9.72±1.15)% and the control group (8.70±1.09)% (allP<0.05). ConclusionsiRNA targeting survivin expression levels through reducing survivin, inhibit synovial fibroblast proliferation and promotes apoptosis.
survivin; rheumatoid arthritis; synovial fibroblast-like cells; siRNA; apoptosis
云南省科技厅昆明医科大学联合专项基金(2011FB215)
马莎,女 ,硕士,主治医师,研究方向:自身免疫性疾病的临床及基础研究,E-mail:15925203463@126.com;林俊,通信作者,女,本科,副主任医师,研究方向:弥漫性结缔组织病的诊治,E-mail:lunjun06@sina.com。
R593.22
A
1005-1678(2015)12-0017-04
