新型希夫碱钌配合物的抗肿瘤作用研究
2015-07-07赵成亮张宝琦杜元良闫鹤张四喜陈宾
赵成亮,张宝琦,杜元良,闫鹤,张四喜,陈宾Δ
(1.承德医学院附属医院,河北 承德 067000;2.吉林大学第一医院,吉林 长春 130021)
新型希夫碱钌配合物的抗肿瘤作用研究
赵成亮1,张宝琦1,杜元良1,闫鹤2,张四喜2,陈宾1Δ
(1.承德医学院附属医院,河北 承德 067000;2.吉林大学第一医院,吉林 长春 130021)
目的 探讨新型希夫碱钌配合物对胃癌SGC-7901细胞生长增殖和细胞凋亡的影响。方法 将胃癌SGC-7901细胞根据不同浓度的新型希夫碱钌配合物处理分为10、30、50 μmol/L组,另设DMSO空白组。MTT法检测新型希夫碱钌配合物对胃癌细胞增殖的影响,流式细胞术检测各组细胞凋亡及细胞周期变化。结果 MTT结果显示SGC-7901细胞生长抑制率随新型希夫碱钌配合物浓度的增加而增加,各剂量组在24、48、72 h的抑制率均显著高于空白组(P<0.05)。流式细胞术结果显示浓度为10、30、50 μmol/L的新型希夫碱钌配合物组的细胞凋亡率分别为(17.64±1.21)%、(26.47±0.61)%、(55.63±1.49)%,均显著高于空白组(P<0.05)。随着新型希夫碱钌配合物浓度升高,G1期细胞所占的百分比逐渐增加。结论 新型希夫碱钌配合物能够抑制胃癌SGC-7901细胞的增殖,促进细胞凋亡,并使细胞停滞在G1期。
新型希夫碱钌配合物; 胃癌SGC-7901细胞;细胞增殖;细胞凋亡;细胞周期
自从Rosenberg[1]发现顺铂的抗肿瘤效应以来,化疗在治疗肿瘤过程中的地位与日俱增。近年来随着顺铂、卡铂等化疗药物应用于临床,在抑制肿瘤生长的同时耐药性也日益突出。探索新的抗肿瘤药物势在必行。钌以及其配合物由于毒性较低、容易吸收、体内排泄快等优点,被视为最有潜力的抗肿瘤药物之一[2-3]。研究发现希夫碱具有抗肿瘤、抑菌、清除自由基等作用[1,4],且其氮原子上的孤对电子极易与多种金属元素形成配合物而具备新的作用[5]。本研究采用的新型希夫碱钌配合物,为新型呋喃酰基吡唑啉酮缩芳胺希夫碱钌配合物(见图1),国际上尚无对该物质的报道,本文旨在通过研究其抗肿瘤作用为新型抗肿瘤药物应用于临床提供理论基础。
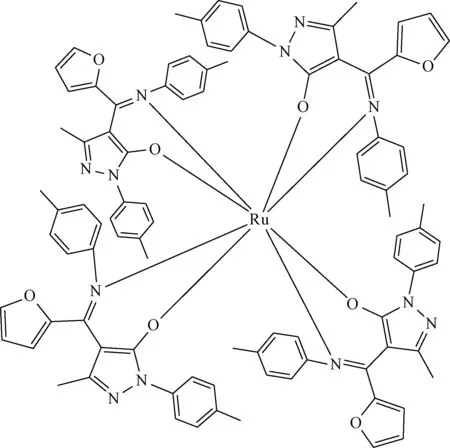
图1 新型希夫碱钌配合物结构式Fig.1 The constitutional formula of a novel schiff base ruthenium coordination compound
1 材料与方法
1.1 材料
1.1.1 细胞株:胃癌SGC-7901细胞,由吉林大学白求恩医学院微生物实验室提供。
1.1.2 新型希夫碱钌配合物:由河北民族师范学院化学系张恒强博士惠赠。
1.1.3 主要试剂:胎牛血清、DMEM高糖培养基、青链霉素、PBS磷酸盐缓冲液、RPMI-1640培养液(均购自Hyclone);噻唑蓝(Amersco公司);PI染色试剂盒、FITC/PI细胞凋亡试剂盒(上海贝博生物)。
1.1.4 主要仪器:微孔滤器(Millipore公司);96孔培养板(Coring公司);Nanodrop2000分光光度计(Thermo公司);CO2培养箱(Forma公司);FaCS CantoTM II system流式细胞仪(Becton-Dickinson Bioscience公司)。
1.2 方法
1.2.1 溶液配制:新型希夫碱钌配合物1.8g溶于1L DMSO中,浓度为0.1 mmol/L,再用RPMI-1640完全培养液稀释成10、30、50 μmol/L溶液,用微孔滤器过滤,于4 ℃保存。
1.2.2 MTT实验:将处于对数生长期的胃癌细胞株SGC-7901,用胰蛋白酶消化成细胞悬液。将SGC-7901细胞以4×104个/孔的密度接种于96孔板,分别加入10、30、50 μmol/L的新型希夫碱钌配合物,即10 μmol/L组、30 μmol/L组、50 μmol/L组。空白组中加入0.1%DMSO。作用24、48、72 h后加入20 μLMTT溶液(5 mg/mL),37 ℃,5%CO2条件下培养4 h。加入150 μL DMSO溶解后,酶标仪上测定OD490。
1.2.3 流式细胞术检测细胞凋亡:细胞分组同1.2.2。加不同浓度新型希夫碱钌配合物作用于SGC-7901细胞48 h,收集细胞,用4 ℃预冷的PBS洗涤2次,加250 μL结合缓冲液重悬细胞,调节浓度为1×106个/mL。取100 μL细胞悬液于流式管中,再加入5 μL AnnexinV/FITC和10 μL PI(20 μg/mL),混匀后室温避光孵育15 min,之后加入400 μL PBS,使用流式细胞仪分析细胞凋亡情况。实验重复3次。
1.2.4 流式细胞术检测细胞周期:细胞分组同1.2.2。加不同浓度新型希夫碱钌配合物作用于SGC-7901细胞48 h后,收集细胞,70%冰醋酸固定,用PBS洗涤后1000 r/min离心5 min,加入1 mg/mL RNase A和50 μg/mL PI,反应并染色30 min,用流式细胞仪检测细胞并使用Modfit软件分析各组细胞周期分布情况。实验重复3次。

2 结果
2.1 MTT实验 不同浓度新型希夫碱钌配合物作用于胃癌SGC-7901细胞24、48、96 h,抑制率明显上升,与空白相比较差异均有统计学意义(P<0.05)。其中以50 μmol/L新型希夫碱钌配合物作用胃癌SGC-7901细胞72 h对胃癌细胞的抑制作用最明显,达66.39%。见表1。

表1 新型希夫碱钌配合物对胃癌SGC-7901细胞增殖的影响±s,n=5)Tab.1 Effect of a novel schiff base ruthenium coordination compound on cell proliferation of gastric cancer SGC-7901 ±s,n=5)
*P<0.05,与空白组相比,compared with blank group
2.2 流式细胞术检测细胞凋亡 不同浓度新型希夫碱钌配合物作用胃癌细胞SGC-7901 48 h后的流式细胞检测的凋亡结果显示,空白组的细胞凋亡率为(11.35±1.18)%,浓度为10、30、50 μmol/L的新型希夫碱钌配合物的抑制率分别为(17.64±1.21)%、(26.47±0.61)%、(55.63±1.49)%。与空白组相比差异均有统计学意义(P<0.05)。见图2。

图2 流式细胞仪检测细胞凋亡Fig.2 Cell apoptosis detected by flow cytometry instrument
2.3 流式细胞术检测细胞周期分布 流式细胞结果显示,随着新型希夫碱钌配合物浓度的增加,G1期细胞所占的百分比逐渐增加,而S期细胞所占的百分比明显减少,G2期的细胞数量未见明显的变化。这说明细胞的生长停滞在G1期,新型希夫碱钌配合物可通过阻止细胞周期由G1期进入S期和G2期。从而延长细胞的生长周期,降低细胞增殖速率。见图3。

图3 流式细胞仪检测细胞周期Fig.3 Cell cycle detected by flow cytometry instrument

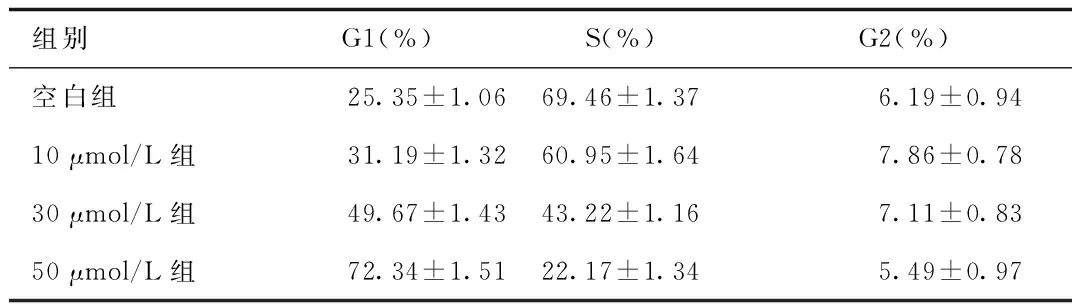
组别G1(%)S(%)G2(%)空白组25.35±1.0669.46±1.376.19±0.9410μmol/L组31.19±1.3260.95±1.647.86±0.7830μmol/L组49.67±1.4343.22±1.167.11±0.8350μmol/L组72.34±1.5122.17±1.345.49±0.97
3 讨论
钌的配合物因其具有抗肿瘤的活性而逐渐被人们熟知。研究认为钌将取代铂在抗肿瘤中发挥巨大的作用[6]。NAMI-A是第一个进入临床的钌配合物,研究发现其对肺癌和乳腺癌的转移表现出特别的活性,但对原发性肿瘤及体外活性仍不理想[7-8]。之后合成的KP1019等钌配合物,抗肿瘤活性上逐渐突凸,且副作用轻微[9-11]。
近年来越来越多的新型钌配合物被合成,同时这些新型配合物也具有较好的抗肿瘤活性。Chen等[12]合成了[Ru(bpy)2(PAIDH)]2+,[Ru(phen)2(PAIDH)]2+,[Ru(dmp)2(PAIDH)]2+和[Ru(dip)2(PAIDH)]2+4种钌配合物并证实其具有抗肿瘤作用。本文采用新型希夫碱钌配合物,MTT实验显示其能抑制胃癌SGC-7901细胞的增殖,且浓度为50 μmol/L的新型希夫碱钌配合物作用细胞72h后对细胞的抑制率达(66.39±0.01)%。流式结果显示希夫碱钌配合物能促进SGC-790细胞凋亡。Yu等[13]对合成的钌(II)β-咔啉配合物[Ru(tpy)(Nh)3]2+进行研究,发现其能抑制小鼠乳腺癌细胞MCF-7和HepG2的生长,作用机制可能与p53和p21蛋白表达有关。p53作为抑癌基因能与p21结合构成细胞周期G1的检测站,使肿瘤细胞的生长停滞在G1期。进而S期和G2期的细胞减少,细胞周期延长,生长迟缓。本研究结果显示,新型希夫碱钌配合物作用于胃癌SGC-7901细胞后可使细胞停滞在G1期,与上述研究结果相同。但是否也与p53及p21蛋白的表达有关,仍需要进一步实验证实。
[1] Rosenberg B,Vancamp L,Krigas T.Inhibition of cell division in Escherichia coli by electrolysis products from a platinum electrode[J].Nature,1965(205):698-699.
[2] Sava G,Bergamo A,Dyson PJ.Metal-based antitumour drugs in the post-genomic era:what comes next?[J].Dalton Trans,2011,40(36):9069-9075.
[3] Messori L,Merlino A.Ruthenium metalation of proteins:the X-ray structure of the complex formed between NAMI -A and hen egg white lysozyme[J].Dalton Trans,2014,43(16):6128-6131.
[4] Desai SB,Desai PB,Desia KR.Synthesis of some Schiff bases thiazolinones and azetidinones from 2,6-di-aminobonzol[1,2;4,5-d’]bisthiazole and their anticancer activities[J].Hetercycl Commun,2001,7(1):83-90.
[5] 刘耘,周磊.无机及分析化学[M].山东:山东大学出版社,2000:254-260.
[6] 汪中明,计亮年.钌配合物的抗肿瘤活性研究进展[J].化学进展,2002,14(4):296-302.
[7] Khalaila I,Bergamo A,Bussy F,et al.The role of cisplatin and NAMI-A plasma-protein interactions in relation to combination therapy[J].Int J Oncol,2006,29(1):261-268.
[8] Bergamo A,Gagliardi R,Scarcia V,et al.In vitro cell cycle arrest,in vivo action on solid metastasizing tumors, and host toxicity of the antimetastatic drug NAMI-A and cisplatin[J].J Pharmacol Exp Ther,1999,289(1):559-564.
[9] Heffeter P,Böck K,Atil B,et al.Intracellular Protein binding Pattems of the anticancer rutheium drugs KP1019 and KP1339[J].J Biol Inorg Chem,2010,15(5):737-748.
[10] Depenbrock H,Schmelcher S,Peter R,et al.Preclinical activity of trans-indazolium[tetrachlorobisindazoleruthenate(III)](NSC 666158; IndCR; KP 1019) against tumour colony-forming units and haematopoietic progenitor cells[J].Eur J Cancer, 1997,33(14):2404-2410.
[11] Hartinger CG,Zorbas-Seifried S,Jakupec MA,et al.From bench to bedside-preclinical and early clinical development of the anticancer agent indazolium trans-[tetrachlorobis(1H-indazole)ruthenate(III)](KP1019 or FFC14A)[J].J Inorg Biochem,2006,100(5-6):891-904.
[12] Qian C,Wang JQ,Song CL,et al.The induction of mitochondria-mediated apoptosis in cancer cells by ruthenium(II) asymmetric complexes[J].Metallomics,2013,65(7):844-854.
[13] Chen Y,Qin MY,Wang L,et al.A ruthenium(II) β-carboline complex induced p53-mediated apoptosis in cancer cells[J].Biochimie,2013,95(11):2050-2059.
(编校:吴茜,王俨俨)
Study on antitumor effect of a novel schiff base ruthenium coordination compound
ZHAO Cheng-liang1, ZHANG Bao-qi1, DU Yuan-liang1, YAN He2, ZHANG Si-xi2, CHEN Bin1Δ
(1.The Affiliated Hospital of Chengde Medical College, Chengde 067000, China; 2. The First Hospital of Jilin University, Changchun 130021, China)
ObjectiveTo study effect of a novel schiff base ruthenium coordination compound on cell proliferation and apoptosis of gastric cancer SGC-7901 cell.MethodGastric cancer SGC-7901 cell were divided into four groups according to different treatment of novel schiff base ruthenium coordination compound (concentration of 10, 30, 50 μmol/L) and blank group with DMSO. Cell proliferation was detected by MTT assay, cell apoptosis and cell cycle were analysed by flow cytometry.ResultsMTT results showed the inhibitory effect of novel schiff base ruthenium coordination compound on SGC-7901 cell enhanced with the increase of its concentration, and inhibitory rates were higher than that of blank group at 24, 48, 72 h. Flow cytometry results showed the apoptosis rate of novel ruthenium coordination compound groups of 10, 30, 50 μmol/L were (17.64±1.21)%, (26.47±0.61)%, (55.63±1.49)%, respectively, all higher than that of blank group (P<0.05). The cell proportion of G1 phase increased with the increasing of the novel schiff base ruthenium coordination.ConclusionA novel schiff base ruthenium coordination compound could inhibit the growth of gastric cancer SGC-7901 cells, promote apoptosis and arrest gastric cancer SGC-7901 cells at G1.
a novel schiff base ruthenium coordination compound;gastric cancer SGC-7901 cells; cell proliferation; cell apoptosis; cell cycle
河北省卫生厅科研基金(ZL20140116);吴阶平医学基金会临床科研专项资助基金(320.6750.14119)
赵成亮,男,主治医师,研究方向:肿瘤及药物化学,E-mail:38221965@qq.com;陈宾,通讯作者,男,主任医师,研究方向:脊柱外科及脊柱肿瘤,E-mail:514329822@qq.com。
R73-3
A
1005-1678(2015)08-0031-04
