含笑花药发育的超微结构研究
2015-07-04何彤慧
包 晗,何彤慧
(1 宁夏大学 生命科学学院,银川750021;2 宁夏大学 西部生态与生物资源开发联合研究中心,银川750021)
被子植物的花药结构复杂,组成花药壁的表皮、药室内壁、中层和绒毡层4层体细胞相互紧邻,但形态、结构和功能大不相同。药室中的花粉发育也是经历了特殊的细胞分裂和分化方式最后形成了由3个细胞组成的雄配子体。花药的发育程序受到严格的调控,通过许多不同于体细胞发育的方式最终成熟。被子植物的种类很多,花药的发育方式也有所不同。至今为止还有很多植物花药的发育特征不清楚。含笑(Micheliafigo)属于木兰科(Magnoliaceae)含笑属(Michelia),为常绿乔木或灌木,叶革质,聚合蓇葖果穗状。大多数种类花芳香袭人,树形优美,是可提取精油及绿化、美化环境和庭园观赏的重要树种[1]。在被子植物中,含笑属是比较原始的类型,但在木兰科中又是较为进化的分类群。敖成齐[2]对含笑的花粉发育做了初步观察,描述了含笑的花药壁组成特征和小孢子发生类型。我们对含笑花药进行了组织化学研究,揭示了该花药发育中营养物质积累特征,也发现有些与其他被子植物不同的现象[3]。鉴于含笑的系统发育位置和其花药发育的特征,值得对其花药发育进行深入研究。本试验通过对含笑花药发育中的超微结构变化进行观察,为研究木兰科植物胚胎学发育机理提供原始资料。
1 材料和方法
含笑采自厦门大学校园内。分别取不同发育时期的花药,迅速投入到含2.5%戊二醛、50mmol·L-1二甲胂酸钠(pH 7.0)缓冲液配制的前固定液中,室温下前固定3h。之后用相同缓冲液换洗3次,每次30min。清洗后的花药转入用50mmol·L-1二甲胂酸钠(pH 7.0)、1%锇酸配制的后固定液中,在4℃下固定过夜。第二天早晨用相同缓冲液换洗3 次,每次30 min。然后用梯度系列丙酮脱水,Spurr树脂包埋。包埋的花药用Leica Ultracut R 型切片机切成约为70~80nm 厚的切片,将切片捞在喷碳具膜的铜网上,自然晾干后用醋酸双氧铀-柠檬酸铅双重染色。使用JEM-2100HC 电子显微镜观察,拍照。
2 观察结果
含笑的花呈现出典型的原始花形态:每朵花中央是数十个离生心皮组成的雌蕊,其周围有数十个花药。但其花药的形态与系统发育进化的被子植物花药没有明显区别。在花药的横切面上,可看出花药由药壁和药室组成,花药壁从外向内,依次分化出表皮、药室内壁、中层、绒毡层四类细胞结构,药室中部是花粉发育的部位(图版Ⅰ,1)。
2.1 造孢细胞时期
雄蕊原基形成后,在其中部形成一些体积较大的细胞,为次生造孢细胞。次生造胞细呈多边形,细胞壁较薄,有明显的核,位于细胞中央(图版Ⅰ,2),核内的染色质呈弥散丝状。此时的绒毡层细胞形态较规则,横切面呈方形。有些绒毡层细胞面向药室的内切向壁与细胞质分开,形成一透明区域。在绒毡层细胞质内分散着较多的小液泡(图版Ⅰ,3)。
2.2 母细胞时期
从造孢细胞转变为小孢子母细胞有两个明显的特征,细胞之间出现较大间隙并且在小孢子母细胞的表面形成一层较厚的胼胝质壁。在早期小孢子母细胞的细胞质内有丰富细胞器和小液泡,线粒体和质体的体积都较小,内部分化程度也较低(图版Ⅰ,4)。随着小孢子母细胞的发育,外表的胼胝质壁不断增厚,小孢子母细胞原有的纤维素壁降解、消失(图版Ⅰ,5)。有时在纤维素壁降解部位可看到电子密度较低、类似液泡的区域(图版Ⅰ,6)。此时,绒毡层细胞的内切向壁开始降解,其质膜与细胞壁之间形成一层电子密度较低的区域;两个绒毡层细胞之间的径向壁也开始部分分开,呈现比较疏松的状态。绒毡层细胞质的电子密度较以前增大,细胞质中形成了很多小液泡,其中有一些絮状物质(图版Ⅰ,7)。
2.3 四分体时期
小孢子母细胞经过减数分裂形成四分体,四分体小孢子的表面都被厚厚的胼胝质壁包裹。胼胝质中间有一电子密度较高的薄层(图版Ⅰ,8)。四分体小孢子内有较多的片层膜结构,其中有些是标志合成细胞内蛋白的多聚核糖体。线粒体体积较小,内部的嵴不明显,显示出分化程度较低(图版Ⅱ,1)。绒毡层细胞的细胞质依然浓厚,有较多质体和线粒体。内切向壁的透明区域仍保留,在内表面上形成了电子密度较高的圆形颗粒,很可能是前乌氏体(图版Ⅱ,2)。
2.4 小孢子早期
当四分体小孢子的胼胝质壁变薄溶解后,小孢子从中释放出来。有时游离小孢子细胞核中出现两个核仁。游离小孢子表面的花粉外壁已形成,由明显区分的3层结构组成(图版Ⅱ,3)。小孢子细胞质浓厚,有丰富的细胞器,其中线粒体的体积较大,质体的体积较小(图版Ⅱ,4)。绒毡层细胞的内切向壁完全消失,只有1层不规则的细胞质膜。在质膜内侧,有一些将被分泌到药室中的原乌氏体,其内部的电子密度较低,外部的电子密度较高,与花粉外壁的电子密度相似(图版Ⅱ,5)。在小孢子形成花粉外壁时,有一电子密度很低的特定部位,扁平的液泡位于花粉壁和细胞质膜之间。这个部位的花粉外壁是不连续的,是将形成花粉萌发孔的部位(图版Ⅱ,6)。
2.5 小孢子晚期
被子植物发育小孢子中无论是否形成大液泡,总是呈现出细胞核靠边分布的特征,呈现出极性分布,这将为小孢子的不等分裂、开始配子体发育作准备。最初在单核中位小孢子中形成了许多小液泡。在细胞质中有较多的线粒体、质体及自体吞噬泡(图版Ⅱ,7)。随着小液泡数量的增加,小液泡融合形成大液泡,细胞核和细胞质被挤到细胞的边缘区域(通常所说的单核靠边期),小孢子细胞呈现明显的极性。小孢子中大液泡的形成为小孢子发育晚期的特征。这时花粉外壁结构清晰,表层的覆盖层和基部的基足层已完全形成,中间是连接覆盖层和基足层的基粒棒层。虽然此时的花粉内壁还没有形成,但在花粉外壁与质膜之间有一层电子密度较低的区域(图版Ⅱ,8)。在小孢子晚期,绒毡层细胞中的基质物质减少,电子密度降低,但细胞内部结构仍完整。在面向药室的内切向面上仍有一些乌氏体,有些已经脱离绒毡层表面,迁移到药室中(图版Ⅲ,1)。
2.6 二胞早期
小孢子经过一次不等有丝分裂后,形成了大小不等的两个细胞,进入二胞花粉时期。小的为生殖细胞,其细胞核大,细胞质的比例较少,呈透镜状紧贴着花粉内壁;大的为营养细胞,继承了原小孢子的绝大部分内含物。在刚形成的二胞花粉中,两个细胞除了细胞核的大小有所差异外,细胞质的差异很小(图版Ⅲ,2)。以后营养核率先迁移到细胞中央。在营养细胞质内又重新出现较多的质体和线粒体(图版Ⅲ,3)。这时花粉内壁已经形成,与花粉外壁的厚度相近,但电子密度较低且由外向内降低(图版Ⅲ,4)。二胞花粉早期时的绒毡层细胞已明显退化,细胞质基质的电子密度进一步减小,膜状结构也明显减少,细胞器结构模糊。在绒毡层的内表面上仍有一些乌氏体(图版Ⅲ,5)。
2.7 成熟时期
到开花时,花粉发育成熟。成熟花粉的外壁形成电子密度较高的3层结构,最外层为覆盖层,中间为基粒棒层,底部为基足层。细胞质内有一大液泡,内部有脂滴分布(图版Ⅲ,6)。在细胞质中有一些淀粉粒和脂滴,但淀粉粒较少(图版Ⅲ,7)。原来在绒毡层的位置形成了绒毡层膜,紧贴中层。其中还有一些乌氏体结构(图版Ⅲ,8)。
3 讨 论
3.1 液泡的变化
液泡是植物细胞内一种特殊的细胞器,也是细胞内膜系统的重要组成部分。在植物细胞的生命活动中,液泡发挥着多种重要的生理功能:参与并调节细胞新陈代谢;控制多种细胞物质的合成、积累和运输;维持细胞内环境稳定;缓冲外界环境对植物生长发育的影响;提高物种适应环境变化和生存能力;在细胞遗传信息的调控下发生和发展,代表着植物细胞结构与功能的转变[4-6]。
液泡的功能多样,在不同的时间和空间出现的液泡具有不同的功能。在含笑花粉发育中,细胞内的液泡发生了三次比较明显的变化。第一次是在小孢子母细胞形成胼胝质壁的过程中,可能与胼胝质壁的形成有关。小孢子母细胞合成胼胝质并用分泌小泡转移至细胞壁外,形成胼胝质壁。第二次是在小孢子母细胞减数分裂之前,原小孢子母细胞的纤维素壁降解,在降解区域形成电子密度较低的液泡,推测是小孢子母细胞分泌的纤维素酶将纤维素细胞壁降解的过程。第三次是在晚期小孢子中形成大液泡将细胞质挤到边缘,使细胞产生极性,这将为小孢子的不等分裂做准备,使小孢子进入雄配子体发育。其结果是小孢子不等分裂形成一个大的营养细胞和一个小的生殖细胞。细胞核的位移是小孢子不对称分裂的前提条件之一,保证了不对称分裂的正常进行[7-8]。小孢子中央大液泡对其未来不对称性质的分裂以及两个细胞的不同命运起了重要决定作用。通常单核靠边期的小孢子核位于萌发孔的对面,而大液泡将细胞核挤到细胞边缘应是随机分布。有实验证明微管对于小孢子核的定位有重要作用[9-10]。在小孢子发育中,大液泡将细胞核挤到细胞边缘,而细胞骨架则将细胞核定位在萌发孔对面的位置,共同作用创建了单核靠边的晚期小孢子结构。然而,目前对小孢子中的大液泡形成过程很少有报道。
3.2 花粉壁的形成
成熟花粉壁包括内壁和外壁。外壁由孢粉素构成,分为外壁外层和外壁内层。外壁外层主要由基柱(pilum)组成,基柱包括头部和棒两部分。如果基柱头部合并,即在基柱上形成1层覆盖层(tectum),棒是分开的。通常外壁可分为2种类型:具覆盖层外壁(tectate type)和具基柱外壁(pilate type)。具覆盖层外壁包含覆盖层、基粒棒层和外壁内层或基足层。基柱型外壁在基柱之间有空隙通向外部[11]。花粉内壁主要为多糖性质的纤维素组成。
在不同植物中,花粉内外壁的结构和组成成分不同。花粉壁的多样性不仅表现在其表面雕纹差异,还表现在发生过程上[11]。在Platanusacerifolia中,胼胝质壁在花粉外壁的构建和后来外壁的沉积具有积极的作用[12]。在含笑花粉发育中,四分体时期的绒毡层细胞就有乌氏体向药室中分泌。四分体小孢子释放后,绒毡层细胞表面的乌氏体大量出现,可观察到乌氏体向药室内迁移,乌氏体内含有孢粉素物质,可能用于构建花粉外壁。随着花粉发育,花粉外壁结构在二胞早期完成,而花粉内壁在二胞花粉时才开始构建。
木兰科是最原始的被子植物类群之一,花粉形态亦表现出其原始性。含笑外壁超微结构有覆盖层,基粒棒层和外壁内层或基足层的分化,基粒棒层有小柱形成,但不典型,很少直立小柱,一般小柱倾斜或悬挂在覆盖层的表面,是为颗粒-初生柱状层。但外壁内层较薄,内壁加厚。Walker曾指出被子植物花粉外壁结构的演化趋势是从无结构层→颗粒→初生柱状层→覆盖层柱状层[13]。含笑花粉壁比起木兰属有些种类花粉外壁为无结构层,内具小裂隙或大小不等的小腔穴,不形成小柱,属于进化类群。但是比起鹅掌楸,单性木兰有小柱典型,短而直立,直径很小的类群,又相对原始[14-15]。这些特征表明木兰科含笑属植物外壁结构的多样性和原始性。
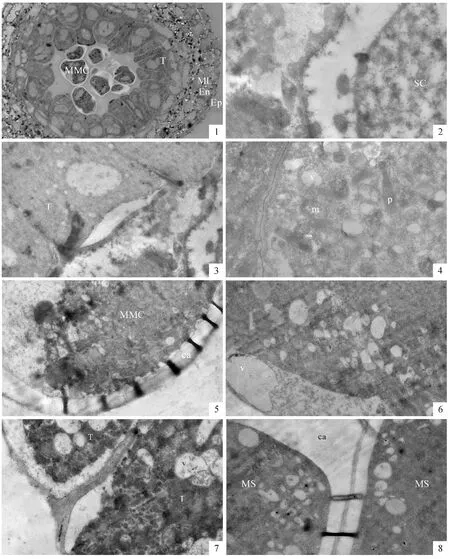
图版Ⅰ 含笑花药发育超微结构PlateⅠ Ultrastructural changes in pollen development of M.figo
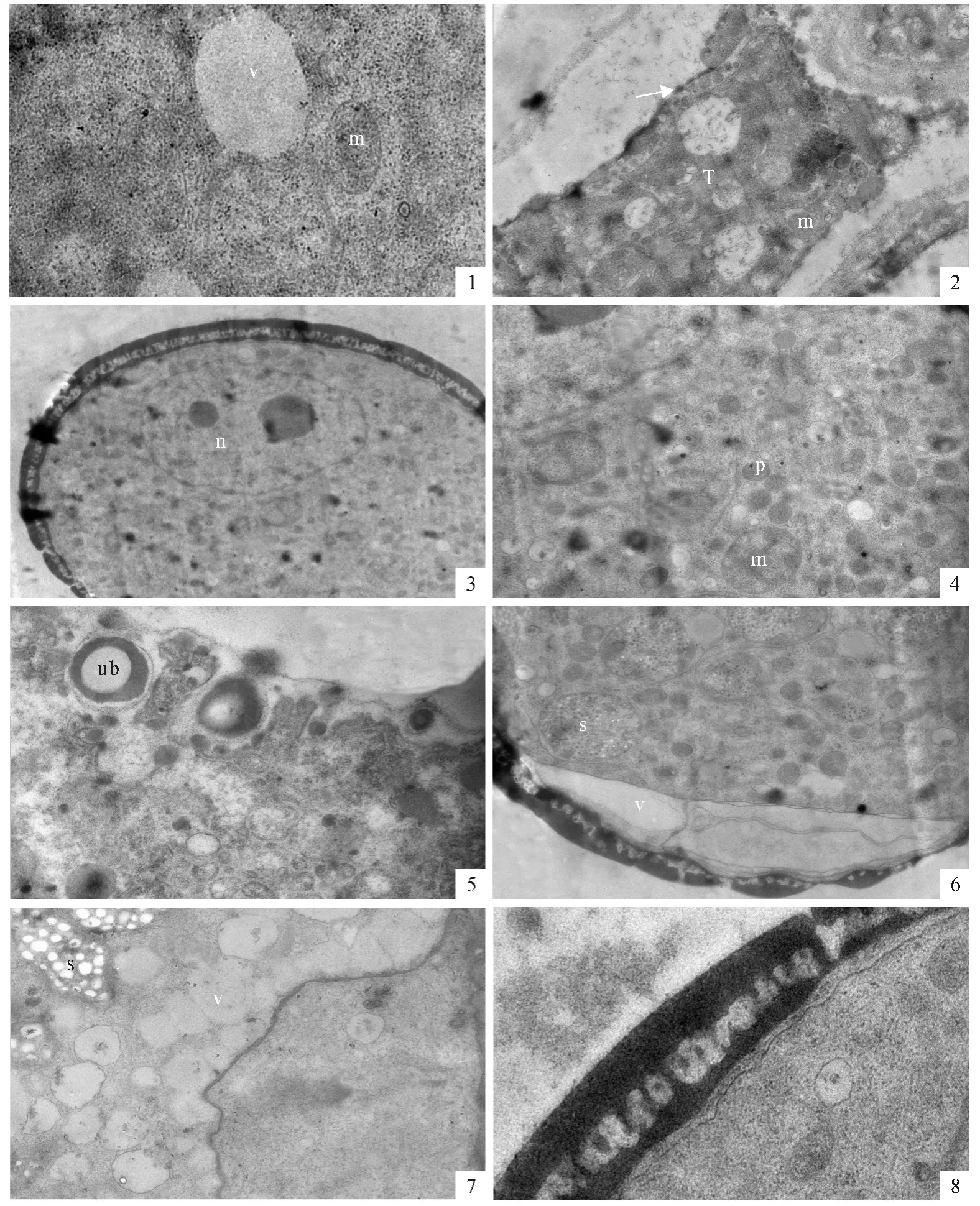
图版Ⅱ T.绒毡层;v.液泡;m.线粒体;p.质体;n.细胞核;ub.乌氏体;s.复合淀粉粒PlateⅡ T.Tapetum;v.Vacuole;m.Mitochondria;p.Plasmid;n.Nucleus;ub.Ubisch body;s.Compound starch grains
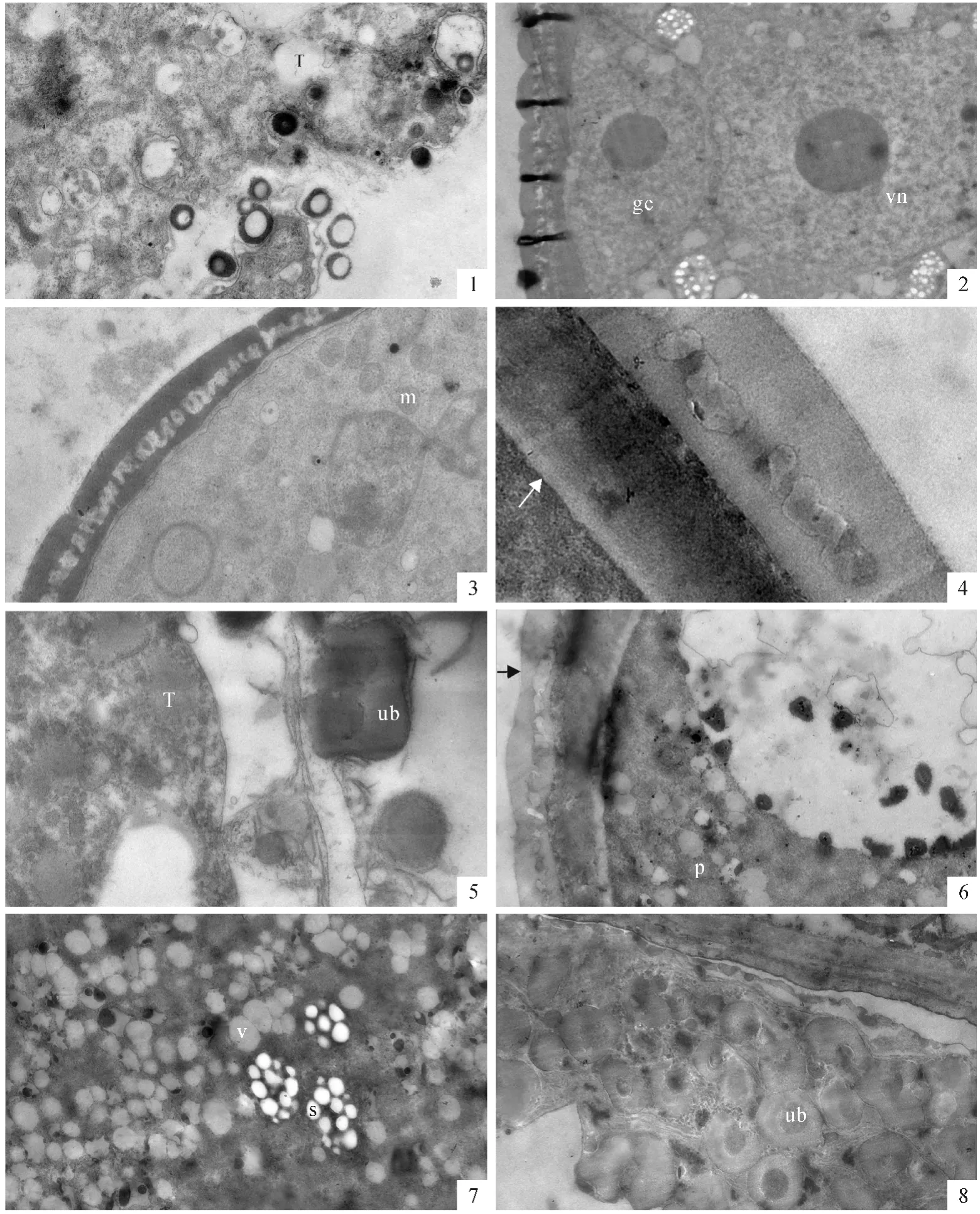
图版Ⅲ T.绒毡层;gc.生殖细胞;vn.营养细胞核;p.质体;m.线粒体;ub.乌氏体;s.淀粉粒;v.液泡PlateⅢ T.Tapetum;gc.Generative cell;vn.Vegetative nucleus;p.Plasmid;m.Mitochondria;ub.Ubisch body;s.Starch grain;v.Vacuole
[1]ZHANG X H(张新华).Advances in research ofMicheliaLinn[J].Guihaia(广西植物),2007,27(5):712-719(in Chinese).
[2]AO CH Q(熬成齐).Microsporogenesis,development of male gametophyte inMicheliafigoand their systematic significance[J].Guihaia(广西植物),2007,27(6):836-839(in Chinese).
[3]BAO H(包 晗),FU SH(傅 劭).Histochemical observation of polysaccharides and lipids on the developing anthers ofMicheliafigo[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2013,33(10):1 981-1 982(in Chinese).
[4]LIANG X R(廖祥儒),CHEN T(陈 彤),LIU X L(刘小丽).Formation and function of vacuoles[J].ChineseJournalofCellBiology(细胞生物学杂志),2002,24(2):95-101(in Chinese).
[5]WANG L J(汪良驹),LIU Y L(刘友良).Vacules of pant cells and their physiological functions[J].PlantPhysiologyCommunication(植物生理学通讯),1998,34(5):394-400(in Chinese).
[6]WANG W(王 玮).The plant vacuole[J].JournalofBiology(生物学杂志),1994,6:9-10(in Chinese).
[7]TWELL D.Mechanisms of microspore polarity and differential cell fate determination in developing pollen[M]//CRESTI M,CAI G,MOSCATELLI A.Fertilization in Higher Plants.Berlin Heidelberg:Springer-Verlag,1999:201-215.
[8]PERIASAMY K,SWANY B G L.Morphology of the tapetum in angiosperms[J].Curr.Sci.,1966,35:427-430.
[9]TERASAKA O,NIITSU T.Unequal cell division and chromatin differentiation in pollen grain cells.Ⅱ.Microtubule dynamics associated with the unequal cell division[J].Bot.Mag.Tokyo,1990,103:133-142.
[10]ZEE S Y,YE X L.Microtubule reorganization during pollen development of rice(OryzasativeL.)[J].Protoplasma,2000,21:188-201.
[11]胡适宜.被子植物生殖生物学[M].北京:高等教育出版社,2005:29-92.
[12]MARIA S C,JESUS M,JUAN S C.Pollen grain and ubisch body development inPlatanusacerifolia[J].ReviewofPalaeobotanyand Palynology,1995,85:63-84.
[13]WALKER J W.Evolution of exine struture in pollen of premitive angiosperms[J].Amer.J.Bot.,1974,61:891-902.
[14]WEI ZH X(韦仲新),WU ZH Y(吴征镒).Pollen ultrastructure of liriodendron and its systematic significance[J].ActaBotanicaYunnanica(云南植物研究),1993,15(2):163-166(in Chinese)..
[15]XI Y ZH(席以珍),ZHANG Y L(张玉龙),LIN Q(林 祁),etal.A study of pollen wall ultrastructure ofKmeriaseptentrionalis[J].BulletinofBotanicalResearch(木本植物研究),2000,20(4):385-398(in Chinese).
