软枣猕猴桃叶片光系统Ⅱ活性对不同温度的响应
2016-01-08王振兴,艾军,陈丽等
软枣猕猴桃叶片光系统Ⅱ活性对不同温度的响应
王振兴1,艾军1*,陈丽2,范书田1,何伟1,秦红艳1,赵滢1
(1 中国农业科学院特产研究所,长春 130112;2 吉林农业大学 园艺学院,长春 130112)
摘要:以软枣猕猴桃“魁绿”为试验材料,利用快速叶绿素荧光诱导动力学曲线分析技术(JIP-test)研究了热胁迫处理对植株叶片光系统Ⅱ活性的影响。结果显示:(1)软枣猕猴桃叶片最大光化学效率(Fv/Fm)在35~48 ℃的范围内并没有明显变化,只有当温度升高到52 ℃时才显著下降。(2)随着温度升高,叶绿素荧光诱导动力学曲线中J点和I点的相对可变荧光Vj和Vi呈显著下降趋势,在52 ℃又显著升高,而K点的相对可变荧光Vk则逐渐上升;叶片捕获的激子将电子传递到电子传递链中QA-下游电子受体的概率(ψ0)随着温度升高而逐渐上升,但在52 ℃时显著下降。(3)随着热胁迫时间的延长,Vj和Vi随时间延长而升高,ψ0则下降,电子传递链受体侧受到了严重的抑制。研究表明,高温显著抑制了软枣猕猴桃叶片PSⅡ电子传递链供体侧和受体侧的活性,但PSⅡ的供体侧比受体侧对高温更加敏感;JIP-test测定的相关参数能有效地评价不同温度对软枣猕猴桃光系统活性的影响。
关键词:软枣猕猴桃;高温胁迫;光系统;JIP-test
收稿日期:2014-07-07;修改稿收到日期:2014-12-03
基金项目:吉林省科技发展计划(20130102046JC);吉林省科技发展计划(20140204034NY)
作者简介:王振兴(1982-),男,助理研究员,在读博士研究生,主要从事果树生理研究。E-mail:zhenxinghd@aliyun.com
通讯作者:*艾军,博士,研究员,主要从事果树生理生化研究。E-mail:aijun1005@163.com
中图分类号:Q945.79 文献标志码:A
Activity of Photosystems Ⅱ in Leaves ofActinidiaarguta
underdifferent Temperature Treatments
WANG Zhenxing1,AI Jun1*,CHEN Li2,FAN Shutian1,HE Wei1,QIN Hongyan1,ZHAO Ying1
(1 Institute of Special Wild Economic Animal and Plant Science,Chinese Academy of Agricultural Sciences,Changchun,Jilin 130112,China;2 Jilin Agricutural University,Changchun,Jilin 130112,China)
Abstract:The effects of heat stress on activities of photosystem Ⅱ in leaves of Actinidia arguta (Sieb.et Zucc.) Planch.exmiq.(Kuilü,a cultivar) were studied by chlorophyll a fluorescence transient and JIP-test.The results showed that:(1)Fv/Fm of leavesdid not significantly change at 35-48 ℃,butdecreased at 52 ℃.(2)With increase of leaf temperature,the relative variable fluorescence at J and I steps of fluorescence transient (Vj and Vi) significantlydecreased,but increased at 52 ℃,the relative variable fluorescence Vk increased gradually.(3)With the increase of heat treatment time,the Vj and Vi increased gradually,but Ψodecreased gradually,indicating that the acceptor side of PSⅡ wasdamaged severely.In summary,activity of thedonor side and the acceptor side of PSⅡ was inhibited by high temperature.Thedonor side wasmore sensitive to heat stress.JIP-test parameters can evaluate effectively activity of photosystems Ⅱ in leaves of A.arguta underdifferent temperatures.
Key words:Actinidiaarguta(Sieb.et Zucc.) Planch.exmiq.;heat stress;photosystem;JIP-test
软枣猕猴桃[Actinidiaarguta(Sieb.et Zucc.) Planch.exmiq.]为多年生落叶木质藤本果树,主产于中国东北地区,是珍贵的抗寒果树资源;其果实富含多种营养成分,Vc含量最高可达430mg/100g,品质风味独特,除鲜食外还适于加工果酒、果汁、果酱等,是一种发展前景广的新兴果树[1]。软枣猕猴桃的原生境多为半阴生环境,空气湿润,温度变化缓和,而在人工栽培条件下由于阳光直射,常使叶片温度过高,造成叶片伤害,影响植株的生长和正常开花结果。研究软枣猕猴桃叶片光系统活性对不同温度的响应,对于揭示软枣猕猴桃叶片对温度条件的适应特性,完善栽培措施等具有重要意义。
近年来,叶绿素荧光诱导动力学曲线分析技术(JIP test)已成为研究光合作用特别是原初光化学反应的最有力工具之一[2-5],它以丰富的信息来反映光系统Ⅱ(PSⅡ)的原初光化学反应和光合机构状态的变化。源于JIP test 的参数对环境胁迫尤其是高温胁迫非常敏感[6-8],植物在高温环境中常常表现为光合作用效率下降,光合电子传递受阻。严重高温胁迫还会对放氧复合体、光系统Ⅱ供体侧和受体侧造成伤害,尤其是对放氧复合体的伤害更为严重,导致叶绿素荧光诱导动力学曲线K点荧光显著增加[9]。本试验采用叶绿素荧光诱导动力学曲线分析方法,研究不同高温处理对软枣猕猴桃叶片PSⅡ活性的影响,通过比较Fv/Fm和源于O-J-I-P的其它参数对高温胁迫的敏感性,揭示高温对PSⅡ反应中心以及电子传递链不同位点的伤害,分析高温胁迫引起软枣猕猴桃光合速率及产量下降的原因,为选育耐高温品种及扩大其种植区域提供理论依据。
1材料和方法
1.1 材 料
试验于2010年7月在中国农业科学院特产研究所软枣猕猴桃资源圃中进行,选择‘魁绿’品种中生长势、株高和树龄等相同的植株3株,每株选取大小、生长状况一致的向阳功能叶片为试验测定材料。
1.2 高温胁迫处理及快速荧光诱导动力学曲线的测定
1.2.1热胁迫温度梯度试验根据软枣猕猴桃叶片特性,在王梅等[10]方法基础上稍作改进。用打孔器在功能叶片上取直径10mm的叶圆片,3片1组,共5组,置于铺有湿润滤纸的小塑料袋中,分别在35、40、44、48和52 ℃的恒温水浴中、黑暗条件下热胁迫5min。热胁迫后立即利用英国Hansatech公司生产的植物分析仪Pocket-PEA进行快速荧光诱导动力学曲线的测定。
1.2.2热胁迫时间梯度试验将软枣猕猴桃叶圆片分别置入44和48 ℃的恒温水浴中黑暗条件下热胁迫3、7和10min,热胁迫后立即利用Pocket-PEA进行快速荧光诱导动力学曲线的测定。
1.2.3热胁迫后恢复试验将5组软枣猕猴桃叶圆片分别置入35、40、44、48和52℃的恒温水浴中、黑暗条件下热胁迫5min,热胁迫后在室内26℃、黑暗条件下、水浴中恢复1 h。此外,将另外6组软枣猕猴桃叶圆片分别置入44和48 ℃的恒温水浴中黑暗条件下热胁迫3、7和10min,热胁迫后在室内26 ℃、黑暗条件下、水浴中恢复1 h。利用Pocket-PEA进行快速荧光诱导动力学曲线的测定。
1.3 JIP-test分析
根据Strasser等[3-4]的JIP-test,对获得的OJIP荧光诱导动力学曲线进行分析。主要得到以下参数:最大光化学效率(Fv/Fm)=(Fm-F0)/Fm;K、J、I点的相对可变荧光:Vk=(FK-F0)/(FM-F0),VJ=(FJ-F0)/(FM-F0),VI=(FI-F0)/(FM-F0);叶片捕获的激子将电子传递到电子传递链中QA-下游电子受体的概率:ψ0=(1-VJ);单位面积有活性的反应中心的数目:RC/CS=φPo·(VJ/Mo)·(ABS/CS);单位反应中心吸收:ABS/RC=Mo(1/VJ)(1/φPo);捕获的能量:TR0/RC=M0·(1/VJ),用于电子传递的能量:ET0/RC=M0·(1/VJ)·ψ0,热耗散的能量:DI0/RC=(ABS/RC)-(TR0/RC);以吸收光能为基础的光化学性能指数:PIABS=(RC/ABS)[φPo/(1-φPo)][ψo/(1-ψo)]。
1.4 数据分析
测定的数据采用Microsoft Excel 2003和SAS 6.0进行数据处理和统计分析。
2结果与分析
2.1 热胁迫对软枣猕猴桃叶片最大光化学效率的影响
图1显示,软枣猕猴桃叶片最大光化学效率(Fv/Fm)随温度升高而逐渐降低。其中,Fv/Fm在35 ℃~48 ℃范围内随温度增加的变化不显著,较35 ℃时降低0.5%~12.5%;当温度升高到52 ℃时开始显著大幅度降低,较35 ℃时降低68.6%。
2.2 热胁迫对快速叶绿素荧光诱导动力学曲线及其参数的影响
从相对可变荧光Vt诱导动力学曲线(图2,A、B)可以看出,高温胁迫显著增加了软枣猕猴桃叶片叶绿素荧光诱导动力学曲线中的J相和I相的相对可变荧光Vi和 Vj。通过比较相对可变荧光Vt的差值ΔVt发现,高温胁迫后,如果不经过常温水浴恢复立即暗适应测定快速叶绿素荧光诱导动力学曲线,则可以观察到K点出现(图2,D),但如果经常温水浴恢复后,仅在52℃高温胁迫下观察到J点,K点没有明显增加(图2,C)。以上结果说明高温胁迫后,放氧复合体在胁迫的一定范围内可以得以恢复。
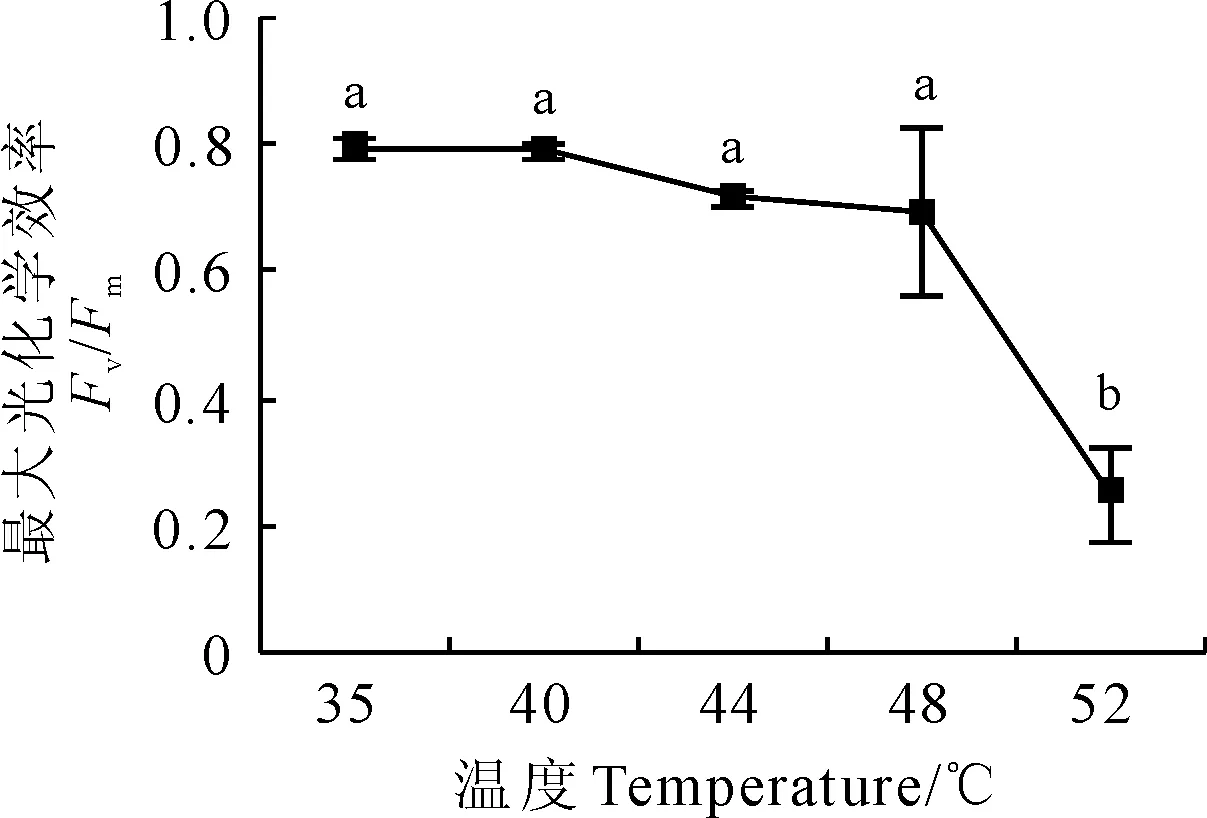
图1 黑暗条件下热胁迫温度对软枣猕猴桃
图3,A所示,软枣猕猴桃叶片在j点和i点的相对可变荧光Vj和Vi随着胁迫温度升高而显著降低,48 ℃时降到最低,但在52 ℃时又显著升高;在高温胁迫下Vj和Vi随处理时间的延长而呈逐渐升高的趋势(图3,B)。图3,C显示,随着温度的升高,软枣猕猴桃叶片相对可变荧光在300 μs的值即Vk逐渐上升,在52 ℃时有显著的升高;而以吸收光能为基础的性能指数(PIABS)随温度的升高呈现显著降低趋势(图3,D)。
另外,从图4,A中可以看出,软枣猕猴桃叶片捕获的激子将电子传递到电子传递链中QA-下游电子受体的概率(ψ0)随着温度升高而逐渐升高,但在52 ℃时则显著降低;随高温处理时间延长,ψ0则逐渐下降(图4,B)。说明较高温度或较长的处理时间会对PSⅡ受体侧造成严重的抑制或伤害。
2.3 高温胁迫对软枣猕猴桃叶片PSⅡ能量分配的影响
由表1可看出,受高温胁迫处理的软枣猕猴桃叶片单位反应中心吸收的能量(ABS/RC)随温度的升高而增加,但捕获(TR0/RC)和用于电子传递(ET0/RC)的能量则先随温度升高而增加,但当温度升高到52 ℃时则下降。这表明高温胁迫后导致叶片单位面积部分反应中心失活,有活性反应中心的数量(RC/CS)减少(表1),单位有活性的反应中心被迫接受更多的光能,单位有活性的反应中心的性能有所增加,但高温仍然会造成单位面积上的光能利用率降低。其原因可能是单位反应中心效率的增加幅度小于单位面积反应中心的数量RC/CS的下降幅度。另外,在52 ℃高温时,TR0/RC和ET0/RC显著降低,说明电子受体侧在更高温度下才可能受到严重的伤害,造成电子传递受到抑制,致使每个反应中心激发能耗散增加[11]。
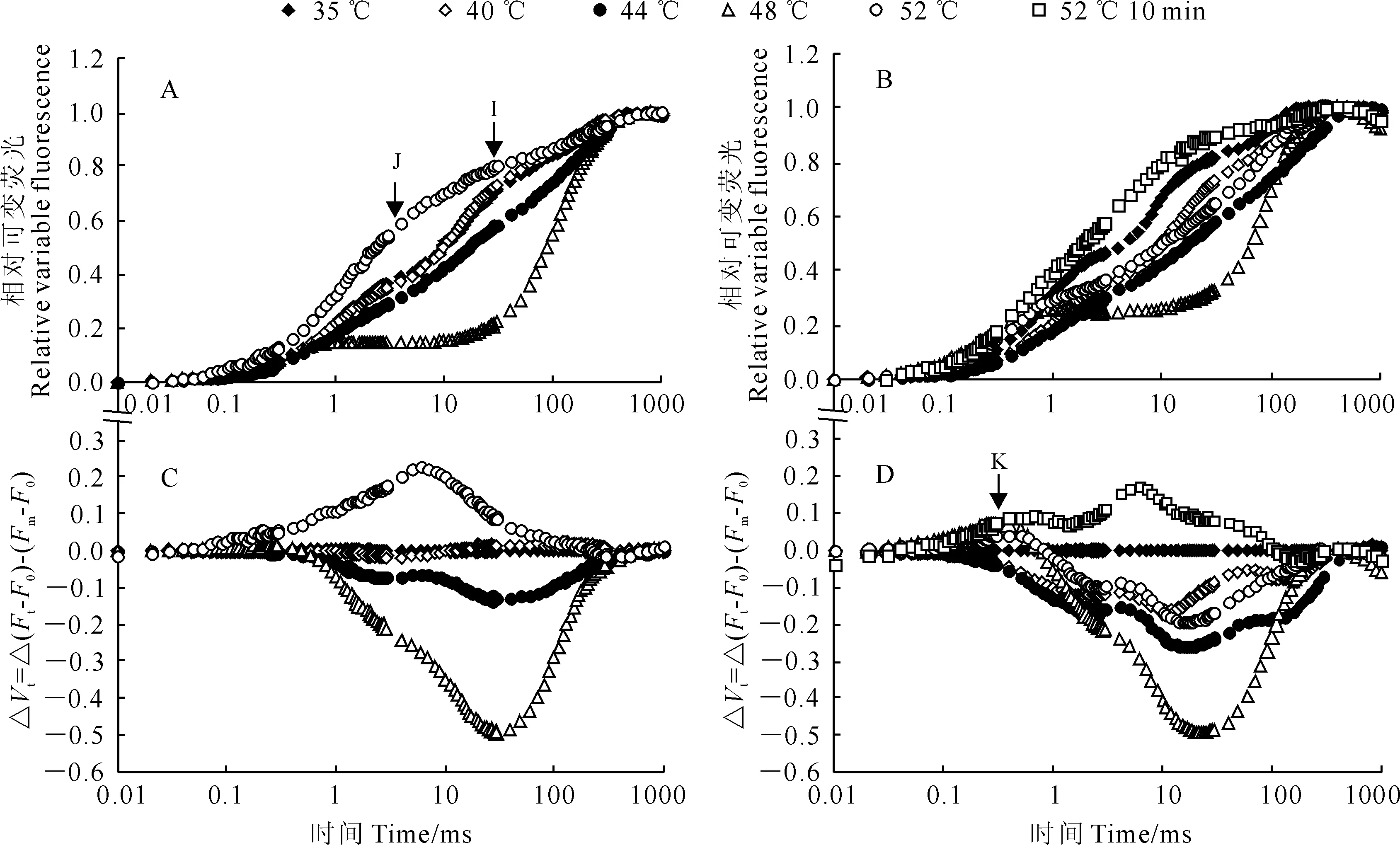
图2 热胁迫温度和时间对软枣猕猴桃叶片叶绿素V t和ΔV t曲线的影响
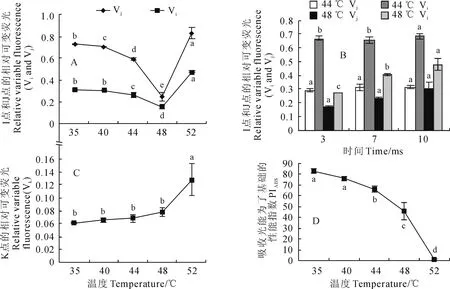
图3 热胁迫温度和时间对K、J、I点的相对可变荧光(V k、V j、V i)和
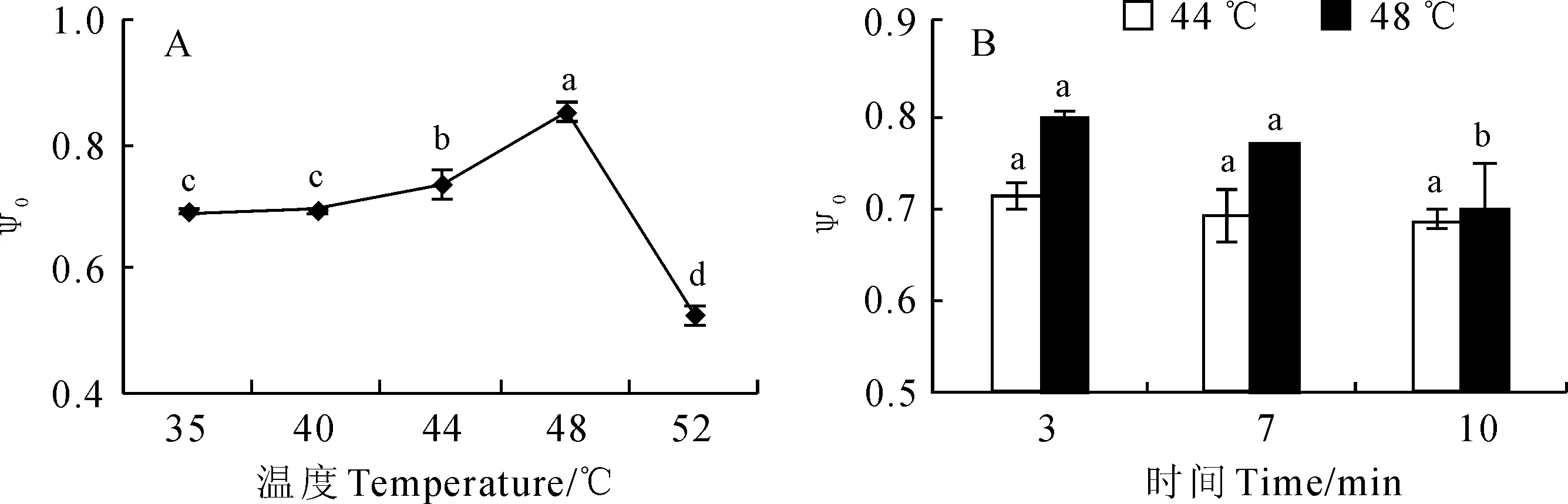
图4 不同温度不同处理时间下叶片捕获的激子将电子传递到电子传递链中Q A -下游的电子受体的概率( ψ 0)
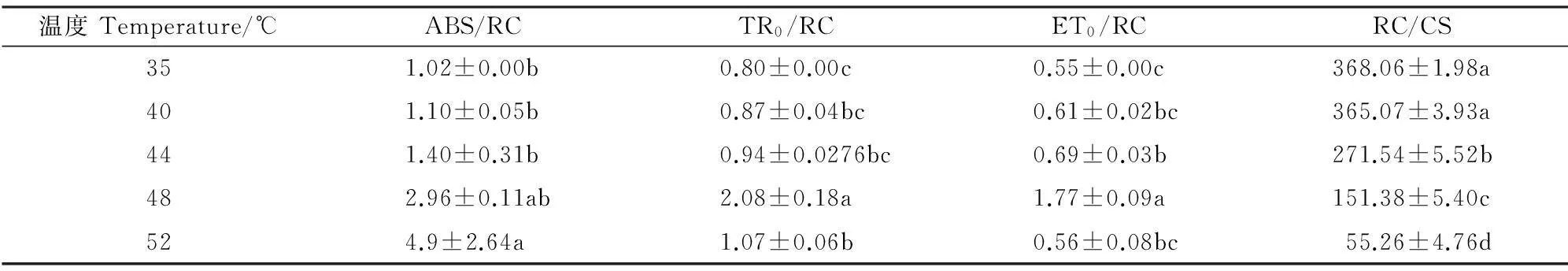
温度Temperature/℃ABS/RCTR0/RCET0/RCRC/CS351.02±0.00b0.80±0.00c0.55±0.00c368.06±1.98a401.10±0.05b0.87±0.04bc0.61±0.02bc365.07±3.93a441.40±0.31b0.94±0.0276bc0.69±0.03b271.54±5.52b482.96±0.11ab2.08±0.18a1.77±0.09a151.38±5.40c524.9±2.64a1.07±0.06b0.56±0.08bc55.26±4.76d
注:同列不同小写字母表示不同处理间在0.05水平存在显著性差异。
Note:Thedifferent normal letters within the same column indicate significantdifference among treatments at 0.05 level.
3讨论
3.1 热胁迫对软枣猕猴桃叶片放氧复合体的影响
很多研究表明,电子传递链供体侧的放氧复合体对热处理特别敏感,在对大麦、苹果、碱蓬、小麦以及藻类的高温处理中[12-17],都观察到PSⅡ电子供体尤其是放氧复合体受到高温的抑制和损害,出现明显的K点。但Tóth等[18]研究表明,对大麦叶片经短暂的热处理后,再在室温中经过较长时间的恢复,则K点消失。同时,高温处理的时间不同也会影响K相的出现,如有的研究处理时间多达180min,这必然会对放氧复合体造成伤害。在本研究中,对软枣猕猴桃叶片高温处理后,PSⅡ电子供体侧受到抑制,常温水浴恢复后并没有观察到明显的K点,这可能由于所用软枣猕猴桃叶片的特殊性以及热胁迫处理时间和热胁迫后的恢复能力等因素造成的,但如果在高温胁迫后立即暗适应则观察到明显的K点,这说明高温胁迫后放氧复合体在胁迫的一定范围内可以经过较长时间得以恢复,但如果胁迫温度很高或胁迫时间很长则会对放氧复合体以及电子受体侧造成不可逆伤害。
3.2 热胁迫对软枣猕猴桃叶片电子传递链不同位点的影响
近些年来,一些研究表明,用Fv/Fm来评价光系统活性对胁迫的反应往往是片面的,甚至是错误的[6,14,19]。Wen等[3-4]认为Fv/Fm并不能准确地揭示PSⅡ活性的变化,作为潜在的最大光化学效率,它仅仅反映了有活性反应中心对光能的捕获效率[20],而源于JIP-test的荧光参数对胁迫反应更敏感[14]。前人研究认为当Vj和Vi上升时,表示电子传递链受阻,这主要归因于QA-的积累和PQ库氧化还原反应受限[21]。本研究的结果表明,软枣猕猴桃叶片Vj和Vi随热胁迫温度升高而呈现先降低后升高的趋势,它们在不同温度下相对于Fv/Fm都有显著的变化,而且都在52 ℃时有较大转变。这表明对于软枣猕猴桃而言,只有当温度上升到一定程度时,PSⅡ受体侧电子传递才会受到显著地抑制。同时,ψ0是对PSⅡ电子传递的综合评价之一,受PSⅡ供体侧的电子供应能力和受体侧(包括PSⅠ)接收电子的能力制约,其在本研究中呈现先升高后降低的趋势,同样表明了软枣猕猴桃叶片只有受到更高温度的胁迫时,才会显著抑制光合电子向QA以后的电子传递体继续传递。然而,本研究中Vk则随温度升高而缓慢增加,在52 ℃显著增加,说明PSⅡ供体侧对高温响应的敏感性高于受体侧,其活性随着温度的升高逐渐受到抑制。这些结果均表明,在Fv/Fm近似一致的情况下,高温胁迫对PSⅡ的能量分配已经产生了显著的影响,电子传递链的不同位点对不同的温度有显著不同的反应,供体侧在高温下受到的伤害较受体侧更为严重。
综上所述,高温胁迫会引起软枣猕猴桃叶片PSⅡ电子传递链供体侧和受体侧受到伤害,但供体侧对高温更加敏感;与JIP-测定的相关参数相比,Fv/Fm不能有效地评价光系统活性对热胁迫的反应,也不能对PSⅡ的异质性提供全面有效的信息。
参考文献:
[1]ZHAO SH L(赵淑兰),YUAN F G(袁福贵),MA Y SH(马月申),etal.Kui Lu-A new cultivar ofActinidiaargutaPlanch[J].ActaHorticulturaeSinica(园艺学报),1994,21(2):207-208(in Chinese).
[2]LI Pm(李鹏民),GAO H Y(高辉远),STRASSER R J.Application of chlorophyll fluorescencedynamics to the study of phytobiology[J].JournalofPlantPhysiologyandMolecularBiology(植物生理与分子生物学学报),2005,31(6):559-566(in Chinese).
[3]STRASSER B J.Donor side capacity of photosystem Ⅱ probed by chlorophyll a fluorescence transients[J].PhotosynthesisResearch,1997,52(2):147-155.
[4]STRASSER R J,SRIVATAVA A,TSIMILLI-MICHAELm.The fluorescence transient as a tool to characterize and screen photosynthetic samples[M].UK:Taylor and Francis,2000:445-483.
[5]OUKARROUM A,SCHANSKER G,STRASSER R J.Drought stress effects on photosystem I content and photosystem Ⅱ thermotolerance analyzed using Chl a fluorescence kinetics in barley varietiesdiffering in theirdrought tolerance[J].PhysiologiaPlantarum,2009,137:188-199.
[7]JIANG Cd,GAO H Y,ZOU Q.Leaf orientation,photorespiration and xanthophyll cycle protect young soybean leaves against high irradiance in field[J].EnvironmentalandExperimentalBotany,2006,55:87-96.
[8]VAN Pd R,SWANEPOEL J W,KRÜGER G H J.Modulation of photosynthesis bydrought in twodesert scrub species exhibiting C3-mode CO2assimilation[J].EnvironmentalandExperimentalBotany,2007,61:124-136.
[9]GEORGIEVA K,TSONEV T,VELIKOVA V,etal.Photosynthetic activityduring high temperature of pea plants[J].JournalofPlantPhysiology,2000,157(2):169-176.
[10]WANGm(王梅),GAO ZH K(高志奎),HUANG R H(黄瑞虹),etal.Heat stress characteristics of photosystemⅡin eggplant[J].ChineseJournalofAppliedEcology(应用生态学报),2007,18(1):63-68(in Chinese).
[11]姜闯道.高等植物光合作用中的激发能分配及光破坏防御机制[D].山东泰安:山东农业大学,2003.
[12]OUKARROUM A,SCHANSKER G,STRASSER R J,etal.Probing the responses of barley cultivars(HordeumvulgareL.) by chlorophyll a fluorescence OLKJIP underdrought stress and rewatering[J].EnvironmentalandExperimentalBotany,2007,60:438-446.
[13]CHEN L S,LI Pm,CHENG L L.Comparison of thermotolerance of sun-exposed peel and shaded peel of ‘Fuji’ apple[J].EnvironmentalandExperimentalBotany,2009,66(1):110-116.
[14]WEN X G,QIU N W,LU Q T,etal.Enhanced thermotolerance of photosystem Ⅱ in salt-adapted plants of the halophyteArtemisiaanethifolia[J].Planta,2005,220(5):486-497.
[15]MATHUR S,JAJOO A,MEHTA P,etal.Analysis of elevated temperature-induced inhibition of photosystem Ⅱ using chlorophyll a fluorescence induction kinetics in wheat leaves(Triticumaestivum)[J].PlantBiology,2011,13:1-6.
[16]LU C,ZHANG J.Heat-inducedmultiple effects on PSⅡ in wheat plants[J].PlantPhysiology,2000,156:259-265.
[17]STRASSER B J.Donor side capacity of photosystem Ⅱ probed by chlorophyll a fluorescence transients[J].PhotosynthesisResearch,1997,52:147-155.
[19]LU C,ZHANG J.Effects of water stress on photosystem Ⅱ photochemistry and its thermostability in wheat plants[J].JournalofExperimentalBotany,1999,50:1 199-1 206.
[20]KRAUSE G H,WEIS E.Chlorophyll fluorescence and photosynthesis:the basis[J].AnnualReviewofPlantPhysiologyandPlantMolecularBiology,1991,42:313-349.
[21]GOVINDJEE.Sixty-three years since Kautsky:chlorophyll a fluorescence[J].AustralianJournalofPlantPhysiology,1995,22(2):131-160.
(编辑:裴阿卫)
