多年生植物欧夏至草集合繁殖体特性
2015-07-04孟雅冰李新蓉
孟雅冰,李新蓉
(新疆农业大学 草业与环境科学学院,新疆草地资源与生态重点实验室,乌鲁木齐830052)
在长期的自然选择过程中,被子植物发展出多样的繁殖体特征(如外形、重量、附属物的多态性等)以保证其扩散成功[1],根据其形态特征的不同呈现多样化的繁殖体,如黏性繁殖体、异型繁殖体、集合繁殖体等[2-3]。其中集合繁殖体又称为聚合传播体(synaptospermy),是指两颗或多颗种子(或单种子果实)聚合在一起形成一个联合的传播体单元,它是成熟种子为适应环境而演化出的一种生存策略[2,4-6];依据其扩散及萌发状态的不同,分为短暂集合繁殖体(在扩散过程中分离)及典型集合繁殖体(在萌发前不分离)两种类型[7-9]。同一植株内能产生两种或更多形态繁殖单元的现象称为繁殖体多态型(heterodiaspory),繁殖体的多态特点增强了植物种在可变环境中的生存能力,为远程扩散及抗远程扩散的适应提供保障[10]。集合繁殖体能有效调控种子扩散及萌发的时间,对研究植物的生态适应机制、生活史对策的进化等方面具有重要的生态意义。
目前,国际上将集合繁殖体作为对植被的区系调查与对植被在荒漠环境扩散的适应策略中研究较多,主要集中在豆科、十字花科、石竹科和禾本科[1,4,11-12];附属物构成是否使其适应于远程扩散 或抗远程扩散仍存在争议[1,13];其内种子萌发行为的研究主要体现在禾本科、葱属、罂粟科及十字花科[5,14-15]。我国学者对荒漠环境条件下集合繁殖体的形态进行了初步描述,但未对集合繁殖体的生态功能作进一步研究,尤其是同一植株内集合繁殖体和种子的比较研究及附属物的功能未见报道[2,16]。
欧夏至草(Marrubiumvulgare)隶属唇形科欧夏至草属(Marrubium),单种属,多年生草本,新疆产1种,是一种常见中药材。花萼管状,其中5枚主齿较长,5枚副齿较短,钻形,在先端处呈钩吻状弯曲,密被短柔毛,小坚果卵圆状三棱形[17]。观察地欧夏至草花期6~8月,果期7~9月,其扩散单位主要由集合繁殖和种子组成,集合繁殖体是具萼筒的种子,多以1个萼筒、8个萼筒、15个萼筒为集合繁殖体进行扩散,本文以单萼筒集合繁殖体为研究材料,比较其和种子在形态特征、扩散行为及萌发特性上的差异,探讨附属物的生态功能及对可变环境的适应对策,为进一步探讨唇形科多年生植物的生活史对策等方面的研究提供重要的基础资料。
1 材料和方法
1.1 试验材料
试验材料欧夏至草集合繁殖体和种子采自乌鲁木齐市郊,地理位置43°56′N,87°29′E,平均海拔830m,该地区年降水量235.9mm,蒸发量2 731.0 mm,年平均气温8.6℃,年日照时数约2 841.8h,无霜期150~190d[18]。
1.2 观测方法
1.2.1 形态特征观测 随机选取成熟且发育正常的集合繁殖体和种子,记录颜色及形状,用游标卡尺(GB/T1214型,150×0.02mm)分别测量每个集合繁殖体附属物齿的长度,统计其内种子数;用Statorius BS210S 型电子天平(Sartorius Co.,Goettingen,Germany)分别对集合繁殖体和种子称重,后去除集合繁殖体内种子对附属物称重。各10组重复,每组100粒,计算平均值。
附属物占质量百分比(%)=(附属物质量/集合繁殖体质量)×100%
1.2.2 扩散特性观察 为比较欧夏至草集合繁殖体和种子的扩散特性,我们在自然生境中对其扩散方式进行观察,室内控制性实验对其的扩散能力进行评价。
(1)静止空气中垂直沉降速度的测定 将表面与内壁光滑的树脂圆筒(内径15cm,长150cm)固定在实验台上,在圆筒上部倒扣一个底部挖出小圆的纸杯,以减小室内空气气流的影响,在圆筒底部使用照明器,以提供清晰视角。用镊子轻轻夹住集合繁殖体或种子,自然松开镊子,使其自然沉降。用电子秒表测量其到达底部所需时间,并换算成降落速率,各10组重复,每组100粒[19]。
(2)不同风速下水平位移的测定 将爱德FT40型台扇(爱德电器有限公司,佛山,中国)放置于与欧夏至草株高相同的高度(约46cm),用AZ8910型风速计(珠海天创仪器有限公司,珠海,中国)测定距电风扇不同距离的水平气流的风速,模拟野外风速为2、4和8 m·s-1处将集合繁殖体和种子分别释放,观测并比较其在水平气流作用下水平方向的扩散距离,各10组重复,每组100粒。
降落速率(cm·s-1)=降落距离/降落时间
1.2.3 活力特性测定 去除集合繁殖体附属物,与无附属物的种子分别用蒸馏水浸泡24h,次日实验将待测种子沿胚珠方向纵切置于新的培养皿中,加入0.1% TTC(氯化三苯基四氮唑)溶液,30℃恒温下浸泡6h后清洗种子并计数被染红的数目,各10组重复,每组100粒,计算平均值。
集合繁殖体活力(%)=(集合繁殖体内种子被染红粒数/集合繁殖体内种子总粒数)×100%
1.2.4 吸水特性测定 25℃恒温条件下,将集合繁殖体(n=50)称重后置于培养皿中进行吸水量测定,从放入培养皿起(第0h)每隔1h将其取出,放在滤纸上吸干表面水分,称重,再放回培养皿中,记录直到其吸水量不再增加为止得到吸水率最大值;由于种子质量较小,其吸水量的测定选取每组200粒进行;各10组重复,计算平均值。
吸水率(%)=[(吸水后集合繁殖体质量-吸水前集合繁殖体质量)/吸水前集合繁殖体质量]×100%
1.2.5 萌发试验 将集合繁殖体内近轴端上部种子记为1,按顺时针方向依次标记进行萌发实验,以探索其萌发率及萌发位置效应。选取25℃恒温、光照/黑暗各12h、含水量5%的最适萌发条件下进行,将集合繁殖体和种子分别置于直径为9cm、铺有2层滤纸的培养皿中,每天17:00~17:30称重以补充损失的水分,胚根突破种皮即萌发。记录其萌发位置、萌发时间及持续时间,统计发芽数,2013年3月28日记录为第1天,持续观测60d,观察结束时统计每个集合繁殖体内种子总数。
萌发率(%)=(集合繁殖体内种子发芽数/集合繁殖体内种子总数)×100%
萌发速率=∑(第n天种子发芽数/对应的发芽天数)
1.3 数据处理
所有数据均用SPSS 19.0(SPSSInc.,Chicago,IL,USA)程序统计软件包进行处理和分析,采用One-way ANOVA 分析比较不同数据组间的差异显著性,用Bivariate Correlation进行相关性分析。曲线图均用Sigma plot 12.0绘图软件绘制。
2 结果与分析
2.1 形态特征
欧夏至草主要由集合繁殖体和种子进行扩散,其中集合繁殖体是具萼筒的种子,萼筒管状,易随风力作用从植株上随机掉落,多以1 个萼筒、8 个萼筒、15个萼筒为集合繁殖体进行扩散(图1,A);萼筒口密被绒毛,宽度为(2.4±0.5)mm,通常具10枚钩状齿,5枚主齿与5枚副齿交替呈现,齿较短较脆,平均长度分别为(2.4±0.2)mm 和(1.2±0.3)mm(图1,B),附属物占质量百分比约为45.29%;集合繁殖体质量在0.002 2~0.006 3g之间,种子平均质量为0.000 6g,集合繁殖体质量远大于种子,存在极显著差异(P<0.01,F=446.877),扩散前集合繁殖体含种子数(3.9±0.4)枚,种子成熟后为褐色,小坚果卵圆状三棱形(图1,C)。
2.2 扩散特性
在自然生境中,欧夏至草的扩散单元多以集合繁殖体为主,随风力作用进行扩散,集合繁殖体成熟后从植株上掉落,在风力作用下能扩散到较远的生境中;扩散时种子从集合繁殖体中分离,这种在扩散过程中集合繁殖体分离的现象符合短暂集合繁殖体特性;植株地上部分干枯后其扩散单元以延迟扩散的方式散落在母株周围。

图1 欧夏至草扩散单元的形态特征Fig.1 Morphological characteristics of dispersal unit of M.vulgare
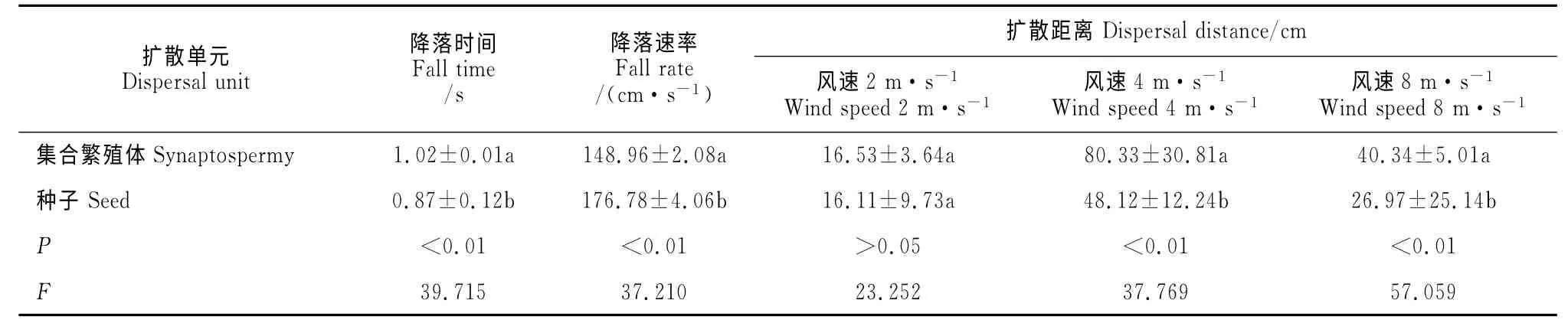
表1 欧夏至草集合繁殖体和种子的降落时间及在不同风速下的扩散距离(均值±标准误差)Table 1 Fall time and effect of wind speed on dispersal distance of dispersal units of M.vulgare(mean±SE)

表2 欧夏至草集合繁殖体和种子萌发参数的单因素方差分析离(均值±标准误差)Table 2 Results of one-way ANOVA to determine the effects of synaptospermy and seed on germination parameters of M.vulgare(mean±SE)
室内扩散实验表明(表1),在静止空气中,集合繁殖体和种子在降落时间和降落速率(P<0.01)上均存在极显著差异;质量与降落时间的相关性分析表明,集合繁殖体质量与降落时间呈正相关关系(r=0.763,P<0.01,n=100),种子质量与降落时间呈负相关关系(r=-0.825,P<0.01,n=100)。在一定距离中,集合繁殖体降落所需的时间更长,这表明附属物的存在使集合繁殖体的扩散能力比种子更强。在2、4及8m·s-1的水平气流作用下,集合繁殖体的扩散距离均比种子远。
2.3 活力特性
欧夏至草集合繁殖体和种子的活力分别约为72.42%和71.96%,无显著差异(P>0.05;表2)。
2.3.1 吸水特性 集合繁殖体和种子吸水率基本在2h内达到最大值,分别为184.47%和6.01%,存在显著差异(P<0.05),附属物的存在可能是影响种子承载更多水分并更长期保留水分的重要原因(表2)。
2.3.2 萌发特性 萌发试验表明(表2),集合繁殖体的萌发为随机萌发,不具有位置效应,且当季最多只萌发1粒种子,不存在同一集合繁殖体内超过2枚种子同时萌发的现象;集合繁殖体和种子分别在第18~20天和第17~21天开始萌发,在第37天和第41天后停止萌发,萌发率及萌发速率均较低,不存在显著差异(P>0.05)。
3 讨 论
具有集合繁殖体的植物通常与荒漠或干扰较重的可变环境相联系[1,4,20]。在本文中,欧夏至草集合繁殖体在质量、吸水量及扩散距离等方面明显大于种子,而在活力、萌发率及萌发速率等方面与种子不存在显著差异,说明附属物的存在决定其在形态、吸水能力及扩散行为上的差异,这种差异主要表现在以下几方面:
首先,附属物的形成是植物生活史进化的一个重要特征,能保护种子免受机械损伤或远离其它危险[10-11]。欧夏至草集合繁殖体质量明显大于无附属物保护的种子,能保护种子或逃避捕食者,比种子吸收更多水分并更长期地保留,防止其迅速干燥,这些特点与Pteranthusdichotomus和Limoniumthouinii等植物相似[4,9]。
其次,集合繁殖体是种子延迟扩散的一种适应策略[21],其附属物的存在与否直接导致了种子扩散能力与扩散距离的差异:欧夏至草集合繁殖体具附属物,其降落时间较长,扩散范围较大,说明集合繁殖体扩散能力比种子强;在扩散过程中,集合繁殖体内的种子随机掉落,这种在扩散时导致传播体分离的现象符合短暂集合繁殖体特性,与对Salsolakali,Brunsvigiaappendiculatad等物种的研究报道一致[10];在2、4及8m·s-1的水平气流作用下,集合繁殖体的扩散距离均比种子远,其附属物具齿能进行动物体外传播,我们认为其更适应于远程扩散,与Navarro 等[1]对 多年 生Medicagosuffruticosa适应于远程扩散的观点相同。欧夏至草集合繁殖体的质量明显大于种子,其在静止空气中的降落速率应该大于种子,而在相同风速下的扩散距离应该小于种子,但由于具附属物,使其在空气中具有较大浮力,最终导致其降落速率比种子小,扩散距离比种子远,这与Meyer等[22]的观点不同,他们认为传播体质量越轻,扩散能力越强。欧夏至草集合繁殖体对扩散距离的适应,支持“Alternate假说”,即存留在母株附近多年生植物的传播体很难有机会找到适宜其萌发的生境,因为母株早已占据了这样的空间,因此物种必须进化出能运送传播体远离母株的机制[4,23]。集合繁殖体具有多种扩散机制,能使其扩散到有利的环境条件后萌发,在一定程度上为植物的拓殖及种子库的建立提供了丰富的手段,避免了同胞子代在生态位上的竞争[24-27]。
种子萌发是种子植物生活史中实现中期更新和物种延续的关键环节之一[28],但对于不同的生活型重要性是不同的。在恶劣的环境条件下,许多植物可能进化出了两种对立的萌发策略,即种子成熟后在适宜的萌发条件下仍保持休眠状态或缓慢萌发,一旦遇到有利条件便迅速萌发,前者使种子保留在种子库中,降低了种子萌发和幼苗建植过程中的死亡率,确保种群延续,后者增加了萌发时可能遇到的风险,却及时补充了种群数量[29]。在本文中,欧夏至草集合繁殖体的萌发位置为随机萌发,不具有规律性,且当季只萌发部分种子,不存在同一集合繁殖体内多粒种子的萌发现象,这种与Pteranthusdichotomus及Buchloedactyloides的萌发特点相似,剩下未萌发的种子仍然保持在集合繁殖体内,分散在不同月或年间萌发[9,30],我们认为其具间歇性萌发特性;集合繁殖体和种子低萌发率表明其萌发策略趋向于缓慢萌发,这种特性能有效避免种群覆灭,能确保一定数量的种子为次年种群稳定打下坚实的基础。多年生植物扩散单元的形态特征和萌发行为对于种群的生存重要性相对低,母株可以长期占据原有的生境,保持种群个体数量,其扩散单元的作用主要用于种群扩散。
综上所述,特定的扩散机制对某些植物群落的特性具有重要的生态学意义,多年生植物会选择最佳的萌发策略以扩大其优势度,这种最佳的扩散及萌发行为保障了物种的繁衍成功。
致谢:审稿专家对本文的撰写提出了宝贵意见及建议,在此表示衷心的感谢。
[1]NAVARRO T,El OUALIDI J,TALEB M S,etal.Dispersal traits and dispersal patterns in an oro-Mediterranean thorn cushion plant formation of the eastern High Atlas,Morocco[J].Flora,2009,204(9):658-672.
[2]LIU ZH M(刘志民),LI X H(李雪华),LI R P(李荣平),etal.Comparative study of seventy kinds of plants’propagules form in Kerqin Sandy Land[J].ActaPrataculturaeSinica(草业学报),2003,12(5):55-61(in Chinese).
[3]ZHU J L(朱金雷),LIU ZH M(刘志民).Major terminologies and concepts in seed dispersal biology[J].ChineseJournalofEcology(生态学杂志),2012,31(9):2 397-2 403(in Chinese).
[4]ELLNER S,SHMIDA A.Why are adaptations for long-range seed dispersal rare in desert plants?[J].Oecologia,1981,51(1):133-144.
[5]QUINN J A.Relationship between synaptospermy and dioecy in the life-history strategies ofBuchloedactyloides(Gramineae)[J].AmericanJournalofBotany,1987,74(8):1 167-1 172.
[6]CHEPLICK G P.Sibling competition in plants[J].JournalofEcology,1992,80(3):567-575.
[7]STOUTAMIRE W.Chromosome races ofGaillardiapulchella(Asteraceae)[J].Brittonia,1977,29(3):297-309.
[8]VAN ROOYEN M W,THERON G K,GROBBELAAR N.Life form and dispersal spectra of the flora of Namaqualand,South Africa[J].JournalofAridEnvironments,1990,19(2):133-145.
[9]GUTTERMAN Y.Survival strategies of annual desert plants[M].Springer-Verlag Berlin Heidelberg New York,2002:65-208.
[10]VAN RHEEDE VAN OUDTSHOORN K,VAN ROOYEN M W.Dispersal Biology of Desert Plants[M].Springer-Verlag,Berlin,1999:93-119.
[11]ZOHARY M.Plant Life of Palestine[M].New York:1962:178-187.
[12]ROMERO-ZARCO C.Helictochloa Romero Zarco(Poaceae),a new genus of oat grass[J].Candollea,2011,66(1):87-103.
[13]VAN DER PIJL L.Principles of dispersal in higher plants[M].Springer-Verlag,New York,1982:91-144.
[14]KAMENETSKY R.Life cycle,flower initiation,and propagation of the desert geophyteAlliumrothii[J].InternationalJournalofPlant Sciences,1994,155(5):597-605.
[15]GUTTERMAN Y.Ibex diggings in the negev desert highlands of Israel as microhabitats for annual plants.Soil salinity,location and digging depth affecting variety and density of plant species[J].JournalofAridEnvironments,1997,37(4):665-681.
[16]LIU ZH M(刘 志 民),JIANG D M(蒋德 明),YAN Q L(阎巧 玲),etal.Study on dispersal biology of common species of Flora of the Horqin Stepe[J].ActaPrataculturaeSinica(草业学报),2005,6(14):23-33(in Chinese).
[17]WU ZH Y(吴征镒).Flora of China[M].Beijing:Science Press,2008:49-50.
[18]PALIDAN SALI(帕丽旦·萨力),LI X R(李新蓉).Floral syndrome and delayed autonomous selfing of hyoscyamus niger[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2012,32(10):2 009-2 015(in Chinese).
[19]ANDERSEN MC.Ananalysis of variability in seed settling velocities of several wind-dispersed Asteraceae[J].AmericanJournalofBotany,1992,79(10):1 087-1 091.
[20]GUTTERMAN Y,KAMENETSKY R,VAN ROOYEN M W.A comparative study of seed germination of twoAlliumspecies from different habitats in the Negev Desert highlands[J].JournalofAridEnvironments,1995,29(3):305-315.
[21]GUTTERMAN Y.Strategies of seed dispersal and germination in plants inhabiting deserts[J].BotanicalReview,1994,60(4):373-425.
[22]MEYER S E,CARLSON S L.Achene mass variation inEricamerianauseosus(Asteraceae)in relation to dispersal ability and seedling fitness[J].FunctionalEcology,2001,15(2):274-281.
[23]GARCíA-FAYOS P,ENGELBRECHT M,BOCHET E.Post-dispersal seed anchorage to soil in semiarid plant communities,a test of the hypothesis of Ellner and Shmida[J].PlantEcology,2013,214(7):941-952.
[24]EDMONDSON J.The correct name for the prophet flower:Arnebiapulchra(Boraginaceae)[J].Willdenowia,1977,8(1):23-26.
[25]HOWE HF,SMALLWOOD J.Ecology of seed dispersal[J].AnnualReviewofEcologyandSystematics,1982,13:201-228.
[26]KAMENETSKY R,GUTTERMAN Y.Life-cycles and delay of seed dispersal in some geophytes inhytes inhabiting the Negev desert highlands of Israel[J].JournalofAridEnvironments,1994,27:337-345.
[27]DE VILLIERS A J,VAN ROOYEN M W,THERON G K.Seed bank classification of the Strandveld Succulent Karoo,South Africa[J].SeedScienceResearch,2002,12(1):57-67.
[28]BU H Y,CHEN X L,XU X L,etal.Seed mass and germination in alpine meadow on the eastern Tsinghai-Tibet plateau[J].PlantEcology,2006,191(1):127-149.
[29]GREENBERG C H,SMITH L M,LEVEY D J.Fruit fate,seed germination and growth of an invasive vine-An experimental test of“sit and wait”strategy[J].BiologicalInvasions,2001,3(4):363-372.
[30]QUINN J A,ENGEL J L.Life-history strategies and sex ratios for a cultivar and a wild population ofBuchloedactyloides(Gramineae)[J].AmericanJournalofBotany,1986,73(6):874-881.
