油菜品种及高油育种材料遗传多样性SSR分析
2015-07-04李晓荣张菁雯赵燕妮徐献锋胡玉梅于澄宇
李晓荣,张菁雯,赵燕妮,徐献锋,胡玉梅,于澄宇
(西北农林科技大学 农学院,陕西杨陵712100)
甘蓝型油菜(BrassicanapusL.AACC=38)是世界上重要的油料作物,是芸薹(BrassicacampestrisL.AA=20)和甘蓝(B.oleraceaL.CC=18)的种间杂交复合种[1],但其遗传变异程度远不如其祖先种白菜和甘蓝丰富,充分利用两个祖先种的基因资源可以扩大其遗传多样性[2]。遗传多样性是指各群体间和群体内不同个体间的遗传变异的总和[3],对育种材料进行遗传多样性分析,不仅可以揭示育种材料间的亲缘关系,为后续材料改良和品种选育提供参考,而且也是挖掘优异等位基因、选择特殊材料、进行种质资源合理保存的基础。目前常用于遗传多样性分析的分子标记主要有SSR、AFLP、ISSR等,其中SSR 具有分布广、易扩增、重复性好、多态性高、共显性等特点而广泛运用于油菜种质资源的研究[4]。SSR 在油菜上主要用于分析种质资源的遗传多样性[5-8]、群体结构[9]、筛选核心种质[10]和构建连锁图谱[11]等。
目前中国油菜育种的主要方法为杂种优势利用,并结合了油菜的双低、高产和高含油量等育种目标[12]。杂种优势利用首先要求选育一批性状优良的自交系,为了获得高产优质杂交组合,这些自交系必须具有较高的遗传多样性。遗传距离是度量亲本遗传差异的有效参数,据之可将亲本较好地分类[13-14]。一般认为,植物亲本材料的遗传距离与其杂种优势或杂种表现可能具有一定的相关性,而油菜的遗传距离与杂种优势是否具有相关性争议较大,但是育种实践表明亲本间适当的遗传距离是获得较高杂种优势的必要条件[15]。因此对主要栽培品种、重要自交系进行遗传多样性和遗传结构分析,判断其亲缘关系,评价它们的异质性,划分杂交优势群是选出优良自交系及杂交种的关键。高含油量材料的创制与应用是当前中国油菜品种改良的一个主攻方向,使得各个育种单位的材料快速更新换代,高含油量油菜品种的选育也取得突破,如‘中双11号’、‘浙油50’、‘秦优88’等在区域试验中籽粒含油量都已接近50%。西北农林科技大学油菜研究中心近年来通过定向选择、从引进杂交组合中系谱选育、高强度品种间杂交等方法选育了一批高含油量育种材料,比传统育种材料提高3~10 个百分点。但是这些材料的遗传构成及亲缘关系尚不明确,因此剖析其遗传多样性是当前迫切任务。本研究主要以甘蓝型油菜新育种材料为研究对象,通过SSR 分子标记检测,分析引进材料和培育自交系之间的亲缘关系、遗传多样性,为油菜杂种优势利用育种提供参考。
1 材料和方法
1.1 材 料
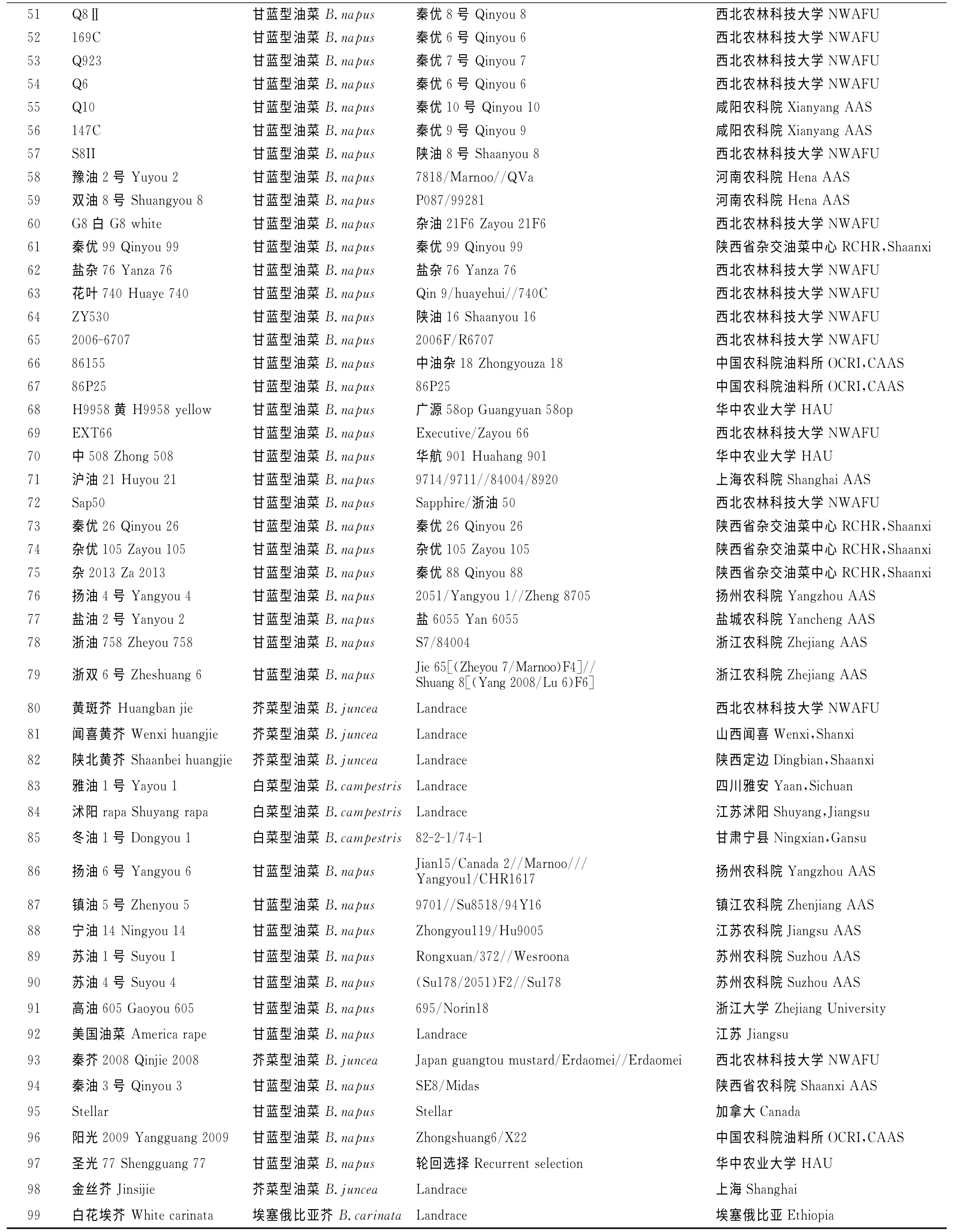
近年来西北农林科技大学油菜研究中心选育的骨干亲本、高含油量自交系和引进品种等91份,以及作为参考的芥菜型油菜、白菜型油菜和埃塞俄比亚芥等8份芸薹属近缘种,材料信息见表1。所有材料于2012年秋季播种于西北农林科技大学杨凌试验田,每个材料种1~3行,田间管理同大田生产。
1.2 SSR 分析
花蕾期选择5 个正常植株,混合法取嫩叶约0.50g,存放于-80℃冰箱。改良CTAB[16]法提取总DNA,0.8%的琼脂糖凝胶电泳检测DNA 提取质量,用TE溶液稀释10μL DNA 母液至50~100 ng/μL储存于4℃冰箱用于扩增,其余存放于-20℃冰箱备用。
从已开发的甘蓝C 组和白菜A 组染色体SSR标记中选取均匀分布于19条染色体上的160对引物,包括BoGMS系列、cnu_m 系列和nia_m 系列,引物系列、名称参考相关文献[17-19],由北京奥科鼎盛生物科技有限公司合成。用48份材料筛选出多态性高、条带清晰的48对引物对所有材料进行扩增分析,其中25对为A 基因组,23对为C基因组。PCR反应体系为10μL,包含1μL DNA(约100ng),3 μL ddH2O,上下游引物各0.5μL(50ng/μL)和5 μL Reaction Mix(康为公司合成)。PCR 程序为94℃预变性4min;94℃变性45s,52~60℃退火45 s,72℃复性1min,共35个循环;最后72℃延伸7 min,4℃保存。PCR 产物用6%非变性聚丙烯酰胺凝胶电泳,电压150V,电流70~80mA,时间2h。银染法染色分析,观察拍照并记录。
1.3 数据统计和分析
统计电泳明晰的条带,以Marker为参照在相同的迁移率上按每个样品扩增条带有无记为“1”或“0”,在Excel中列出“0,1”二元数据矩阵。计算基于A 组和C组标记的遗传相似系数(GS),公式为:
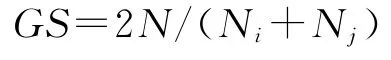
式中,N表示i和j材料的公共条带数;Ni表示i材料中扩增的条带数;Nj表示j材料中扩增的条带数[20]。在NTSYS pc.2.1软件中构建UPGMA(非加权算术平均)聚类图。

表1 材料编号、系谱和来源Table 1 Code,pedigree and origin of materials
续表1 Continued Table 1
2 结果与分析
2.1 SSR引物多态性分析
用筛选的48对SSR 引物对99 份参试材料进行扩增,共检测到336个清晰条带,其中255个具有多态性,占总数69.67%(图1)。如表2所示,A 组染色体的25对引物共检测到186个清晰条带,其中153个条带在不同材料中有差异,多态性比率为82.26%。条带数为3~11,平均每对引物扩增的条带数为7.44个,以nia_m103(11)最多。多态性条带为1~11个,平均为6.25个。其中nia_m060(10)、cnu_m052(10)、nia_m034(9)和nia_m103(11)引物不仅扩增条带多,且有100%多态性比率,表明其标记具有高效性。23对C 组染色体SSR 引物共扩增到清晰条带150个,102个具有多态性,多态性比率为68.00%。引物条带数为3~10个,平均每对引物为6.50个,以BoGMS1394(10)和BoGMS0867(10)最多,其次是BoGMS0847(9)和BoGMS1171(9)。多态性条带为2~10,平均每对引物为4.42 个,BoGMS0867(10)最 多,BoGMS0847(9)次 之,BoGMS1240等8 对引物只有2 个多态性条带。BoGMS0867、BoGMS0847 和BoGMS1171 等3 对引物具有扩增性好,多态性高的特点,可作为核心引物。表2结果显示,A 组染色体上的SSR 引物扩增和多态性比率均高于C组。
2.2 相似系数分析
统计48 对SSR 引物扩增结果的相似系数(GS),发现99份育种材料的成对相似系数变幅为0.500 0~0.904 8。其中相似系数最小的2个品种为‘沭阳rapa’和‘楚0708’,相似系数为0.500 0;‘沭阳rapa’与‘浙油18’、‘国盛油6 号’和‘浙大619’的相似系数也较小,均为0.507 9。相似度最高的品种为‘秦荣2号’和‘秦荣3号’,达到0.904 8,这2个材料均来自陕西省杂交油菜中心。其次分别为‘浙油17’和‘浙油18’、‘浙油50’和‘浙油51’,相似系数均为0.900 8,均来自浙江农科院。
将相似系数划分成5个区间进行统计分析结果(表3)显示,相似系数在0.600 0~0.799 9区间内所占的比例高达92.08%,包括了大部分材料;0.800 0~0.899 9 区 间 内 有134 个,占 总 数 的2.76%;仅有233个相似系数小于0.600 0,占总数的4.60%,说明这99份参试油菜育种材料大部分遗传相似度较高,多样性不够丰富。
2.3 99份油菜育种材料的聚类分析
99份油菜育种材料分别基于A 基因组、C 基因组为主标记进行UPGMA 的聚类结果见表4。
依据25对主要分布于A 基因组的SSR 引物扩增结果,99份材料相似系数区间为0.59~0.92,聚类分析分为7组。第I组包括62个材料,占所有材料的62.63%,其中22个陕西材料,8个中国农科院油料作物研究所材料,5个贵州材料和7个浙江大学材料。第Ⅱ组包括15个来自12个不同地区的材料。第Ⅲ组包括8个材料,其中5个材料来自陕西,包括春油菜Polo、Stellar、D636R,而‘杂优105’和D615含有春油菜血缘,另外还有Slog9、‘双1’和‘沪油21’。第Ⅳ组包括7个材料,有‘G8白’、‘白花埃芥’、‘金丝芥’、169C、Q923、‘H9958 黄’、‘浙双6号’。第Ⅴ组包括‘黄斑芥’、‘闻喜黄芥’和‘陕北黄芥’。第Ⅵ组包括‘雅油1号’、‘沭阳rapa’和‘冬油1号’。‘秦芥2008’在0.65处与其他材料分离单独聚为一类。
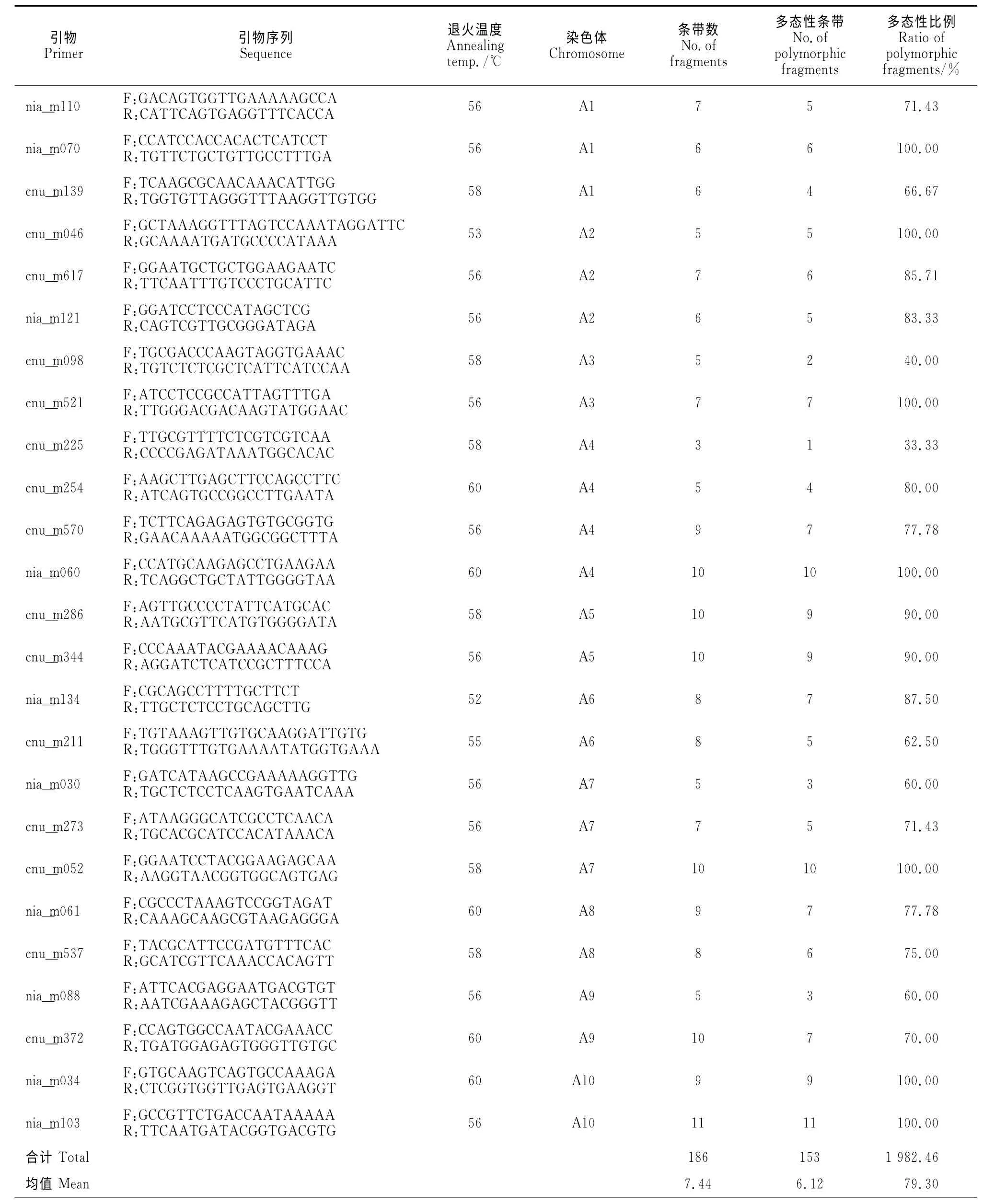
表2 48对SSR 引物信息及其对99份材料的扩增结果Table 2 Information about 48pairs of SSR primers and their amplification
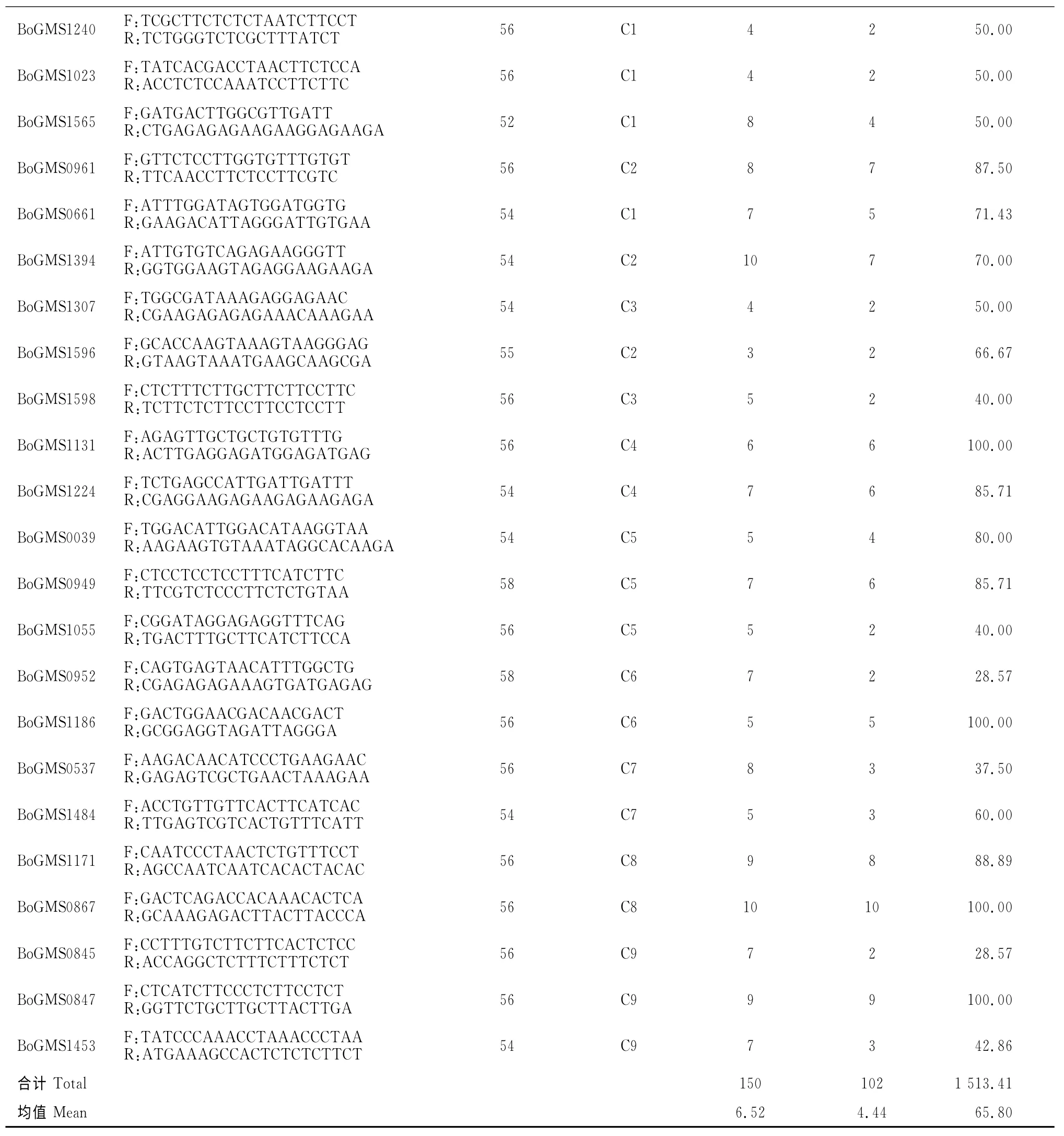
续表2 Continued Table 2
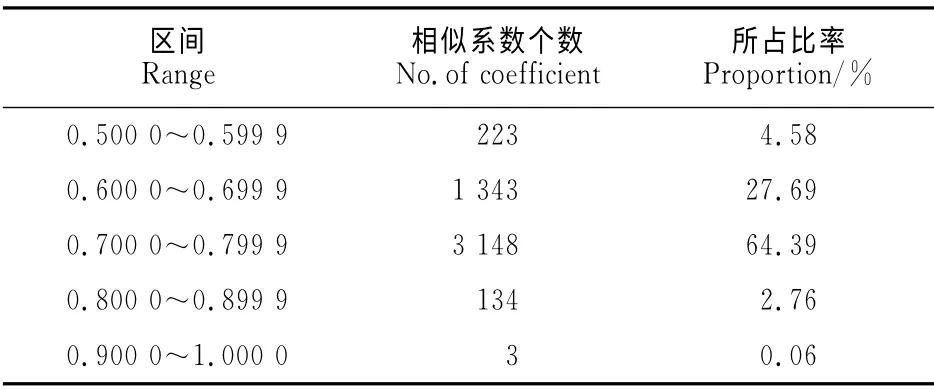
表3 分别基于A、C组引物扩增结果的聚类群Table 3 Groups of 99rapeseed materials clustered based on the amplification using SSR primers in A and C genomes
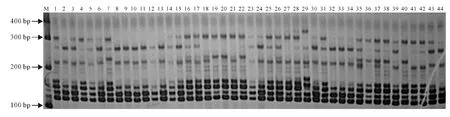
图1 引物BoGMS1171在部分参试材料中的扩增Fig.1 DNA fragment amplified by primer BoGMS1171in some materials
依据23对主要分布在C基因组的SSR 引物扩增结果,99 份材料相似系数区间为0.62~0.96,UPGMA 聚类结果(表4)表明,在相似系数阀值为0.73处可把所有材料聚为5组。第Ⅰ组包括87个材料,占总数87.88%;第Ⅱ组包括来自澳大利亚的Saphhire和CB Boomer等2个春油菜品种;第Ⅲ组包括来自英国的Mohican和来自捷克的Solida;第Ⅳ组包括‘黄斑芥’、‘闻喜黄芥’、‘陕北黄芥’、‘雅油1号’、‘沭阳rapa’和‘冬油1号’;第Ⅴ组包括‘秦芥2008’和‘金丝芥’。在阀值为0.75处又可以把第Ⅰ组的87个材料分为6个亚组。第i亚组包括15个材料,其中包括中国农科院油料研究所的6个材料;第ii亚组包括51个材料,大部分为陕西材料;第iii亚组包括8个材料;第iv亚组包括来自云南的A35和陕西省杂交油菜中心的3个材料;第vi亚组包括8个材料;来自埃塞俄比亚的白花埃芥与其他86个材料距离最远。比较基于A 组和C 组的聚类结果显示,两大类SSR 引物由于其产物主要分布于A 基因组和C基因组,其揭示的遗传信息不同,遗传相似系数不同,聚类结果也有明显差异,C 组SSR 标记显示材料的遗传差异与栽培区域关系更为密切,而A 组SSR 分析对白菜型油菜、芥菜型油菜、甘蓝型油菜的区分更明确。综合A、C 两组SSR 标记对99份材料进行UPGMA 聚类,结果(图2)表明,在阀值为0.71处将99份材料聚为5组。第Ⅰ组包括89个材料,占到所有材料的89.90%;第Ⅱ组仅包括白花埃塞俄比亚芥和‘G8白’2个白花材料,可能与‘G8白’的白花基因染色体来源有关;第Ⅲ组包括‘黄斑芥’、‘闻喜黄芥’、‘陕北黄芥’和‘金丝芥’4个材料;第Ⅳ组包括‘雅油1号’、‘沭阳rapa’和‘冬油1 号’3个白菜型材料;第Ⅴ组仅有1 个‘秦 芥2008’。第Ⅰ组89个甘蓝型油菜在阀值为0.73处又分为5个亚组。第i亚组包括43个材料,主要为陕西的恢复系、华中农业大学和浙江材料;第ii亚组包括9个材料,以陕西材料为主;第iii亚组包括12个材料,以贵州和国外材料为主,除H15R 外均为polima CMS的保持系;第iv亚组包括19 个材料,主要是中国农科院油料作物研究所、浙江农科院和来自安徽的材料,除‘X 矮’外均为polima CMS的保持系;第v亚组包括Qz052、CDH、‘双1’、Q10、147C、和‘浙油758’。
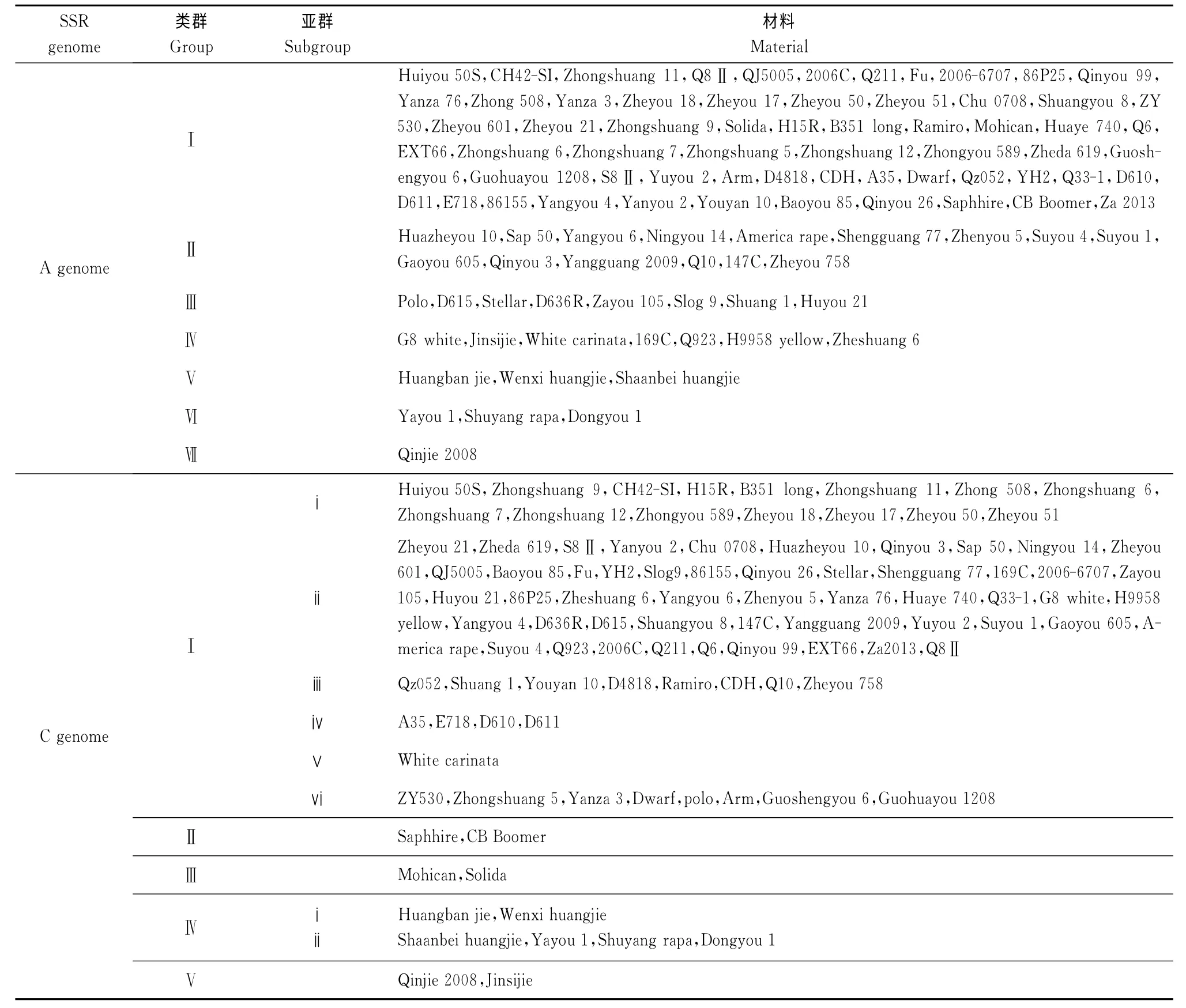
表4 基于25对A组引物和23对C组引物扩增结果的聚类群Table 4 Groups of 99rapeseed materials clustering with 25pairs of primers in A genome and 23pairs of primers in C genome
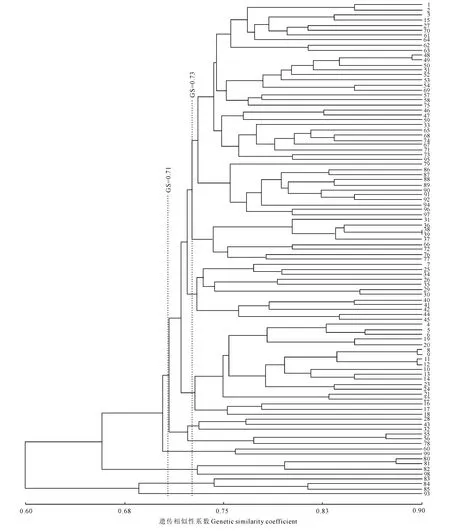
图2 基于48对SSR 引物扩增结果对99份油菜的UPGMA 聚类图Fig.2 Dendrogram of UPGMA clustered based on the amplification using 48SSR primer pairs
总体看来,无论是用23对C组标记、25对A 组标记、还是合并这48对引物的结果进行聚类,均可以把所有参试材料聚为三大类:第一大类包括了大部分材料,除了来源自埃塞俄比亚的白花埃芥(B.carinata)外均为B.napus型材料,第二大类为芥菜型材料,第三大类为白菜型材料。3个聚类结果皆显示,相同种的材料聚在一起,来自同一地区、同一育种单位的品种分布于不同的大组中,说明油菜种质资源存在交流。3个聚类结果中,来自陕西省的的大部分品种都在第一大组里,其中陕西省杂交油菜中心、浙江农科院、中国农科院油料所的品种高度集中,说明各个育种单位的育种材料多样性低,或参试的材料均来自几个有限的核心骨干材料。
3 讨 论
本研究所选用的SSR 标记引物具有易扩增、重复性好、条带清晰等特性,且均匀散布在油菜的19个连锁群上。所选用的48对引物的扩增和分辨能力各异,多态性信息含量与条带数不尽一致,与雷天刚等[21]研究结果一致。其中C组23对引物多态性比率为68.00%,每对引物平均多态性条带为4.42个;A 组染色体25 对引物多态性比率为82.26%,每对引物平均多态性条带6.25个。A 组25对引物的扩增能力、多态性均高于C 组23 对引物。这可能是中国甘蓝型油菜在育种进程中利用白菜型远缘杂交较多,A 组遗传基础较广且白菜品种在改善品质育种时不会明显减少遗传多样性[22],而C 组遗传基础相对较狭窄所引起。成对相似系数统计结果显示,99 份材料遗传相似系数的变幅在0.500 0~0.900 8,相似系数在0.600 0~0.799 9区间的材料占92.08%,所选用的甘蓝型油菜育种群体的遗传多样性不高,这可能与农艺性状选择及骨干亲本的使用有关。
根据聚类结果可知,来自不同区域的材料在各大组中均有分布且在小组内聚集,各个大组中均有来自不同育种单位的材料,品种或品系按栽培区域来源聚集现象不明显,与范志雄等[23]的研究结果相似,因此按地理来源组配的强优势杂交组合的可靠性可能较低。所有参试材料也没有按恢复系、保持系,或者春性、冬性聚类,说明不同地区的油菜育种资源之间有着频繁的交流。同时来自同一育种单位的材料大部分聚在一个亚组内且具有较高的相似性,这可能由于育种较多依赖于核心骨干亲本而引起的。Qian[24]、姚艳梅等[25]的研究表明半冬性油菜与春油菜杂交是改良春油菜生产潜力的有效途径。从本研究中也可以看出,通过轮回选择选育的‘圣光77’、多亲复交选育的‘浙双6 号’和‘苏油1号’等品种的系谱较复杂,特异性较强,说明除过直接引进外来种质资源外,轮回选择、多亲本数复交、不同生态类型间杂交也是提高育种材料遗传多样性的重要途径。
[1]NAGAHARU U.Genome analysis inBrassicawith special reference to the experimental formation ofB.napusand peculiar mode of fertilization[J].JapanJournalofBotany,1935,20(7):389-452.
[2]XU K(许 鲲),LU G Y(陆光远),WU X M(伍晓明),etal.Nuclear-cytoplasmic diversity and population structure of European wildBrassicaoleracea[J].ChineseJournalofOilCropSciences(中国油料作物学报),2011,33(2):111-117(in Chinese).
[3]钱迎倩,马克平.生物多样性研究的原理与方法[M].北京:科学出版社,1994:117-141.
[4]YANG W ZH(杨文柱),JIAO Y(焦 燕).Application of SSR molecular marker technique in the field of biogenetics[J].JournalofAnhui AgriculturalSciences(安徽农业科学),2012,40(2):640-642(in Chinese).
[5]QU C M,MAEN H,LU K,etal.Genetic diversity and relationship analysis of theBrassicanapusgermplasm using simple sequence repeat(SSR)markers[J].AfricanJournalofBiotechnology,2012,11(27):3 923-3 933.
[6]ZHOU G L(周国岭),LIU P W(刘平武),YANG G SH(杨光圣),etal.Evaluation of the genetic diversity of hybrid parents inBrassicnapus[J].ScientiaAgriculturaSinica(中国农业科学),2004,37(11):1 766-1 771(in Chinese).
[7]NIE P(聂 平),DU D ZH(杜德志),XU L(徐 亮),etal.Genetic diversity analysis on different types ofB.napusL by SSR markers[J].ActaAgriculturaeBoreali-OccidentalisSinica(西北农业报),2008,17(4):109-113(in Chinese).
[8]CHEN X(陈 勋),WU J SH(吴江生),LIU K D(刘克德).Genetic diversity comparison between spring and weak-winterBrassicanapuscultivars using single-locus SSR markers[J].ChineseJournalofOilCropSciences(中国油料作物学报),2010,32(1):6-13(in Chinese).
[9]QIN Y M(秦艳梅),LI X(李 向),ZHAO J J(赵建军),etal.Analysis of population structure of non-heading Chinese cabbage based on SSR markers[J].ActaAgriculturaeBoreali-Sinica(华北农报),2013,28(3):62-66(in Chinese).
[10]REN L P(任丽平),NI X Y(倪西源),HUANG J X(黄吉祥),etal.Core collection of a representative germplasm population inBrassica napus[J].ScientiaAgriculturaSinica(中国农业科学),2008,41(11):3 521-3 531(in Chinese).
[11]PIQUEMAL J,CINQUIN E,COUTON F,etal.Construction of an oilseed rape(BrassicanapusL.)genetic map with SSR markers[J].TheoreticalandAppliedGenetics,2005,111(8):1 514-1 523.
[12]FU T D(傅廷栋).Rapeseed production and variety improvement in China[J].JournalofHuazhongAgriculturalUniversity(华中农业大学学报),1999,18(6),501-504(in Chinese).
[13]WANG X D(王学德),PAN J J(潘家驹).Studies on relationship between genetic distance of parents and yield heterosis in hybrid cotton[J].ActaAgronomicaSinica(作物学报),1990,16(1):32-38(in Chinese).
[14]NI X L(倪先林),ZHANG T(张 涛),JIANG K F(蒋开锋),etal.Correlations between specific combining ability,heterosis and genetic distance in hybrid rice[J].Hereditas(遗传),2009,31(8):849-854(in Chinese).
[15]YU C Y,HU S W,ZHAO H X,etal.Genetic distances revealed by morphological characters,isozymes,protein and RAPD markers and their relationships with hybrid performance in oilseed rape(BrassicanapusL.)[J].TheoreticalandAppliedGenetics,2005,110(3):511-518.
[16]SAGHAIMAROOF M A,SOLIMAN K M,JORGENSEN R A,etal.Ribosomal DNA spacer length polymorphisms in barley:Mendelian inheritance,chromosomal location,and population dynamics[J].ProceedingsoftheNationalAcademyofScienceoftheUSA,1984,81(24):8 014-8 018.
[17]CHENG X M,XU J S,XIA S,etal.Development and genetic mapping of microsatellite markers from genome survey sequences inBrassicanapus[J].TheoreticalandAppliedGenetics,2009,118(6):1 121-1 131.
[18]KIM H R,CHOI S R,BAE J,etal.Sequenced BAC anchored reference genetic map that reconciles the ten individual chromosomes ofBrassicarapa[J].BMCGenomics,2009,10(1):432.
[19]LI H T,CHEN X,YANG Y,etal.Development and genetic mapping of microsatellite markers from whole genome shotgun sequences inBrassicaoleracea[J].MolecularBreeding,2011,28(4):585-596.
[20]NEI M,LI W.Mathematical model for studying genetic variation in terms of restriction endonucleases[J].ProceedingsoftheNational AcademyofScienceoftheUSA,1979,76(10):5 256-5 273.
[21]LEI T G(雷天刚),ZHANG X K(张学昆),LI J N(李加纳),etal.Genetic diversity of yellow-seeded rapeseed lines(BrassicanapusL.)based on SSR markers[J].ChineseJournalofOilCropSciences(中国油料作物学报),2005,27(1):41-45(in Chinese).
[22]ZHAO Y G,OFORI A.Genetic diversity of European and Chinese oilseedBrassicarapacultivars from different breeding periods[J].AgriculturalSciencesinChina,2009,8(8):931-938.
[23]FAN ZH X(范志雄),LEI W X(雷伟侠),JIANG Y F(江莹芬),etal.Genetic diversity analysis on yellow seed oilseed rape(BrassicanapusL.)breeding lines with high oilcontent[J].Crops(作物杂志),2012,1:44-48(in Chinese).
[24]QIAN W,SASS O,MENG J,etal.Heterotic patterns in rapeseed(BrassicanapusL.):I.Crosses between spring and Chinese semi-winter lines[J].TheoreticalandAppliedGenetics,2007,115(1):27-34.
[25]YAO Y M(姚艳梅),NIE P(聂 平),DU D ZH(杜德志).Analysis of different ecotypes ofB.napusin Qinghai Province by SRAP markers and study on the relationship between genetic distance and F1performance[J].ActaAgriculturaeBoreali-OccidentalisSinica(西北农业学报),2012,21(1):80-87(in Chinese).
