丹参SmPI1和SmPI2基因克隆及胁迫表达研究
2015-07-04孔维维化文平王喆之
孔维维,化文平,2,王喆之*
(1 药用资源与天然药物化学教育部重点实验室,西北濒危药材资源开发国家工程实验室,陕西师范大学 生命科学学院,西安710062;2 陕西学前师范学院 生物科学与技术系,西安710100)
蛋白酶抑制剂(proteinase inhibitor,PI)是一类能够抑制蛋白水解酶活性的小分子蛋白质,在植物体内广泛存在。PI能与蛋白酶的活性部位和变构部位结合,抑制酶的催化活性或阻止酶原转化为有活性的酶[1],具有防止体内蛋白的不必要降解、调节蛋白代谢及调节蛋白酶的生理活性的功能。此外,PI还可以抑制某些病原微生物及某些昆虫体内蛋白酶,参与植物体的自然防御[2]。目前对PIs的研究主要集中在植物抗性功能方面。根据作用于酶的活性基团的不同及其氨基酸序列的一致性,自然界中蛋白酶抑制剂被分为4类:丝氨酸蛋白酶抑制剂、半胱氨酸蛋白酶抑制剂、金属蛋白酶抑制剂和酸性蛋白酶抑制剂[3],其中丝氨酸蛋白酶抑制剂和巯基蛋白酶抑制剂是在转基因中应用最广泛的两类PI蛋白。自Hilder等[4]将豇豆蛋白酶抑制剂基因转入烟草并获得抗虫转基因植株以来,蛋白酶抑制剂因具有抗虫谱广、害虫不易产生抗体、对人畜无副作用等优点,已成为除Bt杀虫晶体蛋白基因外被广泛用于抗虫工程的第二大类抗性基因。
丹参(Salviamiltiorrhiza)为唇形科鼠尾草属多年生草本植物,以干燥的根及根茎入药,具有活血调经、祛瘀生新、镇静安神、凉血消痈、消肿止痛等功效,临床上被用于治疗冠心病、心绞痛和月经不调等症[5-7]。随着丹参各种药理作用的广泛应用,其需求量也逐渐增加。但在其种植过程中,各种病虫害十分普遍,可造成15%~45%的损失,病虫害成为了影响丹参质量和产量的重要因素[8-9]。
本研究克隆分析了丹参中的2个蛋白酶抑制剂基因SmPI1和SmPI2,并对其在甘蓝黑腐病黄单胞 菌(Xanthomonascampestrispv.Campestris,XC)和茉莉酸甲酯(methyl jasmonate,MeJA)诱导下转录水平变化进行了初步分析,为进一步研究丹参的抗虫抗病机理打下基础。
1 材料和方法
1.1 材 料
丹参(SalviamiltiorrhizaBunge)种子采自陕西天士力植物药业商洛有限公司商州药源基地,于盛有蛭石、草木灰(蛭石∶草木灰=1∶1)的基质中萌发,在人工气候箱内培养(宁波,RXZ-500D),光照强度150μmol·m-2·s-1,光周期为光照16h/黑暗8h,温度(25±2)℃,湿度48%。
RNA 提取试剂盒购自OMEGA 公司;SYBR Green ⅡPremixExTaq、pMD19-T vector和反转录试剂盒均购自TaKaRa生物公司;甘蓝黑腐病黄单胞菌(Xanthomonascampestrispv.Campestris,XC)和大肠杆菌DH5α均由本实验室保存。
1.2 方 法
1.2.1 处理方法 培养60d的丹参幼苗分别用5 mmol/L MeJA 溶液和用生理盐水稀释至OD600=0.2的XC菌液进行喷洒处理。具体处理方法见刘梅等[10]。处理后的丹参幼苗继续放于光照培养箱中培养,并于处理后0、6、12、24、48和72h分别取样,液氮速冻,-80℃保存备用。
1.2.2SmPI1和SmPI2 基因克隆按照植物RNA 提取试剂盒(OMEGA)使用说明书提取不同处理条件下丹参样品总RNA,并用1%琼脂糖凝胶电泳检测RNA 完整性。以总RNA 为模板按照反转录试剂盒PrimeScript? RT reagent Kit(TaKa-Ra)说明书反转录得到cDNA 第一链。cDNA 样品保存于-20℃。
依据本实验室丹参转录组数据库中基因序列(rsmsxl_009845.y1.scf,rsmsxl_012002.y1.scf)采用Premer Premier 5.0软件在完整ORF 框两端设计引物2对(表1),以丹参总RNA 反转录合成的cDNA 为模板,进行PCR 扩增。PCR 程序为95℃预变性3min;95℃变性30s,55℃退火30s,72℃延伸30s,30个循环;72℃延伸10min。扩增产物经凝胶纯化后,连接至pMD19-T vector(TaKaRa)上并转入大肠杆菌DH5α,而后将阳性克隆送北京华大基因科技有限公司进行测序。
1.2.3 SmPI1和SmPI2蛋白生物信息学分析 利用生物信息学数据库和在线软件对SmPI1 和SmPI2蛋白的结构及理化性质进行分析。使用ProtParam tool(http://web.expasy.org/protparam/)工具预测蛋白质分子量、等电点、稳定性等。利用在线工具PSORT Prediction、TMHMM-2.0、SignalP-4.1(http://psort.hgc.jp/form.html/,http://www.cbs.dtu.dk/services/TMHMM-2.0/,http://www.cbs.dtu.dk /services/SignalP/)对SmPI1和SmPI2蛋白的亚细胞定位、跨膜结构域及信号肽进行预测。用在线工具SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(http://swissmodel.expasy.org/)完成蛋白质二级结构和三维结构的分析。多序列比对通过ClustalW 完成。系统进化树使用MEGA 6.0,以最大似然法(Maximum Likelihood,ML),选用最适算法模型WAG+G 构建。

表1 实验所用引物Table 1 The primers used for study
1.2.4 胁迫诱导下SmPI1和SmPI2表达变化
采用Premer Premier 5.0软件,在已知基因序列内部设计实时荧光定量PCR 引物,引物序列见表1。以适宜浓度样品cDNA 为模板进行实时荧光定量PCR 反应,检 测MeJA 和XC诱导下SmPI1 和SmPI2表达量变化。采用丹参持家基因GAPDH作为内参基因。实时荧光定量PCR 反应程序为95℃预变性3 min;95℃10s,60℃30s,共40 个循环。实时荧光定量PCR 结果采用比较Ct法的相对定量[11]进行处理。
2 结果与分析
2.1 SmPI 1和SmPI 2基因克隆
依据丹参转录组数据库基因序列,采用Premer Premier 5.0 软件设计引 物(SmPI1-S、SmPI1-R;SmPI2-S、SmPI2-R),通过PCR 扩增从丹参cDNA中克隆得到了2个蛋白酶抑制剂基因(图1),经测序验证后分别命名为SmPI1 和SmPI2(GenBank登录号分别为EF187459.1和EF187460.1)。
2.2 SmPI 1和SmPI 2的序列分析
利用DNAstar软件对SmPI1和SmPI2 全序列进行分析,发现SmPI1和SmPI2分别含有一个长度为222bp和216bp开放阅读框,分别编码73和71个氨基酸。NCBI 中BLAST分析显示,SmPI1和SmPI2 蛋白与川桑(XP_010094276.1)、可可(XP_007009884.1)、苜蓿(XP_003590799.1)等植物的蛋白酶抑制剂蛋白相似性较高,分别为58%、52%、53%和54%、56%、51%。
丝氨酸蛋白酶抑制剂按照所含有结构域不同可分为Bowman-Birk、Kunitz、马铃薯蛋白酶抑制剂Ⅰ(PI-Ⅰ)和 马铃薯蛋白酶抑制剂Ⅱ(PI-Ⅱ)等家族[12]。其中马铃薯蛋白酶抑制剂(PI-Ⅰ和PI-Ⅱ)是一类创伤诱导型蛋白抑制剂。PI-Ⅰ家族成熟肽分子量约为8kD,只有1个活性中心,主要抑制胰凝乳蛋白酶。PI-Ⅱ家族成熟肽的分子量约为12 kD,有2个活性中心,可以同时抑制胰蛋白酶和胰凝乳蛋白酶[13]。用ScanProsite在线工具预测蛋白结构域发现,丹参SmPI1和SmPI2蛋白N 端存在1个马铃薯蛋白酶抑制剂Ⅰ的特征性保守序列[FYW]-P-[EQH]-[LIV](2)-G-x(2)-[STAGV]-x(2)-A(图2),说明丹参SmPI1和SmPI2蛋白属于马铃薯蛋白酶抑制剂Ⅰ家族成员。用Clustal W 对丹参SmPI1和SmPI2与其他物种中的马铃薯蛋白酶抑制剂I氨基酸序列进行多序列比对发现,马铃薯蛋白酶抑制剂I家族的特征序列保守性很高。
利用SOPMA 程序对SmPI1和SmPI2氨基酸序列的二维结构进行预测发现,SmPI1和SmPI2蛋白二级结构组成十分相似,分别包含α螺旋21.92%和21.13%,无规则卷曲41.10%和36.62%,伸展链20.55%和26.76%,β转角16.44%和15.49%。用SWISS-MODEL在线对丹参SmPI1和SmPI2蛋白三维结构进行预测发现,SmPI1和SmPI2蛋白三维结构与马铃薯蛋白酶抑制剂Ⅰ家族其他成员如水蛭蛋白酶抑制剂(eglinc)、大麦胰凝乳蛋白酶抑制剂2(CI2)、南瓜丝氨酸蛋白酶抑制剂(CMTI-V)等相似,都含有一个反应位点环(reactive-site loop),这个环可以通过与蛋白酶的活性部位结合从而抑制蛋白酶活性。反应位点环通常由9~10个氨基酸残基组成,环中包含一个易断裂位点,即蛋白酶的活性位点[14-17](图3)。比对活性中心发现,在各物种中蛋白酶抑制剂的活性位点氨基酸变化较大。丹参SmPI1和SmPI2的易断裂位点可能为丙氨酸(A50)和精氨酸(R47)。
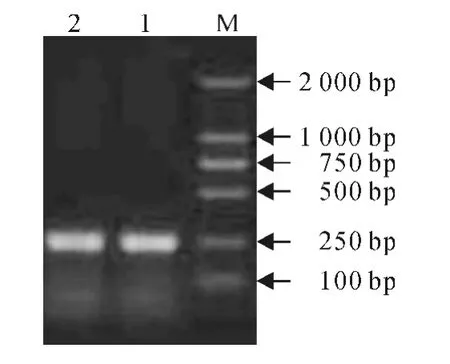
图1 丹参SmPI 1和SmPI 2基因克隆电泳结果Fig.1 Agarose gel electrophoresis of PCR products of the cloned SmPI 1and SmPI 2 M.DL2000;1.SmPI 1;2.SmPI 2
ProtParam tool 预测结果显示:SmPI1 和SmPI2蛋白分子量分别为7.6kD 和7.84kD,为小分子蛋白。理论等电点分别为3.93和4.85,为酸性蛋白。不稳定系数(instability index(Ⅱ))分别为34.79 和26.53,属于稳定蛋白。利用PSORT Prediction对SmPI1 和SmPI2 蛋白进行亚细胞定位预测,结果显示SmPI1 和SmPI2 蛋白都定位于细胞质;用TMHMM-2.0、SignalP-4.1对蛋白质的跨膜结构域和信号肽进行预测显示,SmPI1 和SmPI2蛋白没有跨膜结构域,且无信号肽。据此推测,SmPI1和SmPI2蛋白可能是游离于细胞质中发挥作用。从ML进化树(图4)明显看出,聚类结果分为2支,马铃薯蛋白酶抑制剂Ⅰ和马铃薯蛋白酶抑制剂Ⅱ。在马铃薯蛋白酶抑制剂I家族中,丹参SmPI1与大豆(Glycinemax,NP_001238694.1)亲缘关系最近,而SmPI2 与荞麦(Fagopyrumesculentum,AAB46906.1)亲缘关系最近。

图2 丹参SmPI1和SmPI2与其它马铃薯蛋白酶抑制剂I的序列比对结果Fig.2 Multiple alignment of SmPI1and SmPI2with other protease inhibitors
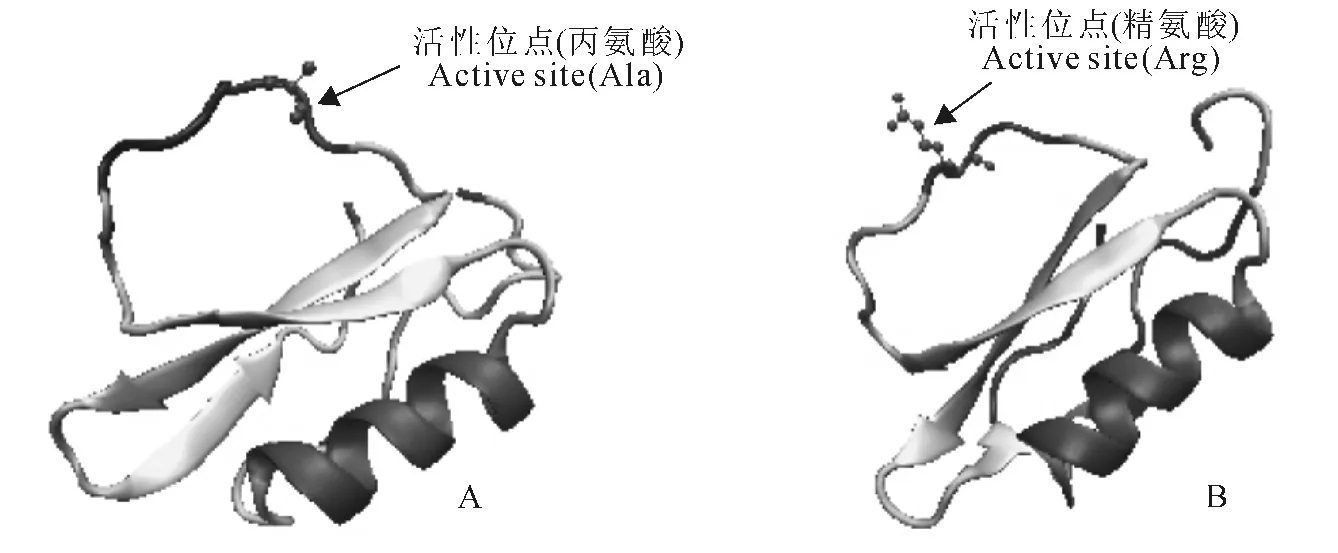
图3 丹参SmPI1(A)和SmPI2(B)蛋白三维结构预测结果Fig.3 Predicted 3Dstructures of SmPI1(A)and SmPI2(B)in S.miltiorrhiza
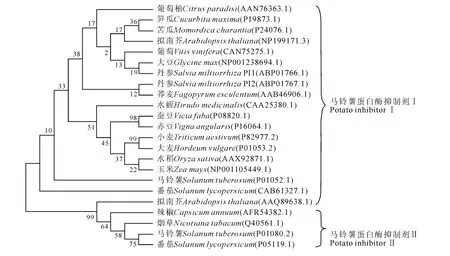
图4 丹参SmPI1和SmPI2蛋白与其它蛋白酶抑制剂系统进化树Fig.4 Phylogenetic analysis of SmPI1and SmPI2protein with other protease inhibitors

图5 MeJA 和XC诱导下SmPI1和SmPI2表达量变化Fig.5 The relative expression of SmPI1and SmPI2responsed to MeJA or XC
2.3 MeJA 和XC 诱导下SmPI 1和SmPI 2的表达变化
马铃薯蛋白酶抑制剂是一类创伤诱导型表达的蛋白酶抑制剂[13]。马铃薯和番茄蛋白酶抑制剂Ⅰ和Ⅱ在植株受到机械损伤或昆虫伤害后都会在叶片中大量积累[18-19]。为了探究丹参蛋白酶抑制剂SmPI1和SmPI2 对损伤的响应,用逆境信号分子MeJA 和植物病原菌XC 分别对丹参幼苗进行了处理。实时荧光定量PCR 结果(图5)显示,在MeJA和XC诱导下,SmPI1 和SmPI2 的表达量都在处理后6h达到峰值,之后逐渐恢复至初始水平,说明该基因受到植物激素MeJA 和病原菌XC的诱导。
3 讨 论
马铃薯蛋白酶抑制剂I家族的大部分成员都来自于植物,而且其众多成员普遍与植物的抗逆性相关。Dunse等[20]研究表明,在棉花中共表达马铃薯蛋白酶抑制剂Ⅰ和Ⅱ可以显著增强棉花对昆虫伤害的抵抗力。在番茄中,蛋白酶抑制剂Ⅰ和Ⅱ会在未成熟的果实中大量积累,以抵御昆虫、鸟类等的伤害;在果实成熟后迅速消失使果实可食用,从而促进种子的传播[21]。在遭受机械损伤后,番茄蛋白酶抑制剂Ⅰ和Ⅱ在叶片的积累也会显著增加[22-24]。丹参蛋白酶抑制剂SmPI1和SmPI2作为马铃薯蛋白酶抑制剂Ⅰ家族成员,可能同其他成员一样在植物抵御损伤、病虫害等方面发挥作用。
茉莉酸类是与植物抗性密切相关的内源信号分子,参与损伤、病虫害、干旱和低温等条件下的多种抗逆反应,也是环境胁迫中驱动植物防御基因表达的重要信号分子[25-26]。在创伤、昆虫或病菌攻击时,植物体内内源茉莉酸类物质含量会急剧上升[27-28]。茉莉酸类物质含量的增加会促进一些与环境胁迫相关物质的合成,并且诱导植物防御基因的表达[29]。本研究发现茉莉酸甲酯和植物病原菌XC 都可以迅速诱导丹参蛋白酶抑制剂SmPI1 和SmPI2 的表达,与番茄蛋白酶抑制剂Ⅰ对损伤的响应相似[24],说明丹参蛋白酶抑制剂SmPI1和SmPI2与丹参的抗性密切相关。推测病原菌XC 伤害可能是通过信号分子MeJA 的传导来最终诱导蛋白酶抑制剂基因的表达。本研究为进一步研究丹参蛋白酶抑制剂的抗虫抗病机理奠定了基础,为生产中增强丹参以及其他农作物的抗逆性,培育优良品系,增加产量有重要的指导意义。
[1]RYAN C A.Proteolytic enzymes and their inhibitors in plants[J].Annu.Rev.PlantPhysiol.,1973,24:173-196.
[2]CHENG ZH Y(程仲毅),XUE Q ZH(薛庆中).The structure and regulation of plant proteinase inhibitor genes and their strategy in pest control[J].ActaGeneticaSinica(遗传学报),2003,30(8):790-796(in Chinese).
[3]ZHANG L(张 莉),WANG D F(汪东风),ZHANG B(张 宾),etal.Advances in the study of protease inhibitors from leguminous plants[J].SoybeanScience(大豆科学),2006,25(3):314-319(in Chinese).
[4]HILDER V A,GATEHOUSE A M R,SHEERMAN S E,etal.A novel mechanism of insect resistance engineered into tobacco[J].Nature,1987,330(6 144):160-163.
[5]WANG B Y(王冰瑶),WU X Y(吴晓燕),FAN G W(樊官伟).Pharmacologic mechanism for protective effects of danshensu on cardiovascular system[J].ChineseTraditionalandHerbalDrugs(中草药),2014,45(17):2 571-2 575(in Chinese).
[6]LUO C L(罗彩莲).The pharmacological effects and clinical application of theSalvia[J].ChinaModernMedicine(中国当代医药),2012,19(12):11-12(in Chinese).
[7]LI Q Y(李巧玉),LIU Y(刘 杨),BAO H Y(包华音).Progress on pharmaceutical effects and chemical constituents ofSalviamiltiorrhizain recent five years[J].FoodandDrug(食品与药品),2014,16(2):145-146(in Chinese).
[8]WEN J F(文家富).Investigation and integrated management for main diseases and insect pests onSalviamiltiorrhizain Shangluo[J].ShaanxiJournalofAgriculturalSciences(陕西农业科学),2009,55(1):210-211(in Chinese).
[9]ZHAO K(赵 魁),GUO X H(郭晓恒),SONG J(宋 杰),etal.The present production situation investigation and analysis ofSalvia miltiorrhiza[J].LishizhenMedicineandMateriaMedicaResearch(时珍国医国药),2010,21(9):2 307-2 310(in Chinese).
[10]LIU M(刘 梅),SHENG H(生 华),HUA W P(化文平),etal.Cloning and expression analysis of a non-specific lipid transfer protein gene(SmLTP1)fromSalviamiltiorrhizaBunge[J].PlantPhysiologyJournal(植物生理学报),2011,47(1):63-68(in Chinese).
[11]VANDESOMPELE J,DE PRETER K,PATTYN F,etal.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].GenomeBiology,2002,3(7):34-45.
[12]卜庆云.马铃薯蛋白酶抑制剂Ⅱ基因PINⅡ2x的克隆及其转化水稻的研究[D].南京:南京农业大学,2005.
[13]LIU W G(柳武革),XUE Q ZH(薛庆中).Proteinase inhibitors and their application in insect-resistant gene engineering[J].BiotechnologyBulletin(生物技术通报),2000,(1):23-28(in Chinese).
[14]BODE W,PAPAMOKOS E,MUSIL D.The high-resolution X-ray crystal structure of the complex formed between subtilisin Carlsberg and eglin c,an elastase inhibitor from the leechHirudomedicinalis[J].TheJournalofBiologicalChemistry,1987,166(3):673-692.
[15]WHITLEY M J,LEE A L.Exploring the role of structure and dynamics in the function of chymotrypsin inhibitor 2[J].Proteins,2011,79(3):916-924.
[16]LIU J,GONG Y,PRAKASH O,etal.NMR studies of internal dynamics of serine proteinase protein inhibitors:Binding region mobilities of intact and reactive-site hydrolyzedCucurbitamaximatrypsin inhibitor(CMT1)-Ⅲof the squash family and comparison with those of counterparts of CMTI-V of the potato I family[J].ProteinScience,1998,7(1):132-141.
[17]OGATA F,MIYATA T,FUJII N,etal.Purification and amino acid sequence of a bitter gourd inhibitor against an acidic amino acid-specific endopeptidase ofStreptomycesgriseus[J].TheJournalofBiologicalChemistry,1991,266(25):16 715-16 721.
[18]GREEN T R,RYAN C A.Wound-induced proteinase inhibitor in plant leaves:apossible defense mechanism against insects[J].Science,1972,175(4 023):776-777.
[19]GREEN T R,RYAN C A.Wound-induced proteinase inhibitor in tomato leaves:some effects of light and temperature on the wound response[J].PlantPhysiol.,1973,51(1):19-21.
[20]DUNSE K M,STEVENS J A,LAY F T,etal.Coexpression of potato typeⅠandⅡproteinase inhibitors gives cotton plants protection against insect damage in the field[J].PNAS,2010,107(34):15 011-15 015.
[21]PEARCE G,RYAN C A,LILJEGREN D.Proteinase inhibitors Ⅰand Ⅱin fruit of wild tomato species:Transient components of a mechanism for defense and seed dispersal[J].Planta,1988,175(4):527-531.
[22]JOHNSON R,NARVAEZ J,AN G,etal.Expression of proteinase inhibitorsⅠand Ⅱin transgenic tobacco plants:Effects on natural defense againstManducasextalarvae[J].PNAS,1989,86(24):9 871-9 875.
[23]WALKER-SIMMONS M,RYAN C A.Immunological identification of proteinase inhibitorsⅠandⅡin isolated tomato leaf vacuoles[J].PlantPhysiol.,1977,60(1):61-63.
[24]GRAHAM J S,HALL G,PEARCE G,etal.Regulation of synthesis of proteinase inhibitorsⅠandⅡmRNAs in leaves of wounded tomato plants[J].Planta,1986,169(3):399-405.
[25]吴福安,余茂德,程嘉翎.植物诱导抗性的重要信号分子:茉莉酸类[C]//中国蚕学会第五次全国桑保学术研讨会论文集,2004:118-124.
[26]CAI K ZH(蔡昆争),DONG T X(董桃杏),XU T(徐 涛).The physiological roles and resistance control in stress environment of jasmonates[J].EcologyandEnvironment(生态环境),2006,15(2):397-404(in Chinese).
[27]MITHÖFER A,REICHELT M,NAKAMURA Y.Wound and insect-induced jasmonate accumulation in carnivorousDroseracapensis:two sides of the same coin[J].PlantBiology,2014,16(5):982-987.
[28]SHI Y X(石延霞),YU Y(于 洋),FU J F(傅俊范)etal.Relationship between LOX activity and JA accumulations in cucumber leaves induced by pathogen[J].ActaPhytophylacicaSinica(植物保护学报),2008,35(6):486-490(in Chinese).
[29]XU W(徐 伟),YAN SH CH(严善春).The function of jasmonic acid in induced plant defence[J].ActaEcologicaSinica(生态学报),2005,25(8):2 074-2 082(in Chinese).
