缺铁胁迫对梨叶片中GA信号转导相关基因的影响
2015-07-04何家轩朱立武
丁 伟,周 葱,刘 超,何家轩,贾 兵,朱立武
(安徽农业大学 园艺学院,合肥230036)
赤霉素(gibberellins acid,GA)是一类存在于植物整个生命周期的内源激素,调控植物的生长发育过程。GA 可促进细胞分裂和伸长,诱导开花,打破植物休眠,促进雌花分化,增强细胞内生长素IAA水平从而促进养分积累,促进某些梨树座果和单性结实,延缓叶片衰老等[1-2]。GA2-氧化酶(GA2-oxidase,GA2ox)是GA 合成过程中关键调控酶,以2-酮戊二酸和氧分子为底物、Fe2+和抗坏血酸为辅助因子的双加氧酶,在GA 合成过程中,将活性GA 氧化为无活性GA,维持着植物体内生物活性GA 和无活性GA 的平衡,受GA 正反馈调节[3-4]。
DELLA蛋白是一类C 端非常保守、N 端含有Asp-Glu-Leu-Leu-Ala结构域的蛋白质家族。DELLA 蛋白定位于细胞核内,与某种转录因子结合,对基因转录起阻遏作用,抑制赤霉素效应,间接或直接调节GA 响应基因的转录[5]。Fu等[6-9]发现DELLA 蛋白对赤霉素、茉莉酸、脱落酸、乙烯和生长素等多种激素的信号转导过程都有抑制作用,抑制植物的发育;Achard等[10]研究拟南芥DELLA 蛋白在植物激素处理和逆境胁迫下的变化,结果发现DELLA 蛋白可以实时调节植物生长以响应外界环境变化,以此提高植物的抗逆性。
GID1(gibberellin insensitive dwarf)是一种GA 受体,定位于细胞核内,是一种可溶性受体[11]。GID1与活性GA 结合形成GA-GID1二聚体,二聚体上N端构象发生改变,易于同DELLA 蛋白连接,形成GA-GID1-DELLA三聚体,然后SCF 聚合体标记该三聚合体,诱导泛素26S蛋白酶体降解DELLA 蛋白,解除DELLA 蛋白对基因转录的阻遏作用,产生“赤霉素效应”[12-14]。
‘砀山酥梨’种植面积约占中国梨栽培面积的1/4,其主产区在西北和黄河故道地区。该地区梨园缺铁现象严重影响了梨品质和产量的提高[15-16]。Romheld等[17]研究发现,缺铁胁迫导致向日葵根系的IAA 含量显著提高,Li等[18]用IBA 或IAA 处理正常供铁植物,发现能诱导类似植物的高铁还原酶的活性。Romera[19]将乙烯合成前体ACC 加入缺铁植株后,显著促进高铁还原酶活性和根毛发育。Graziano[20]则研究了NO 对植物缺铁的调控,发现NO 能促进缺铁条件下植株的各种缺铁响应,但是不能诱导正常供铁植株产生缺铁相关的反应。
关于缺铁条件下GA 含量变化及其信号转导相关基因表达研究目前尚未见报道。试验以‘砀山酥梨’组织培养试管苗叶片为试材,测定不同程度缺铁胁迫下叶片内源GA 含量;采用RT-PCR 技术,分析GA 信号转导相关基因GA2ox、受体蛋白GID1的4个等位基因和DELLA 蛋白4个等位基因相对表达量变化;研究缺铁胁迫下梨叶片GA 水平和相关信号转导基因的关系,探讨GA 及其转导基因在梨树缺铁胁迫下的作用。
1 材料和方法
1.1 材 料
参考Pestana M 设计[21],将‘砀山酥梨’组培生根苗移植至MS培养基,其中不含铁元素,Fe2+浓度另设4个处理水平。Fe40:添加40μmol/L Fe-EDTA;Fe20:添加20μmol/L Fe-EDTA;Fe10:添加10μmol/L Fe-EDTA;Fe0:不添加Fe-EDTA。处理的苗木置于光照培养箱中,培养温度(白天/夜晚)25℃/20℃,光照时间每天15h,光照度2 100lx,相对湿度70%,培养28d后,Fe40叶片表现正常,Fe20叶片黄化不明显,Fe10 叶边缘出现明显的失绿,Fe0叶片黄化严重,呈黄白色(图1)。将不同处理叶片用液氮处理后,置于-80℃冰箱中保存备用[22]。
1.2 方 法
1.2.1 GA 含量测定 应用酶联免疫检测法ELISA(Enzyme-Linked ImmunoSorbent Assay)测定叶片中GA 含量[23]。

图1 不同铁离子含量培养基中叶片黄化症状程度Fig.1 Leaf with symptom of iron-deficiency at MS medium at different iron concentrations
1.2.2 总RNA提取与GA2ox基因克隆 总RNA提取使用StarSpin Plant RNA Mini Kit试剂盒(购自Genstar公司),cDNA合成使用M-MLV RTase cDNA Synthesis Kit(购自大连宝生物工程有限公司)。通过NCBI查找GA2ox基因的同源序列,根据同源序列的保守区域设计引物,进行PCR 扩增,将扩增得到的特异片段回收,送到上海生工生物工程公司进行测序,获得GA2ox基因的保守序列。根据保守序列按照TaKaRa宝生物工程(大连)有限公司的3′-Full RACE Core Set with Prime ScriptTMRtase和5′-Full RACE Kit with Tap试剂盒设计引物进行扩增。PCR 扩增条件为94℃预变性10 min;94℃变性30s;52℃退火45s,72℃延伸1 min,共进行35个循环;72℃延伸10min。
1.2.3 实时荧光定量PCR 提取不同程度缺铁叶片的总RNA,经反转录获得mRNA 第一链。根据获得的GA2ox全长序列,以及从梨基因组数据库中得到GID1 的4 个等位基因为GID11(登录号Pbr006571.1)、GID13(登录号Pbr041942.1)、GID15(登录号Pbr019693.1)和GID16(登录号Pbr029795.1),DELLA蛋白4个等位基因DELLA1(登 录 号Pbr037895.1)、DELLA2(登 录 号Pbr040316.1)、DELLA4(登录号Pbr004513.1)和DELLA6(登录号Pbr037896.1)(http://peargenome.njau.edu.cn:8004/default.asp?d=4&m=2),使用Premier 5.0软件设计荧光定量PCR 引物(表1)。使用ABI STEPONE荧光定量PCR仪和Takara 公司SYBR?PremixExTaqTMⅡ(Tli RNaseH Plus)试剂进行荧光定量PCR 分析,采用20μL 反应体系:SYBRTMPremixExTaq10μL,正、反向引物(10 μmol·L-1)各0.8μL,荧光染料0.4μL,cDNA 模板1μL,ddH2O 7.0μL。反应程序为95℃预变性30s,95℃变性5s,60℃退火30s,共40个循环,每个样品4次重复。以GAPDH基因作为内参,使用2-△△Ct法求待测样品相对表达量。

表1 所用引物序列Table 1 The sequences of the primers used in the experiment
1.2.4 数据分析 利用SPSS 17.0软件对叶片中GA 含量、基因相对表达量差异进行分析。
2 结果与分析
2.1 不同程度缺铁叶片中GA 含量
各处理苗木培养28d后,Fe40叶片表现正常,Fe20 叶片黄化不明显,其GA 含量分别为7.29 ng/g和8.13ng/g,两者差异不显著。Fe10仅叶缘出现明显黄化,GA 含量显著高于Fe40与Fe20处理;而未添加Fe-EDTA 的叶片黄化严重,GA 含量也显著高于Fe10处理。由此可见,叶片内源GA 水平受到缺铁胁迫的影响,随着植株缺铁程度加重,叶片GA 含量增加(图2)。
2.2 GA 2ox 基因的克隆
对GA 氧化酶基因GA2ox进行克隆,首先得到保守序列,该扩增片段大小为576bp;将此序列在NCBI上进行BLASTn比对,结果它与西洋梨(登录号JF441168)的GA2ox最接近,一致性达到99%。3′-RACE扩增片段大小为536bp,比对结果与苹果(登录号FJ571521)的GA2ox基因一致性最大,达到97%;5′-RACE 扩增片段大小为585bp,与苹果(登录号FJ571521)的GA2ox基因一致性达到99%(图3)。
将2个片段拼接得到编码区全长1 014bp的基因,在NCBI上比对,发现与西洋梨的GA2ox(登录号JF441168)基因一致性达到99%。依据上述特征判断,本研究获得了‘砀山酥梨’GA2ox(登录号KJ008976)基因完整cDNA 全长序列,共含337 个氨基酸序列。
2.3 不同程度缺铁叶片中GA 2ox 基因差异表达分析
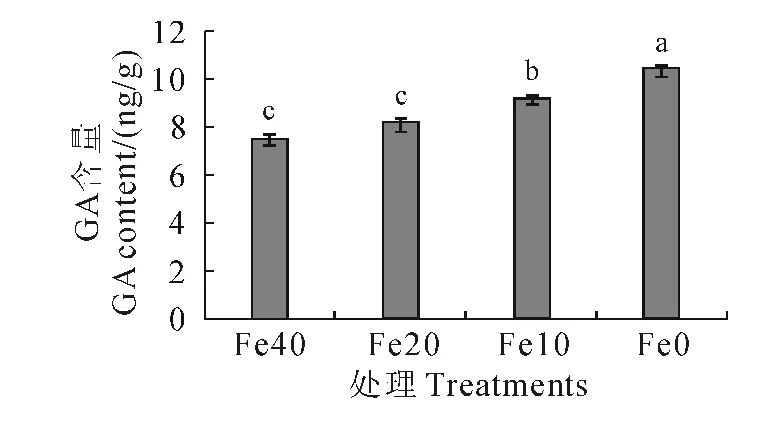
图2 不同缺铁处理叶片中内源GA 含量Fig.2 The endogenous GA content in leaves of different iron-deficiency treatment
Fe20处理的GA2ox基因相对表达量显著高于Fe40;Fe10和未添加Fe-EDTA的GA2ox基因相对表达量与Fe40 处理无显著差异。与正常植株相比,轻度的缺铁胁迫会使叶片GA2ox基因表达量增加;中度或重度缺铁时,GA2ox基因表达量并未呈现出显著差异(图4)。由此可见,缺铁胁迫并不一定能促进活性GA 向无活性GA 转化。
2.4 不同程度缺铁叶片中GA 受体GID1 等位基因表达分析
在不同程度缺铁叶片间,GID11 和GID13 的相对表达量均达到显著差异;而GID15 和GID16基因在Fe40和Fe20处理中相对表达量无显著性差异,随着缺铁程度的加重,两者相对表达量均显著高于Fe40处理(图5)。
相关分析结果显示,GA 含量与GA 受体蛋白GID1的4个等位基因相对表达量呈正相关,相关关系均达到显著水平,相关系数分别为0.987 6、0.987 6、0.982 4和0.983 9。
2.5 不同程度缺铁叶片中DELLA 蛋白等位基因表达
DELLA 蛋白的4个等位基因中,仅DELLA6在不同缺铁程度叶片间相对表达量差异不显著。DELLA1 在Fe20 与Fe10 处理中差异不显著;DELLA2在Fe10与Fe0、Fe40与Fe20处理中差异不显著;而DELLA4在Fe40、Fe20和Fe10处理中相对表达量无显著差异(图6)。

图3 GA2ox 基因cDNA 序列扩增Fig.3 Amplification of cDNA sequence of GA2oxgene

图4 不同缺铁处理叶片中GA 2ox 基因相对表达量Fig.4 Relative expression level of GA 2ox gene in leaves with iron-deficiency at different degrees
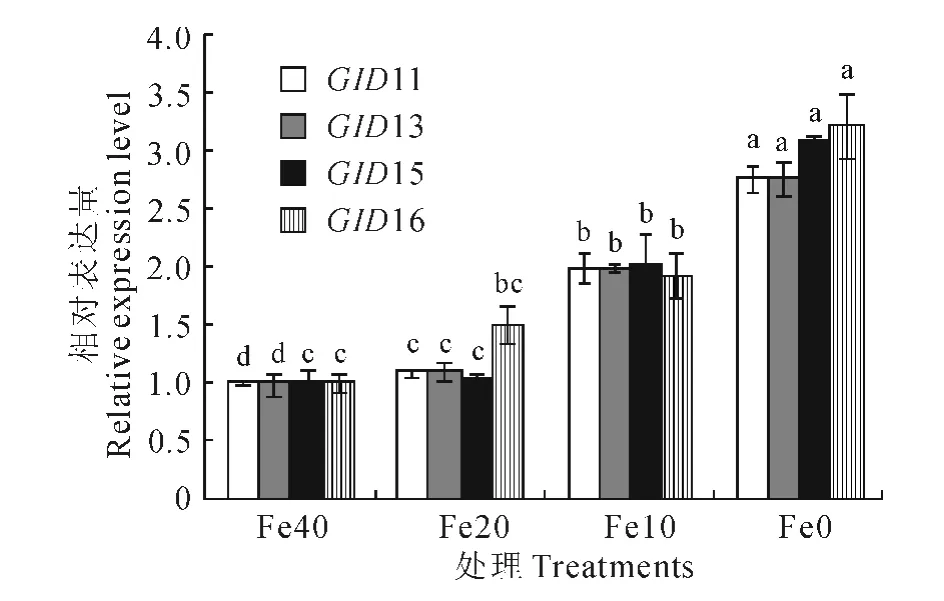
图5 不同缺铁处理对叶片中GID1等位基因相对表达量的影响Fig.5 Relative expression level of GID1alleles in leaves with iron-deficiency at different degrees
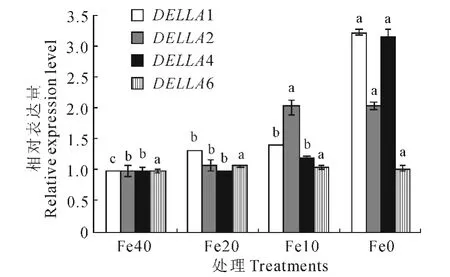
图6 缺铁处理对叶片中DELLA 蛋白等位基因相对表达量的影响Fig.6 Effect of the different iron-deficiency on the relative expression quantity of DELLA protein gene alleles
与DELLA 蛋白的其他3 个等位基因相比,DELLA1随着缺铁程度加重,相对表达量逐渐增加,说明DELLA1基因对缺铁胁迫比较敏感。
3 讨 论
3.1 缺铁胁迫条件下GA 的作用及与GA 2ox 基因的关系
梨树缺铁症状首先出现在幼叶上,轻者叶片边缘失绿黄化,重者整个叶片黄化,直至叶片全部变为黄白色、出现褐色锈斑且叶缘枯焦,引起叶片脱落,致使枝条枯死,甚至植株死亡[24]。Zhou等[25]发现GA 可以延缓叶片中叶绿素降解、缓解失绿;Lers等[26]研究认为GA 可以延缓蛋白质和RNA 的分解,延迟叶片衰老。
GA2ox基因是调控GA 分解的关键酶,它可以促进活性GA 转化为无活性GA。但是本试验发现,叶片内源GA 水平随着植株缺铁程度加重而增加,而GA2ox基因表达量并未随之上升。表明缺铁胁迫条件下,叶片中GA 的总量是增加,可能是缺铁诱导了内源GA 合成。在缺铁胁迫下,通过外源GA的应用是否能增加梨抗缺铁能力有待进一步研究。
3.2 缺铁胁迫叶片中GA 信号转导
本试验结果显示,GID1作为GA 的受体,在重度缺铁处理叶片中,其4个等位基因表达量均显著上调,与内源GA 含量显著上升相一致,使GA 与GID1结合成二聚体的数量增加。形成的GA-GID1二聚体,再同DELLA 蛋白连接,成为GA-GID1-DELLA 三聚体,然后激活泛素26S 蛋白酶降解DELLA 蛋白,解除DELLA 蛋白对生长的抑制作用,进而产生“赤霉素效应”。
Cao等[27]研究表明,DELLA 蛋白反向调控GA信号途径。但是,本试验中DELLA基因表达水平并没有随着内源GA 含量增加而降低。缺铁胁迫同时诱导了梨叶片内源GA 合成和DELLA 蛋白基因的表达,其中的调控机制尚有待进一步深入研究。
[1]DAVIES P J.Plant Hormones:Physiology,Biochemistry,and Molecular Biology[M].Kluwer Academic,1995:25-31.
[2]YAMAGUCHI S,SMITH M W,BROWN R G,etal.Phytochrome regulation and differential expression of gibberellin 3beta-hydroxylase genes in germinatingArabidopsisseeds[J].ThePlantCell,1998,10(12):2 115-2 126.
[3]ZHOU B,PENG D,LIN J ZH,etal.Heterologous expression of a gibberellin 2-oxidase gene fromArabidopsisthalianaenhanced the photosynthesis capacity inBrassicanapusL.[J].JournalofPlantBiology,2011,54(1):23-32.
[4]程飞飞.矮生梨‘中矮1号’GA2-oxidase基因的克隆与功能分析[D].北京:中国农业科学院,2012.
[5]PESTANA M,HARDTKE CH S.Hormone signalling crosstalk in plant growth regulation[J].CurrentBiology:CB,2011,21(9):365-373.
[6]FU X D,HARBERD N P.Auxin promotesArabidopsisroot growth by modulating gibberellin response[J].Nature,2003,421(6 924):740-743.
[7]HOU X L,LEE L Y,XIA K,etal.DELLAs modulate jasmonate signaling via competitive binding to JAZs[J].DevelopmentalCell,2010,19(6):884-894.
[8]ACHARD P,VRIEZEN W H,VAN D S,etal.Ethylene regulatesArabidopsisdevelopment via the modulation of DELLA protein growth repressor function[J].ThePlantCell,2003,15(12):2 816-2 825.
[9]LAWIT S J,WYCH H M,XU D,etal.Maize DELLA proteins dwarf plant 8and dwarf plant 9as modulators of plant development[J].Plant&CellPhysiology,2010,51(11):1 854-1 868.
[10]ACHARD P,CHENG H,DE G L,etal.Integration of plant responses to environmentally activated phytohormonal signals[J].Science(New York,N.Y.),2006,311(5 757):91-94.
[11]UEGUCHI-TANAKA M,ASHIKARI M,NAKAJIMA M,etal.Gibberellin insensitiveDwarf1encodes a soluble receptor for gibberellin[J].Nature,2005,437(7 059):693-698.
[12]ZENTELLA R,ZHANG Z L,PARK M,etal.Global analysis of DELLA direct targets in early gibberellin signaling inArabidopsis[J].ThePlantCell,2007,19(10):3 037-3 057.
[13]CHEN M X,MAODEKA A,ZHOU L H,etal.Removal of DELLA repression promotes leaf senescence inArabidopsis[J].PlantScience,2014,219:26-34.
[14]FU X D,RICHARDS D E,BARBARA F,etal.TheArabidopsismutant sleepy1gar2-1protein promotes plant growth by increasing the affinity of the SCFSLY1E3ubiquitin ligase for DELLA protein substrates[J].ThePlantCell,2004,16(6):1 406-1 418.
[15]ZHOU H J(周厚基),TONG Y A(仝月澳).Studies of iron chlorosis in apple plants.Ⅱ.The influence of iron stress on the morphological,physiological and biochemical changes in apple[J].ScientiaAgriculturaSinica(中国农业科学),1988,21(4):46-50(in Chinese).
[16]SU J(苏 军),ZHONG CH(钟 晨),DING W(丁 伟),etal.Expression of auxin-repressed protein gene in‘Dangshansuli’pear leaves with different degrees of iron-dificiency[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2013,33(2):240-246(in Chinese).
[17]ROMHELD V,MARSCHNER H.Mobilization of iron in the rhizosphere of different plant species[J].AdvancesinPlantNutrition,1986,2:155-204.
[18]SAUERBREY E,GROSSMANN K,JUNG J.Is ethylene involved in the regulation of growth of sunflower cell suspension cultures?[J].JournalofPlantPhysiology,1987,127(5):471-479.
[19]ROMERA F J,ALC N E.Ethylene involvement in the regulation of Fe-deficiency stress responses by strategy I plants[J].Functional PlantBiology,2004,31(4):315-328.
[20]GRAZIANO M,LAMATTINA L.Nitric oxide accumulation is required for molecular and physiological responses to iron deficiency in tomato roots[J].ThePlantJournal,2007,52(5):949-960.
[21]PESTANA M,PEDRO J C,MANUELA D,etal.Response of five citrus rootstocks to iron deficiency[J].JournalofPlantNutrition andSoilScience,2011,174(5):837-846.
[22]LI D D,WANG Y,HAN ZH H,etal.Studies on propagation tissue culture inPyrusbetulifoliaBung by applying orthogonal design[J].NorthernHorticulture,2009,1(5):47-48.
[23]HUANG SH B(黄少白),ZHOU X(周 燮).The development of GA1,3,4,7ELLSA[J].ActaAgriculturaeBoreali-Sinica(华 北 农 学报),1993,8(4):46-51(in Chinese).
[24]YE ZH F(叶振风),ZHU L W(朱立武),ZHANG SH M(张水明),etal.The reason,symptom and it’s correct of iron-deficiency in‘Dangshansuli’[J].YantaiFruit(烟台果树),2012,(2):36-37(in Chinese).
[25]ZHOU X J(周相娟),JIANG W B(姜微波),HU X S(胡小松),etal.The influence of gibberellic acid and ethylene on the senescence of coriander leaf[J].NorthernHorticulture(北方园艺),2003,(3):54-56(in Chinese).
[26]LERS A,JIANG W B,LOMANIEC E,etal.Gibberellic acid and CO2additive effect in retarding postharvest senescence of parsley[J].FoodScience,1998,63(1):66-68.
[27]CAO D N,HUSSAIN A,CHENG H,etal.Loss of function of fourDELLAgenes leads to light and gibberellin-independent seed germination inArabidopsis[J].Planta,2005,223(1):105-113.
