CYP2C9、VKORC1基因多态性与华法林个体化用药研究进展
2015-06-28刘跃平杨翔徐含青李永川李明黄庆府伟灵
刘跃平,杨翔,徐含青,李永川,李明,黄庆,府伟灵
CYP2C9、VKORC1基因多态性与华法林个体化用药研究进展
刘跃平,杨翔,徐含青,李永川,李明,黄庆,府伟灵
尽管具有治疗指数狭窄和出血并发症频繁的弊病,华法林仍是临床上应用非常广泛的口服抗凝血药物。不同患者对华法林的反应差异很大,在达到相同治疗效果的情况下,不同个体的用药剂量可能相差20倍之多。华法林的治疗剂量受多种因素影响,包括基因多态性、体重指数、年龄等及其他药物因素等,这就要求临床医师在应用华法林时需注重个体化用药及选择最优治疗方案。多种基因可影响华法林的药物代谢,其中细胞色素P450 2C9(CYP2C9)及维生素K环氧化物还原酶复合体1(VKORC1)基因多态性是目前研究的重点。本文将综述以上两个基因的基因多态性及其与华法林个体化用药相关性的研究进展。
细胞色素P450 CYP2C9;维生素K环氧化物还原酶复合体1;遗传药理学;华法林;个体化医学;多态性,单核苷酸
华法林是当今抗凝治疗的首选药,主要用于机械心脏瓣膜置换术术后、非瓣膜性心房颤动以及深静脉血栓等患者的抗凝治疗[1-3]。华法林的缺点在于其治疗指数狭窄,剂量个体差异大,即使同一个个体在不同时期所需的剂量也可能不同[4]。华法林的剂量受多种因素影响,如遗传基因多态性、体重指数、年龄等及其他药物因素等[5]。自关于基因多态性与华法林剂量的关系报道以来,华法林的个体化用药研究逐渐集中在与药物代谢有关的基因上,如细胞色素P450 2C9 (cytochromeP450 2C9,CYP2C9)基因、维生素K环氧化物还原酶复合体1(vitamin K epoxide reductase complex subunit 1,VKORC1)、细胞色素P450 4F2(cytochromeP450 4F2,CYP4F2)、γ-谷氨酰胺羧化酶(gamma-glutamylcarboxylase,GGCX)和钙腔蛋白(calumenin,CALU)基因,其他还有环氧化物水解酶(epoxide hydrolase,EPHX1)、载脂蛋白E(apolipoprotein E,apoE)基因等[1],其中CYP2C9、VKORC1基因多态性已成为近年研究的重点。一项针对197例心脏机械瓣膜置换术后中国汉族患者VKORC1、CYP2C9、CYP4F2和EPHX1基因多态性对华法林剂量影响的研究表明:VKORC11639G>A、CYP2C9 1075A>C(CYP2C9*3)、EPHX1 rs2292566、CYP4F2 rs2108622基因多态性以及体重和年龄分别解释了30.2%、7.0%、2.8%、3.6%、1.9%和1.7%的华法林个体剂量差异[6]。
1 华法林的抗凝机制及药代动力学
华法林是20世纪40年代美国Wisconsin大学合成的香豆素类口服抗凝血药,通过特异性抑制维生素K环氧化物还原酶(vitamin K epoxide reductase,VKOR)的催化反应而发挥抗凝作用,VKOR主要由VKORC1基因编码[7-9]。VKOR能够催化维生素K的环氧化物转化为还原型维生素K,还原型维生素K是GGCX的必要辅助因子。不具活性的凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ前体和蛋白质C、S、Z前体在GGCX的作用下转化为具有活性的凝血因子和蛋白质,进而发生一系列级联反应,引起血液凝固(图1)。
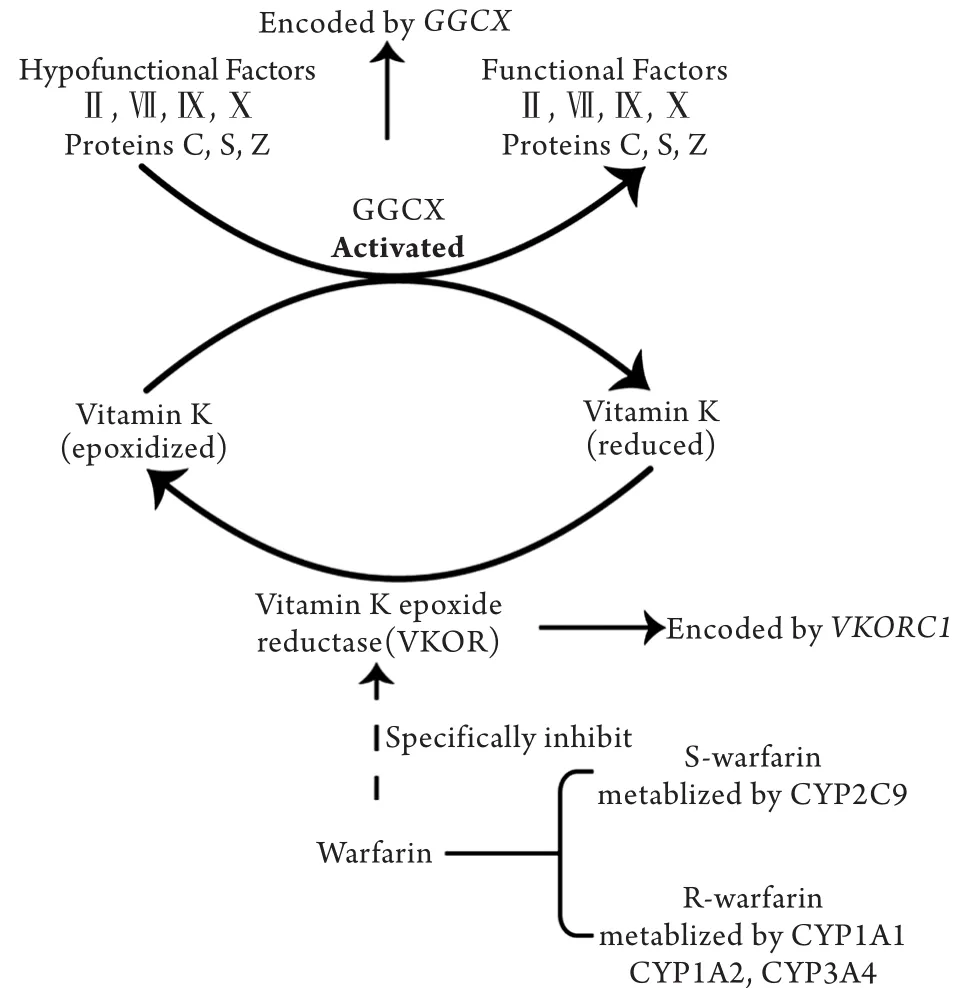
图1 华法林的抗凝机制及代谢示意图Fig.1 Schematic representation of warfarin metabolism and its mechanism of action
华法林口服生物利用度高,口服后很快被肠道吸收,90min后血药浓度达到高峰。半衰期为36~42h,在血浆中主要与白蛋白结合,结合率为90%。用药后20~30h起效,停药后作用可持续4~5d[10]。临床使用的华法林是消旋酸光学异构体的混合物,其中S型华法林的效能是R型华法林的3~5倍,S型华法林占据了华法林效应的60%~70%[11]。这两种华法林都是在肝脏中被清除且清除率均较低。CYP2C9仅负责药理活性更强的S型华法林的代谢。R型华法林虽然活性低,但代谢却十分活跃,可以通过CYP1A2、CYP1A2、CYP3A4和酮还原酶在肝脏中进行代谢。因此,仅仅一种酶的变化对R型华法林的代谢影响很小,大多数情况下,R型华法林在华法林所引起的出血并发症中所占比例极小。S型华法林的主要代谢产物是S-7羟基-华法林,另外还有少量的S-6-羟基-华法林。这些反应都是由CYP2C9来介导的。
2 CYP2C9和VOKRC1基因的结构及突变类型
2.1 CYP2C9基因结构及突变类型 人体内代谢药物的酶主要是细胞色素P450超家族(cytochrome P450,CYP),它们是一类主要存在于肝脏、肠道中的单加氧酶,多位于细胞内质网上,催化多种内、外源物质包括大多数临床药物的代谢[12]。CYP2C亚家族是一类重要的药物代谢酶,占肝微粒体CYP蛋白总量的18%,催化大约20% CYP介导代谢的临床药物[13]。CYP2C9同工酶主要氧化代谢一些应用较为广泛的临床药物,包括苯妥因(phenytoin)、华法林(S-warfarin)、甲苯磺丁脲(tolbutamide)、非甾体抗炎药(NSAIDS)、氯沙坦(losartan)、托拉塞米(torasemide)等100余种药物[14]。在这些药物中,一些治疗指数狭窄的药物代谢受到更多关注,如华法林、甲苯磺丁脲和苯妥因,因为CYP2C9代谢活性受损可能影响药物在体内的实际含量,甚至可能造成中毒。CYP2C9具有表型和基因型多态性,且其表型和基因型多态性与治疗指数狭窄的华法林类药物的疗效及毒副作用密切相关。
编码CYP2C9蛋白的基因(Gene ID:1559,NG_008385.1)位于10号染色体长臂(10q24.2),全长约为50kb,包含9个外显子和8个内含子,可读框长度为1472bp。酶代谢活性的降低或缺失与CYP2C9基因的突变密切相关。CYP2C9基因的多态性主要取决于编码区的单核苷酸多态性(SNPs)[15]。SNPs是指人类基因组中存在的单个核苷酸变异,是一个具有高度稳定性的遗传标志。一般认为SNPs在人群中出现的频率应大于0.3%[16]。人类细胞色素P450等位基因命名委员会(http://www.cypalleles. ki.se/cyp2c9.htm)已经命名58种SNPs,分别以CYP2C9*1~CYP2C9*58命名[17]。决定酶高活性的等位基因CYP2C9*1为野生型等位基因,野生型等位基因具有正常的酶代谢活性,突变型的纯合子或杂合子酶代谢活性与野生型相比,都有不同程度的降低,杂合子基因型CYP2C9*1/*3对S型华法林的清除率只有野生型纯合子CYP2C9*1的90%,而突变型纯合子CYP2C9*3则仅为CYP2C9*1的60%[18]。CYP2C9基因突变类型及其突变频率在不同种族间存在明显的差异[19-20]。一项针对中国浙江省与河北省健康汉族人的大规模调查结果显示,出现频率较高的等位基因为CYP2C9*1、CYP2C9*3、CYP2C9*16、CYP2C9*29和CYP2C9*13,频率分别是94.48%、2.94%、0.19%、0.19%和0.16%,出现频率较高的基因型为CYP2C9*1/*1、CYP2C9*1/*3、CYP2C9*1/*16、CYP2C9*1/*29和CYP2C9*1/*13,频率分别是89.23%、5.36%、0.38%、0.38%和0.33%[21]。此次调查未见纯合子CYP2C9*2/*2,纯合子CYP2C9*3/*3的出现频率为0.24%。CYP2C9*2在该次调查中出现的频率并不高,仅为0.14%,与Sanchez-Diz针对西班牙白种人群的调查结果相差较大,Sanchez-Diz的调查显示,在西班牙白种人群中CYP2C9*2基因的出现频率为15.80%[22],一项针对日本人的调查显示CYP2C9*2与CYP2C9*3的基因出现频率为0.00%和3.40%[23],针对埃塞俄比亚的调查显示CYP2C9*2与CYP2C9*3的基因出现频率为4.30%和2.30%[24],可见亚洲人群与非洲人群的CYP2C9*2、CYP2C9*3基因出现频率明显低于高加索人群。我国民族众多,地域广阔,不能排除存在其他基因型的可能,目前针对少数民族CYP2C9基因多态性的研究还比较少,需要更多的研究来加以证实。
2.2 VKORC1基因结构及突变类型 VKOR是华法林的作用靶点[25]。编码VKOR蛋白的基因VKORC1(Gene ID:79001)位于16号染色体短臂(16p11.2),全长约4100bp,包含3个外显子。在VKORC1编码区和非编码区存在大量的多态性位点,其中对华法林剂量有影响的单核苷酸多态性位点主要有启动子区1639位置G>A,第一个内含子1173位置C>T。VKORC1-1639GG和VKORC1-1173CC被称作非变异或野生基因型,VKORC1-1639GA和VKORC1-1173CT是杂合突变基因型,与野生基因型相比,携带杂合突变基因型的患者需要华法林剂量相对较低的;VKORC1-1639AA和VKORC1-1173TT是纯合子突变基因型,与野生基因型相比,携带纯合子突变基因型的患者需要的华法林剂量更低一些[26-27]。
VKORC1基因突变频率在不同种族间也存在显著差异。一项关于VKORC1基因型在亚洲国家分布的研究表明,随着地理位置从东亚向西亚跨越,纯合子突变基因型和突变等位基因的出现频率都在递减[28]。纯合子突变基因型频率在东亚的中国和日本分别是82.80%(2493/3011)和83.60% (1876/2244),在东南亚的泰国和印度尼西亚分别是63.15%(209/331)和63.04%(215/341),在南亚的伊朗是27.05%(56/207),在西亚的阿曼和土耳其则是14.33%(51/356)和24.92%(76/305)。这也很好地解释了为什么中国、日本、伊朗和阿曼的华法林标准日用量分别为3.43、2.62、3.79和4.75mg[29-32]。
3 华法林的个体化用药
Aithal发表于Lancet的一项研究发现,华法林低剂量组约81%的患者(29/36)有1~2个突变等位基因,而在对照组,这一比例仅为40%(40/100),两组之间的OR(odds ratio)值为6.21(95%CI 2.48~15.6)[33],说明CYP2C9变异等位基因与华法林的维持剂量紧密相关[34]。该项研究还发现,华法林低剂量组发生严重出血并发症的比例为11/132.8,而在随机临床对照组这一比例为7/311.1,两组之间的RR(rate ratio)值为3.68(95%CI 1.43~9.50,P=0.007)[33],进一步说明有突变的个体发生出血并发症的频率较高。
不同个体患者对华法林的反应差异很大,因此要达到同样的效果[国际标准化比值(INR)介于2和3之间],剂量相差有20倍之多,从1mg到超过20mg[4,11]。为达到华法林最优治疗效果并为华法林的个体化用药提供实验室支持,研究者们进行了多项前瞻性随机对照研究[35-41]。欧洲抗凝治疗药物基因组学小组(European Pharmacogenetics of Anticoagulant Therapy Group,EU-PACT)的一项多中心、单盲、前瞻性随机对照试验[41],对征集的455例患者进行随机分组,227例患者为基因型指导用药小组(Genotype-Guided group),另外228例患者为常规给药组,即对照组。两组的区别在于初始给药方案不同,基因型指导用药小组根据患者的基因型[CYP2C9*2,CYP2C9*3和VKORC1(1639G>A)]测试结果进行为期5d的给药方案,对照组按照当地常规治疗方案进行为期3d的给药,而两组在初始给药之后的维持性治疗方案都一样,对其进行为期3个月的随访,主要的比较指标有INR值介于2和3之间的时间所占百分比、达到治疗INR值所需要的时间和抗凝过度(INR≥4.0)时间所占百分比。结果显示,与对照组比较,基因型指导用药小组INR值介于2和3之间的时间所占百分比更高(67.4%vs60.3%,P<0.001,图2),达到治疗INR值所需要的时间更短(图3)、抗凝过度时间所占百分比更低(27.0%vs36.6%,P=0.03)。上述结果表明,基因型指导的给药方案效果要优于常规给药方案,但还需要更大规模和涉及更多种族的前瞻性研究予以证实。
国内外也有不少学者发表了以CYP2C9和VKORC1基因多态性为依据,结合其他因素如年龄、性别、身高、体重等的华法林剂量预测数学模型[27,42]。但这些以药物遗传学为基础的华法林维持剂量预测模型大多是根据回顾性研究结果开发出来的,因此在实际应用于临床之前必须通过前瞻性研究对其加以验证以确定临床效果和安全性[43]。

图2 平均INR值(A)和INR值介于2和3之间的时间所占百分比(B)[41]Fig. 2 Mean international normalized ratio (INR) (A) and percentage of time in the therapeutic INR range (B)[41]

图3 达到治疗INR值所需时间(A)和达到稳定维持治疗剂量所需时间(B)的Kaplan-Meier曲线[39]Fig.3 Kaplan-Meier plots of the time to reach a therapeutic INR (A) and to reach a stable warfarin dose (B)[39]
4 展 望
药物基因组学及相关基因多态性在华法林类药物的合理使用和个体化用药上具有重要意义,因此美国食品药品管理局(FDA)更换了华法林药物标签,增加了“患者的相关基因信息有助于患者初始剂量的选择”(http://www.accessdata.fda.gov/ drugsatfda_docs/label/2010/009218s108lbl.pdf)的内容,以优化治疗方案,避免药物不良反应。但患者是采用常规用药策略(标准剂量给药后再根据PTINR监测值进行调整)还是在用药之前进行相关基因检测,以及如何、何时进行基因型检测,目前均未达成共识或仍存在争议[44-45],如美国胸科医师学会发布的指南不推荐对患者常规进行基因型检测[46]。随着检测技术的日益完善与便捷,基因型检测在指导个体化用药方面将扮演越来越重要的角色[47]。同时随着新药开发技术的不断创新,将有希望开发出在药物作用、性价比等方面可与华法林相媲美,而副作用却比华法林少很多的药物[48]。
[1] Ke KP, Liu YQ, Yang HS. Research progress in warfarin's anticoagulation dosage and its influencing factors[J]. Med Recap, 2013(11): 2055-2058.[柯鹍鹏, 刘寅强, 杨鸿生. 华法林抗凝剂量与其影响因素的研究进展[J]. 医学综述, 2013(11): 2055-2058.]
[2] Zheng C, Mei D. Related factors affecting anticoagulant effect of warfarin[J]. Adverse Drug React J, 2007, 9(4): 256-261. [郑策,梅丹. 影响华法林抗凝血作用的有关因素[J]. 药物不良反应杂志, 2007, 9(4): 256-261.]
[3] Sun YH. Update and explanation of suggestions on anticoagulant therapy of atrial fibrillation and valvular heart disease in the 2012-edition guideline from The American College of Chest Physicians[J]. Chin J Pract Intern Med, 2013, 33(5): 369-371. [孙艺红. 美国新版《抗栓治疗和血栓预防指南》心房颤动和瓣膜病的更新解读[J]. 中国实用内科杂志, 2013, 33(5): 369-371.]
[4] Mega, Jessica L, Giugliano,et al. Genotype-guided dosing of warfarin[J]. Clin Chem, 2014, 60(7): 920-922.
[5] Yang F, Zhao GT, Ding YY,et al. Influences of gene polymorphisms on warfarine[J]. Med Rep, 2012(6): 771-774. [杨凡, 赵钢涛, 丁媛媛, 等. 基因多态性对华法林的影响[J].医药导报, 2012(6): 771-774.]
[6] Zhang HY, Luo WW, Fang HR,et al. Influence of VKORC1, CYP2C9, CYP4F2 and EPHX1 Gene Polymorphisms on Warfarin Dose[J]. China Pharm, 2012, 23(34): 3201-3205. [张海燕, 罗万慰, 方焕荣, 等. VKORC1、CYP2C9、CYP4F2、EPHX1基因多态性对华法林剂量的影响[J]. 中国药房, 2012, 23(34): 3201-3205.]
[7] Rost S, Fregin A, Ivaskevicius V,et al. Mutations in VKORC1 cause warfarin resistance and multiple coagulation factor deficiency type 2[J]. Nature, 2004, 427(6974): 537-541.
[8] Li T, Chang CY, Jin DY,et al. Identification of the gene for vitamin K epoxide reductase[J]. Nature, 2004, 427(6974): 541-544.
[9] Liu F, Zhu R, Kang J. Unfavorable prognosis of cancerassociated acute pulmonary thromboembolism with sequentialanticoagulation[J]. Chin J Pract Intern Med, 2014, 34(2): 183-186. [刘璠, 朱然, 康健. 癌症相关急性肺血栓栓塞症序贯抗凝治疗的研究[J]. 中国实用内科杂志, 2014, 34(2): 183-186.]
[10] Yue LF. Anticoagulant drug warfarin and its safe application[J]. Pharm Clin Res, 2009, 17(5): 397-399. [岳林峰. 抗凝药物华法林的安全应用[J]. 药学与临床研究, 2009, 17(5): 397-399.]
[11] Johnson JA, Gong L, Whirl-Carrillo M,et al. Clinical Pharmacogenetics Implementation Consortium Guidelines for CYP2C9 and VKORC1 Genotypes and Warfarin Dosing[J]. Clin Pharmacol Ther, 2011, 90(4): 625-629.
[12] Rendic S. Summary of information on human CYP enzymes: human P450 metabolism data[J]. Drug Metab Rev, 2002, 34 (1/2): 83-448.
[13] Einolf HJ, Story WT, Marcus CB,et al. Role of cytochrome P450 enzyme induction in the metabolic activation of benzo[c] phenanthrene in human cell lines and mouse epidermis[J]. Chem Res Toxicol, 1997, 10 (5): 609-617.
[14] Lee CR, Goldstein JA, Pieper JA. Cytochrome P450 2C9 polymorphisms: a comprehensive review of thein-vitroand human data[J]. Pharmacogenetics, 2002, 12(3): 251-263.
[15] Zhou S, Zhou Z, Huang M. Polymorphisms of human cytochrome P450 2C9 and the functional relevance[J]. Toxicology, 2010, 278(2): 165-188.
[16] Qiao ZD. Molecular Biology[M]. BeiJing: Military Medical Science Press, 2012.491. [乔中东. 分子生物学[M]. 北京: 军事医学科学出版社, 2012. 491.]
[17] Sim SC, Ingelman-Sundberg M. The human cytochrome P450 Allele Nomenclature Committee Web site: submission criteria, procedures, and objectives[J].MethodsMol Biol, 2006, 320: 183-191.
[18] Jiang YY. Pharmacogenomics[M]. Beijing: People's Medical Publishing House, 2006.406. [姜远英. 药物基因组学[M]. 北京: 人民卫生出版社, 2006. 406.]
[19] Van Booven D, Marsh S, Mcleod H,et al. Cytochrome P450 2C9-CYP2C9[J]. Pharmacogenet Genomics, 2010, 20(4): 277-281.
[20] Wang B, Wang J, Huang S Q,et al. Genetic polymorphism of the human cytochrome P450 2C9 gene and its clinical significance[J]. Curr Drug Metab, 2009, 10(7): 781-834.
[21] Dai DP, Xu RA, Hu LM,et al. CYP2C9 polymorphism analysis in Han Chinese populations: building the largest allele frequency database[J]. Pharmacogenomics J, 2014, 14(1): 85-92.
[22] Sanchez-Diz P, Estany-Gestal A, Aguirre C,et al. Prevalence of CYP2C9 polymorphisms in the south of Europe[J]. Pharmacogenomics J, 2009, 9(5): 306-310.
[23] Schelleman H, Brensinger C M, Chen J,et al. New genetic variant that might improve warfarin dose prediction in African Americans[J]. Br J Clin Pharmacol, 2010, 70(3): 393-399.
[24] Scordo MG, Aklillu E, Yasar U,et al. Genetic polymorphism of cytochrome P450 2C9 in a Caucasian and a black African population[J]. Br J Clin Pharmacol, 2001, 52(4): 447-450.
[25] He BX, Shi L, Zhao SJ. Progress of CYP2C9 and VKORC1 polymorphisms on individualized warfarin therapeutic regimen [J]. Guangdong Med J, 2008, 29(4): 684-686. [贺宝霞, 石磊,赵树进. CYP2C9和VKORC1基因多态性与华法林个体化用药研究进展[J]. 广东医学, 2008, 29(4): 684-686.]
[26] Wang D, Chen H, Momary KM,et al. Regulatory polymorphism in vitamin K epoxide reductase complex subunit 1 (VKORC1) affects gene expression and warfarin dose requirement[J]. Blood, 2008, 112(4): 1013-1021.
[27] Sconce EA, Khan TI, Wynne HA,et al. The impact of CYP2C9 and VKORC1 genetic polymorphism and patient characteristics upon warfarin dose requirements: proposal for a new dosing regimen[J]. Blood, 2005, 106(7): 2329-2333.
[28] Gaikwad T, Ghosh K, Shetty S. VKORC1 and CYP2C9 genotype distribution in Asian countries[J]. Thrombosis Research, 2014, 134(3): 537-544.
[29] Zhu J, Zheng WJ, Zhang WJ,et al. White blood cells contribute to patient-specific warfarin dose for Han Chinese[J]. Chin Med J (Engl), 2012, 125(11): 1960-1963.
[30] Pathare A, Al KM, Alkindi S,et al. Warfarin pharmacogenetics: development of a dosing algorithm for Omani patients[J]. J Hum Genet, 2012, 57(10): 665-669.
[31] Ohno M, Yamamoto A, Ono A,et al. Influence of clinical and genetic factors on warfarin dose requirements among Japanese patients[J]. Eur J Clin Pharmacol, 2009, 65(11): 1097-1103.
[32] Andalibi P, Farsam H, Amanlou M,et al. Determination of dosage requirements of warfarin in Iranian patients using HPLC technique[J]. J Clin Pharm Ther, 1998, 23(3): 199-202.
[33] Aithal GP, Day CP, Kesteven PJ,et al. Association of polymorphisms in the cytochrome P450 CYP2C9 with warfarin dose requirement and risk of bleeding complications[J]. Lancet, 1999, 353(9154): 717-719.
[34] Freeman BD, Zehnbauer BA, Mcgrath S,et al. Cytochrome P450 polymorphisms are associated with reduced warfarin dose[J]. Surgery, 2000, 128(2): 281-285.
[35] Johnson JA, Gong L, Whirl-Carrillo M,et al. Clinical Pharmacogenetics Implementation Consortium Guidelines for CYP2C9 and VKORC1 genotypes and warfarin dosing[J]. Clin Pharmacol Ther, 2011, 90(4): 625-629.
[36] Daly AK. Optimal dosing of warfarin and other coumarin anticoagulants: the role of genetic polymorphisms[J]. Arch Toxicol, 2013, 87(3): 407-420.
[37] Ageno W, Gallus AS, Wittkowsky A,et al. Oral anticoagulant therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines[J]. Chest, 2012, 141(2 Suppl): e44S-e88S.
[38] Anderson JL, Horne BD, Stevens SM,et al. Randomized trial of genotype-guided versus standard warfarin dosing in patients initiating oral anticoagulation[J]. Circulation, 2007, 116(22): 2563-2570.
[39] Hillman MA, Wilke RA, Yale SH,et al. A prospective, randomized pilot trial of model-based warfarin dose initiation using CYP2C9 genotype and clinical data[J]. Clin Med Res, 2005, 3(3): 137-145.
[40] Caraco Y, Blotnick S, Muszkat M. CYP2C9 genotype-guided warfarin prescribing enhances the efficacy and safety of anticoagulation: a prospective randomized controlled study[J]. Clin Pharmacol Ther, 2008, 83(3): 460-470.
[41] Pirmohamed M, Burnside G, Eriksson N,et al. A randomized trial of genotype-guided dosing of warfarin[J]. N Engl J Med, 2013, 369(24): 2294-2303.
[42] Zhu Y, Shennan M, Reynolds KK,et al. Estimation of warfarinmaintenance dose based on VKORC1 (-1639 G>A) and CYP2C9 genotypes[J]. Clin Chem, 2007, 53(7): 1199-1205.
[43] Zheng HY, Song J. Effect of polymorphisms of CYP2C9 and VKORC1 on warfarin dosage[J]. Med Recap, 2011, 17(2): 178-180. [郑红艳, 宋杰. CYP2C9和VKORC1基因多态性对华法林剂量的影响[J]. 医学综述, 2011, 17(2): 178-180.]
[44] Cavallari LH, Nutescu EA. Warfarin pharmacogenetics: to genotype or not to genotype, that is the question[J]. Clin Pharmacol Ther, 2014, 96(1): 22-24.
[45] Eriksson N, Wadelius M. Prediction of warfarin dose: why, when and how[J]? Pharmacogenomics, 2012, 13(4): 429-440.
[46] Holbrook A, Schulman S, Witt DM,et al. Evidence-based management of anticoagulant therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines[J]. Chest, 2012, 141(2 Suppl): e152S-e184S.
[47] Xu DP, Liu Y. A novel insight of understanding of mechanism of hepatitis B virus drug resistance by combining genotype resistant mutation detection and phenotype resistance analysis[J]. Med J Chin PLA, 2012, 37(6): 535-538. [徐东平, 刘妍. 结合基因型耐药突变检测与表型耐药分析探索乙肝病毒耐药的新认识[J]. 解放军医学杂志, 2012, 37(6): 535-538.]
[48] Ruff CT, Giugliano RP, Braunwald E,et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials[J]. Lancet, 2014, 383(9921): 955-962.
Research progress in CYP2C9 and VKORC1 gene polymorphism and individualized warfarin therapeutic regimen
LIU Yue-ping1, YANG Xiang1, XU Han-qing1, LI Yong-chuan1, LI Ming2, HUANG Qing1, FU Wei-ling11Department of Laboratory Medicine, Southwest Hospital, Third Military Medical University, Chongqing 400038, China
2Department of Laboratory Medicine, 477 Hospital of PLA, Xiangyang, Hubei 441003, China
Warfarin is still the most clinically used oral anti-coagulant despite of its narrow therapeutic index and high risk of hemorrhage. The mean daily dose of warfarin varies widely from patient to patient, and to achieve the same therapeutic effect, the daily dose of warfarin could be varied over 20-fold. The variability in warfarin dosage depends on several factors, including gene polymorphisms, index of body mass, age and other drugs, and these factors compelled the clinicians to individualize warfarin dosage in order to optimize the therapeutic regimen. A number of genes are involved in metabolism of warfarin, such as cytochrome P450 2C9 (CYP2C9), vitamin K epoxide reductase complex subunit 1 (VKORC1), cytochrome P450 4F2 (CYP4F2), gamma-glutamylcarboxylase (GGCX), etc. Of them CYP2C9 and VKORC1 are the emphasis of current researches. The association between the polymorphism of CYP2C9 and VKORC1 and individualized warfarin therapeutic regimen are mainly discussed in this paper.
cytochrome P-450 CYP2C9; vitamin K epoxide reductase complex subunit 1; pharmacogenetcs; warfarin; individualized medicine; polymorphism, single nucleotide
R973.2
A
0577-7402(2015)02-0163-06
10.11855/j.issn.0577-7402.2015.02.16
2014-07-26;
2015-01-13)
(责任编辑:沈宁)
刘跃平,硕士研究生,主管技师。主要从事个体化用药的基因诊断方面的研究
400038 重庆 第三军医大学西南医院检验科(刘跃平、杨翔、徐含青、李永川、黄庆、府伟灵);441000 湖北襄阳 解放军477医院检验科(李明)
黄庆,E-mail: DR.Q.Huang@gmail.com;府伟灵,E-mail: weilingfu@yahoo.com
*Corresponding author. HUANG Qing, E-mail: DR.Q.Huang@gmail.com; FU Wei-ling, E-mail: weilingfu@yahoo.com
