活性氧介导的铁过载对小鼠骨髓间充质干细胞的影响及其机制探讨
2015-06-28沈继春张宇辰赵明峰
沈继春,张宇辰,赵明峰
·基础研究·
活性氧介导的铁过载对小鼠骨髓间充质干细胞的影响及其机制探讨
沈继春,张宇辰,赵明峰
目的建立小鼠骨髓间充质干细胞(BM-MSCs)铁过载(IO)模型,并对铁过载模型小鼠进行去铁及抗氧化治疗,探讨铁过载对小鼠BM-MSCs的损伤作用及活性氧(ROS)在该损伤中的作用机制。方法采用随机区组设计,将40只雄性C57BL/6小鼠随机分为对照组、铁剂(右旋糖酐铁,25mg/ml)组(IO组)、铁剂+去铁治疗(DFX,125mg/kg)组(Fe+DFX组)、铁剂+抗氧化治疗(NAC,40mmol/L)组(Fe+NAC组),每组10只。从小鼠密质骨中分离BM-MSCs培养至P1代,检测BM-MSCs内铁颗粒、不稳定铁(LIP)及ROS水平;利用倍增时间及CCK-8试剂盒检测BM-MSCs增殖情况;采用碱性磷酸酶染色(ALP)、茜素红染色、成骨分化基因检测等方法评估BM-MSCs成骨分化能力;采用油红O染色检测BM-MSCs成脂定向分化能力。结果与对照组相比,铁剂组BM-MSCs内存在明显铁颗粒,LIP及ROS水平明显增高(P<0.05),倍增时间明显延长(2.07±0.14dvs1.03±0.07d,P<0.01)。DFX组及NAC组倍增时间较铁剂组有所缩短,分别为1.52±0.07d与1.68±0.03d(P<0.05)。与对照组比较,铁剂组BM-MSCs矿化能力及向成骨细胞分化能力下降,成骨基因ALP、RUNX2、OSN表达增强,而成脂定向分化能力增强。在去铁及抗氧化治疗后,上述改变发生部分逆转。结论铁过载可影响小鼠骨髓MSCs的增殖及定向分化能力,其机制可能与铁过载所致ROS升高有关。
铁超负荷;间质干细胞;活性氧
铁过载是指铁在体内过度沉积导致重要脏器的结构损害和功能障碍[1]。铁过载分为原发性(遗传性血色病)和继发性(长期红细胞输注所致的铁过载)两种[2]。近年来一些临床数据表明,铁过载会对骨髓造血功能产生明显影响,去铁治疗可使部分铁过载患者(骨髓纤维化、再生障碍性贫血、骨髓增生异常综合征)的输血次数减少甚至脱离输血,表明铁过载可抑制骨髓造血功能,体外实验显示这种抑制作用是通过增加活性氧(ROS)的产生影响骨髓造血干祖细胞的功能实现的[3-10]。间充质干细胞(mesenchymal stem cells,MSCs)作为骨髓造血微环境的重要组成部分,具有干细胞特性及多向分化能力,同时可分泌多种细胞因子调节造血功能[10-11]。对体外MSCs铁过载模型进行研究发现,铁过载可通过提高细胞内ROS水平抑制MSCs增殖、诱导其凋亡,从而降低其造血支持能力[12-13]。本研究旨在建立MSCs铁过载动物模型,为探索铁过载对骨髓造血微环境的影响及其机制提供实验基础,为治疗铁过载提供方向。
1 材料与方法
1.1 实验动物 雄性C57BL/6纯系小鼠,6~8周龄,SPF级,由中国食品药品鉴定研究院北京鉴定所提供。
1.2 实验器材与试剂 TH4-200型荧光倒置显微镜为日本Olympus公司产品,流式细胞仪为美国Beckman Coulter Altra产品。右旋糖酐铁注射液购自丹麦Pharmacocmos公司,胎牛血清、0.25%胰酶购自美国Gibco公司,α-MEM培养基购自美国Hyclone公司,钙荧光素乙酰氧基甲酯(Calcein-AM)、油红O染液(oil-red-O)、茜素红染液(alizarin red S)、碱性磷酸酶试剂盒(ALP kit)、L-谷氨酰胺、青链霉素、地塞米松、1-甲基-3-异丁基-黄嘌呤(IBXM)、吲哚美辛、牛胰岛素、β-甘油磷酸钠、维生素均购自美国Sigma公司,CCK-8试剂盒购自上海贝博生物技术公司,ROS检测试剂盒购自上海碧云天生物技术公司。基因引物均由上海生工科技有限公司合成。
1.3 实验方法
1.3.1 铁过载模型建立 利用随机区组设计,将40只雄性C57BL/6小鼠分为对照组、铁剂组(右旋糖酐铁,25mg/ml)、铁剂+去铁治疗(地拉罗司,deferasirox,DFX,125mg/kg)组(Fe+DFX组)及铁剂+抗氧化(N-乙酰半胱氨酸,NAC,40mmol/L)组(Fe+NAC组)。对照组小鼠腹腔注射生理盐水0.2ml/次;铁剂组小鼠腹腔注射右旋糖酐铁0.2ml/次,1次/3d;去铁治疗组小鼠予口服灌胃DFX 125mg/ kg,每周5d;抗氧化治疗组小鼠通过饮用水服用NAC 40mmol/L,每周换水2次。铁剂、去铁及抗氧化药物共给予4周。
1.3.2 MSCs的分离及培养 处理4周后,小鼠脱颈处死,浸泡于75%乙醇中2min后,转入100mm无菌平皿,切开下肢皮肤,用组织剪尽可能分离干净附着在股骨和胫骨上的肌肉、韧带。根据文献[14]方法从密质骨中分离培养MSCs:将骨组织置入35mm无菌平皿中,加入5ml培养液(α-MEM+1%P/ S+2%FBS),为保持MSCs细胞活性,操作不宜超过2h。剪去骨两端的骨骺,冲洗髓腔内造血细胞,冲洗至髓腔变白。将骨组织剪成1~3mm3大小颗粒,转至25cm2培养瓶中,加入α-MEM(含1mg/ml胶原酶Ⅱ)4ml,37℃振摇1~2h。回收消化松散的骨片进行原代培养。将经上述分离所得的骨片种于25cm2培养瓶中,加入5ml完全培养基(α-MEM+10%FBS+1%P/S),在37℃、5%CO2条件下连续培养3d,在此期间避免移动培养瓶,以便细胞附壁生长。3d后全量换液,弃去未贴壁细胞,之后隔天换液,5d后细胞融合达80%,弃去培养液,胰酶消化3min,加入等量完全培养基终止消化,离心重悬并进行细胞计数,备用于下一步实验及指标检测。
1.3.3 MSCs铁过载鉴定 调整P1代MSCs细胞浓度为1×106/ml,将细胞悬液混匀,取100μl,加入已用PBS浸润的甩片架上,利用甩片机进行甩片(900r/min,5min),之后用95%乙醇固定15min,进行普鲁士蓝铁染色,观察细胞内铁颗粒。利用不稳定铁(LIP)可以淬灭钙荧光素乙酰氧基甲酯的原理检测MSCs内的LIP水平,将用胰酶消化的P1代细胞用PBS洗涤2次后重悬细胞于PBS中,加入钙荧光素乙酰氧基甲酯,使其终浓度为0.125μmol/L,37℃避光温育15min,用PBS洗涤2次后,采用流式细胞仪检测细胞的平均荧光强度值(mean fluorescence intensity,MFI)。
1.3.4 MSCs增殖能力检测 群体倍增时间:将MSCs传至P1代,取对数生长期细胞,以1×105/孔密度接种于6孔板中,每组设3个复孔,在37℃孵箱中培养,当细胞达80%~90%融合时,用胰酶消化计数。按以下公式计算BM-MSCs的倍增时间(doubling time,DT):DT=CT×lg2/lg(X1/X0),其中X0是细胞的最初数量,X1是细胞的最终数量,CT是细胞培养时间。使用CCK-8试剂盒检测细胞增殖情况,步骤为:将浓度为2.5×104的细胞,倍比稀释为4个浓度梯度,分别为2.5×104/孔、1.25×104/孔、0.75×104/孔、0.375×104/孔,接种于96孔板中,每孔200μl,48h后,加8μl CCK-8试剂,37℃孵育3h后利用分光光度仪测定450nm及610nm波长处的吸光度值(A值),检测细胞增殖能力。
1.3.5 MSCs成骨诱导及鉴定 将原代BM-MSCs用胰酶消化,以5×104/孔密度接种于24孔板中,每组设3个复孔,待细胞长至板底70%~80%时,更换为成骨细胞诱导剂(10%FBS、10-8mol/L地塞米松、50μmol/L抗坏血酸磷酸盐、10μg/ml胰岛素、10mmol/L β-磷酸甘油、1%双抗)。每周换液2次,14d后用ALP试剂盒检测ALP活性,具体操作按试剂盒说明书进行,根据BM-MSCs染色情况检测ALP积分。继续培养14d,采用茜素红染色检测细胞钙化能力。将各组BM-MSCs用胰酶消化,根据试剂盒说明书提取RNA,反转录为cDNA,采用real-time PCR测定成骨相关基因(RUNX2,ALP,OSX,COLI)的表达量。
1.3.6 BM-MSCs成脂诱导及鉴定 将原代BMMSCs用胰酶消化,以2×104/孔密度接种于24孔板中,待细胞长至板底70%~80%时,更换为成脂诱导完全分化培养基,按照说明书进行诱导,细胞在培养过程中无须传代,15d后进行油红O染色鉴定。
1.3.7 ROS测定及相关信号通路检测 2',7'-二氯荧光黄双乙酸盐(dichloro fl uorescindiacetate,DCFH-DA)为非荧光脂类可渗透性成分,能被细胞内的ROS氧化生成非渗透性荧光成分DCF,故DCF的荧光强度与细胞内ROS水平呈正比。收集1×106个细胞,PBS洗涤、重悬,加入10mmol/L的DCFH-DA,使其终浓度为1μmol/L,37℃避光温育20min,PBS洗涤3次,重悬,流式细胞仪检测荧光强度。将各组原代BM-MSCs用胰酶消化,根据试剂盒说明书提取RNA,反转录为cDNA,采用real-time PCR测定成骨相关基因(FOXO3,PI3K)的表达量。
1.4 统计学处理 采用SPSS 17.0软件进行统计分析,实验数据以表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 MSCs原代培养细胞形态 原代培养48h后可见类圆形细胞从骨片中爬出,呈贴壁生长。继续培养24h后可见更多细胞爬出环绕骨片,培养72h后有集落形成,细胞变长呈梭形。培养7d后,细胞融合达80%(图1)。
图1 密质骨分离的间充质干细胞形态Fig. 1 Morphology of BM-MSCs isolated from compact bone
2.2 MSCs多向分化能力鉴定 将MSCs传至P1代,放入成骨诱导培养基及成脂诱导培养基,成骨诱导28d后进行茜素红染色,成脂诱导20d后进行油红-O染色,鉴定结果显示MSC分化为成骨及成脂细胞(图2)。

图2 BM-MSCs 的成骨及成脂分化鉴定(×400)Fig. 2 Identity of the osteoblastic and adipogenic differentation ability of BM-MSCs (×400)
2.3 MSCs铁过载鉴定 铁染色可见IO组细胞内存在大量铁颗粒,对照组细胞内几乎无铁颗粒(图3A)。流式细胞仪检测细胞内LIP结果显示:IO组MFI明显低于对照组(33 357±678vs56 282±813),进行去铁及抗氧化治疗后,细胞内荧光猝灭减少,LIP减少。DFX组MFI值(50 687±475)及NAC组MFI值(35 722±592)较IO组回升且差异具有统计学意义(P<0.05,图3B)。
2.4 铁过载抑制MSCs增殖 将P1代MSCs以1×105/孔密度接种于6孔板中培养,计算倍增时间,比较各组细胞的增殖能力,结果显示:对照组细胞生长旺盛,IO组细胞增殖能力明显下降。IO组倍增时间长于对照组(2.07±0.14dvs1.03±0.17d),在进行去铁及抗氧化治疗后,BM-MSCs的倍增时间较IO组缩短(Fe+DFX组1.52±0.07d,Fe+NAC组1.68±0.03d,图4A)。此外,利用CCK-8试剂盒检测细胞增殖得到了相同的结果,IO组增殖能力较对照组明显下降(0.977±0.075vs1.349±0.089)。在进行去铁及抗氧化治疗后,BM-MSCs增殖能力有所回升,Fe+DFX组吸光度为1.162±0.051,Fe+NAC组吸光度为1.163±0.054,二组较IO组差异均有统计学意义(P<0.05,图4B)。
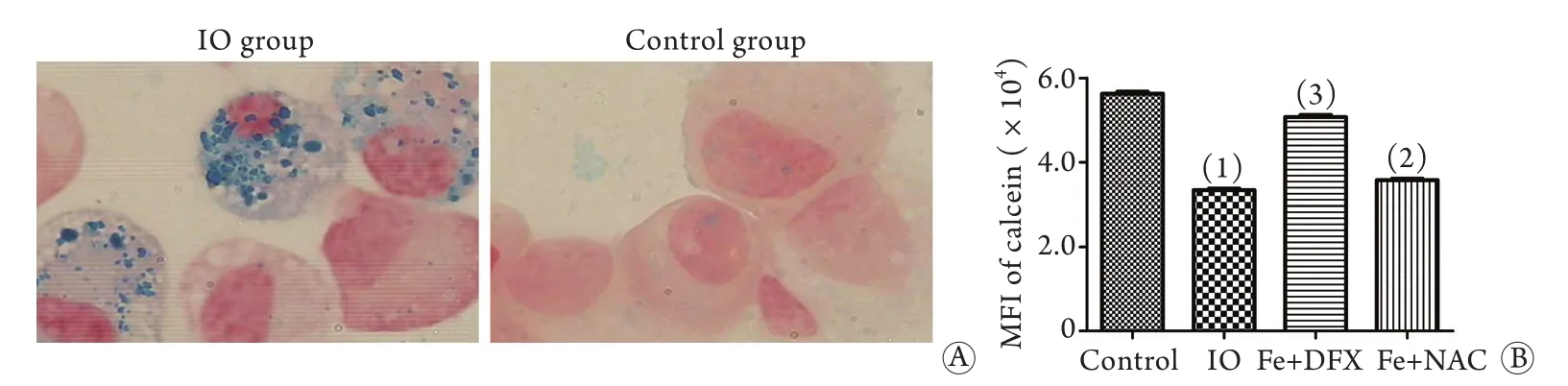
图3 BM-MSCs铁过载模型的鉴定Fig. 3 Identity of BM-MSCs iron deposit by Perl's iron staining
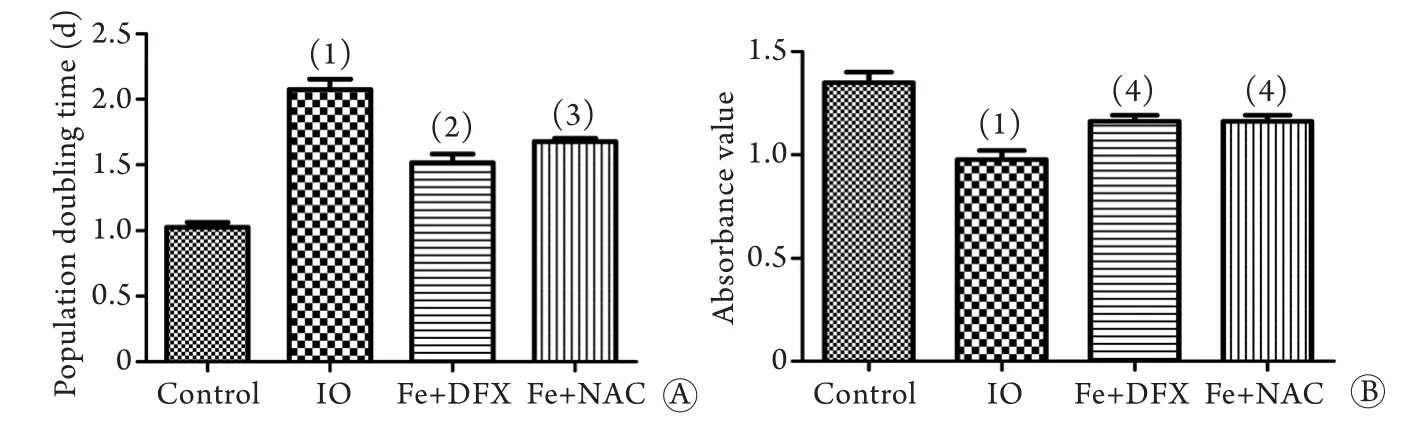
图4 各组倍增时间及吸光度比较Fig. 4 Comparison of doubling time and absorbency value of each group
2.5 铁过载对BM-MSCs向成骨细胞分化的抑制作用 将细胞以5×104/孔密度接种于24孔板中,加入成骨诱导培养基,培养1周可见有纤维状细胞开始变圆,培养2周时,可见细胞由单一梭形变为多角形、圆形,各组细胞密度不同。此时成骨细胞分泌的ALP达到高峰,ALP试剂盒检测结果显示,IO组ALP活性低于对照组(185±7vs253±18),差异有统计学意义(P<0.05,图5A)。茜素红染色可见IO组染色阳性细胞数明显低于对照组(图5B)。Realtime PCR检测显示,IO组成骨基因ALP、RUNX2及OSN表达降低,分别为对照组的0.383±0.025倍、0.336±0.045倍、0.830±0.091倍。去铁及抗氧化治疗后,ALP活性回升,分别为对照组的0.583±0.042倍及0.533±0.052倍,与IO组相比差异有统计学意义(P<0.01);RUNX2表达也有所升高,分别为对照组的0.613±0.056倍、0.058±0.090倍,与IO组相比差异有统计学意义(P<0.001,图5C)。
2.6 铁过载对MSCs成脂的影响 成脂诱导14d后进行油红O染色,结果显示铁剂组脂滴明显多于对照组,说明过量的铁颗粒可促进BM-MSCs向成脂细胞分化(图6)。
2.7 铁过载引起ROS升高及相关信号通路激活流式细胞仪检测各组MSCs细胞内的ROS水平,结果显示铁剂组ROS水平高于对照组(29 381±886vs17 836±1844),去铁及抗氧化治疗后ROS水平有所下降,DFX组为24 065±203,NAC组为21 116±542(P<0.05,图7)。Real-time PCR结果显示ROS相关信号通路被激活,铁剂组PI3K表达是对照组的1.87±0.04倍,去铁及抗氧化治疗后PI3K表达减少,分别为对照组的1.24±0.06倍及1.11±0.06倍(P<0.001)。铁剂组ROS负调控因子FOXO3表达下降,是对照组的0.62±0.04倍,去铁及抗氧化治疗后FOXO3表达有所增加,分别为对照组的0.77±0.04倍及0.88±0.02倍(P<0.01)。
3 讨 论
铁过载(血色病)主要原因为铁在体内过度沉积,导致重要脏器(尤其是心脏、肝脏、垂体、胰腺和关节)的结构损害和功能障碍,可见于遗传性血色病等遗传因素及红系无效造血、长期输血等继发因素造成的机体内铁吸收过多及代谢障碍。有临床证据表明,铁过载可以抑制骨髓造血功能[15-17],铁过载患者给予去铁治疗后血液学指标明显改善,输血依赖减少[15,18]。在本研究小组前期建立的铁过载动物模型中,我们发现在造血微环境中有大量铁沉积,而BM-MSCs为造血微环境的重要组成部分,因此本研究旨在探索铁过载对小鼠BM-MSCs的影响及其可能机制。

图5 铁过载对BM-MSCs 成骨分化的影响Fig. 5 IO influence the osteogenic differentiation of BM-MSCs
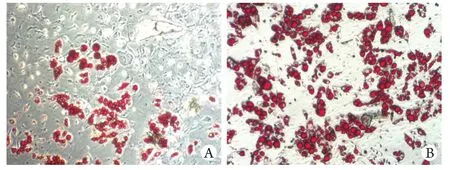
图6 油红O染色鉴定BM-MSCs成脂能力(×400)Fig. 6 Adipogenesis of BM-MSCs (Oil-red-O staining ×400)
BM-MSCs通过与造血细胞直接接触、分泌细胞外基质及多种细胞因子来维持造血微环境结构和功能的完整性,对造血进行精细调控。同时MSCs自身也具有向成骨细胞、成软骨细胞及脂肪细胞分化的能力。本研究根据密质骨及其骨内膜富含间充质干细胞这一特性,从密质骨中提取MSCs,将细胞分离培养至P1代,进行细胞甩片普鲁士蓝铁染色,发现铁剂组间充质干细胞内存在大量铁颗粒,应用流式细胞仪检测细胞内LIP也得出类似结果,证明小鼠MSCs铁过载模型构建成功。

图7 铁过载对BM-MSCs中ROS、FOXO3及PI3K表达的影响Fig. 7 IO increased the ROS expression in BM-MSCsviaaffecting the expression of FOXO3and PI3K
本课题组前期体外研究证实,铁过载可致ROS水平升高而损伤人骨髓及脐带MSCs,机制包括抑制MSCs的增殖、促进其衰老及凋亡[19-20]。本研究在小鼠骨髓MSCs铁过载模型中也发现了相同结果:对照组小鼠MSCs表现出旺盛的增殖能力,而铁剂组小鼠MSCs增殖能力明显下降。此外,铁过载可抑制小鼠骨髓MSCs向成骨细胞分化。将小鼠骨髓MSCs进行成骨诱导,结果显示,铁剂组诱导形成的成骨细胞内ALP含量明显低于对照组,茜素红染色可见铁剂组阳性细胞数明显低于对照组。MSCs向成骨细胞分化过程可以分为细胞增殖期、基质成熟期和矿化期,成骨细胞在上述时期分别优势性表达ALP、骨钙素(OCN)、Ⅰ型胶原(COLⅠ)等细胞外基质蛋白,因此,观察这些蛋白的表达情况,可以在一定程度上反映成骨细胞分化成熟的阶段。ALP在成骨分化的早期分泌,在基质成熟期分泌量达高峰,是骨质钙化、矿化必需的因子。RUNX2是成骨细胞分化过程中主要的因子之一,具有调节成骨及成脂平衡等重要作用。
本研究结果表明,铁过载可以抑制小鼠BMMSCs增殖,影响其成骨及成脂分化平衡,其机制可能为胞质内聚集的大量自由铁转运到线粒体,通过Fenton反应和Haber-Weiss途径催化生成大量ROS[21]。本研究利用DCFH-DA探针检测铁过载BM-MSCs内的ROS含量,发现细胞内ROS水平与细胞内铁颗粒数目呈正比,与本课题组前期体外实验结果一致。大量文献报道,ROS升高可抑制成骨细胞相关基因(RUNX2、COLⅠ、ALP等)的表达,从而抑制成骨细胞形成[22],其机制可能是由于ROS下调细胞内FOXO相关因子的表达,而FOXO相关因子在氧化还原平衡及骨形成过程中发挥重要作用[23]。因此,铁过载抑制BM-MSCs向成骨细胞分化可能与上述机制相关。
综上所述,铁过载可以抑制小鼠骨髓MSCs增殖,降低其向成骨细胞分化的能力,从而降低其造血支持能力,损伤骨髓造血功能,其机制主要与ROS升高相关。
[1] Cao XL, Zhao MF. Organ dysfunction of Iron overload and magnetic resonance imaging for the detection of Iron Overload Research[J]. Chin J Pract Intern Med, 2014, 34(12): 1226-1228. [曹小立, 赵明峰. 铁过载对器官功能损伤及磁共振检测铁过载研究进展[J]. 中国实用内科杂志, 2014, 34(12): 1226-1228.]
[2] The Chinese Medical Association Society of Blood. China expert consensus about diagnosis and treatment of iron overload[J]. Chin J Hematol, 2011, 32(8): 572-574. [中华医学会血液学分会. 铁过载诊断与治疗的中国专家共识[J]. 中华血液学杂志, 2011, 32(8): 572-574.]
[3] Chai X, Zhao MF. The damage and treat development of iron overload in hematological diseases[J]. Chin J Intern Med, 2013, 52(5): 431-433. [柴笑, 赵明峰. 铁过载在血液系统疾病中的危害及治疗进展[J]. 中华内科杂志, 2013, 52(5): 431-433.]
[4] Guariqlia R, Martorelli MC, Villani O,et al. Positive effect on hematopoiesis in patients with myelodysplastic sydrome receiving deferasirox as oral iron chelation therapy: a brief review[J]. Leuk Res, 2011, 35(5): 566-570.
[5] Zhao MF, Xie F, Li YM,et al. Increased intracellular concentration of reactive oxygen species mediated the deficient hematopoiesis of iron overload bone marrow[J]. Blood, 2010, 116(11): 4247a.
[6] Xie F, Zhao MF, Li YM,et al.In vitroe ff ect of iron overload on bone marrow cell function by inducing the reactive oxygen species[J]. Chin J Hematol, 2011, 32(9): 606-609. [谢芳, 赵明峰, 李玉明,等. 铁过载诱导活性氧物质生成对骨髓造血功能影响的体外实验研究[J]. 中华血液学杂志, 2011, 32(9): 606-609.]
[7] Xie F, Zhao MF, Zhu HB,et al. Establishment of iron overloaded bone marrow modelin vitroand its impact on hematopoiesis[J]. J Exp Hematol, 2011, 19(4): 1038-1042. [谢芳, 赵明峰, 朱海波, 等. 铁过载骨髓造血细胞体外模型的建立及其对造血的影响[J]. 中国实验血液学杂志, 2011, 19(4): 1038-1042.]
[8] Xie F, Zhao MF, Zhu HB,et al. The e ff ect of iron-catalyzed oxidative stress to hematoposis of hematopoietic stem and progenitor cell[J]. Natl Med J Chin, 2011, 91(46): 3284-3288. [谢芳, 赵明峰, 朱海波, 等. 氧化应激对铁过载造血干祖细胞造血功能的影响[J].中华医学杂志, 2011, 91(46): 3284-3288.]
[9] Taoka K, Kumano K, Nakamura F,et al. The effect of iron oveload and chelation on erythroid differentiation[J]. Int J Hematol, 2012, 95(2): 149-159.
[10] Shi M, Liu ZW, Zhang Z,et al. Progress and challenge in the treatment of end-stage liver disease with stem cells[J]. Med J Chin PLA, 2013, 38(8): 685-692. [施明, 刘振文, 张政, 等. 干细胞治疗终末期肝病的进展与挑战[J]. 解放军医学杂志, 2013, 38(8): 685-692.]
[11] Lu XC, Yang B, Chi XH,et al. A novel etiology of aplastic anemia: the uncontrolled adipogenic differentiation of mesenchymal stem cells in bone marrow induced by an abnormal immunological reaction[J]. Med J Chin PLA, 2014, 39(3): 173-179. [卢学春, 杨波, 迟小华, 等. 再生障碍性贫血病因学的新探索:异常免疫诱导骨髓间充质干细胞的过度脂肪化(英文)[J]. 解放军医学杂志, 2014, 39(3): 173-179.]
[12] Lu WY, Zhao MF, Sajin R,et al. Effect and mechanism of ironcatalyzed oxidative stress on mesenchymal stem cells[J]. Acta Acad Med Sin, 2013, 35(1): 6-12. [卢文艺, 赵明峰, Sajin Rajbhandary,等. 铁过载催化的氧化应激对骨髓间充质干细胞的影响及其作用机制[J]. 中国医学科学院学报, 2013, 35(1): 6-12.]
[13] Lu WY, Zhao MF, Chai X,et al. Reactive oxygen species mediate the inury and de fi cient hematopoietic supportive capacity of umbilical cord derived mesenchymal stem cells induced by iron overload[J]. Natl Med J Chin, 2013, 93(12): 930-934. [卢文艺, 赵明峰, 柴笑,等. 活性氧介导铁过载对脐带间充质干细胞及其造血支持作用的研究[J]. 中华医学杂志, 2013, 93(12): 930-934.]
[14] Zhu H, Guo ZK, Jiang XX,et al. A protocol for isolation and culture of mesenchymal stem cells from mouse compact bone[J]. Nat Protoc, 2010, 5(3): 550-560.
[15] Hartmann J, Braulke F, Sinzig U,et al. Iron overload impairs proliferation of erythroid progenitors cells (BFU-E) from patients with myelodysplastic syndromes[J]. Leuk Res, 2013, 37(3): 327-332.
[16] Oliva EN, Ronco F, Marino A,et al. Iron chelation therapy associated with improvement of hematopoiesis in transfusiondependent patients[J]. Transfusion, 2010, 50(7): 1568-1570.
[17] Gattermann N, Finelli C, Della Porta M,et al. Hematologic responses to deferasirox therapy in transfusion dependent patients with myelodysplastic syndromes[J]. Haematologica, 2012, 7(9): 1364-1371.
[18] Ho JH, Chen YF, Ma WH,et al. Cell contact accelerates replicative senescence of human mesenchymal stem cells independent oftelomere shortening and p53 activation: roles of Ras and oxidative stress[J]. Cell Transplant, 2011, 20(8): 1209-1220.
[19] Ko E, IJee KY, Hwang DS. Human umbilical cord blood-derived mesenchymal stem cells undergo cellular senescence in response to oxidative stress[J]. Stem Cells Dev, 2012, 21(11): 1877-1886.
[20] Kanda Y, Hinata T, Kang SW,et al. Reactive oxygen species mediate adipocyte differentiation in mesenchymal stem cells[J]. Life Sci, 2011, 89(7/8): 250-258.
[21] Valko M, Morris H, Cronin MT. Metals, toxicity and oxidative stress[J]. Curr Med Chem, 2005, 12(10): 1161-1208.
[22] Suh KS, Rhee SY, Jung WW,et al. Chrysanthemum zawadskii extract protects osteoblastic cells from highly reducing sugar-induced oxidative damage[J]. Int J Mol Med, 2013, 32(1): 241-250.
[23] Kim KM, Park SJ, Jung SH,et al. MiR-182 is a negative regulator of osteoblast proliferation, differentiation, and skeletogenesis through targeting FoxO1[J]. J Bone Miner Res, 2012, 27(8): 1669-1679.
Effect of reactive oxygen species mediated iron overload on murine bone marrow mesenchymal stem cells and its mechanism
SHEN Ji-chun1, ZHANG Yu-chen2, ZHAO Ming-feng2*1Department of Hematology, Affiliated Hospital of Logistics University of People’s Armed Police Forces, Tianjin 300162, China
2Department of Hematology, The First Central Clinical College of Tianjin Medical University, Tianjin 300192, China
*Corresponding author, E-mail: zmfzmf@hotmail.com
This work was supported by the Natural Science Foundation of China (81041043), Natural Science Foundation of Tianjin (13JCYBJC23400), and Science and Technology Foundation of Tianjin Health Bureau(2013KR07)
ObjectiveTo reproduce an iron overload (IO) model of murine bone marrow derived mesenchymal stem cells (BM-MSCs), explore the effects of IO on murine BM-MSCs, and elucidate the involvement of reactive oxygen species (ROS) in this process.MethodsForty male mice (C57BL/6) were randomly divided into 4 groups (n=10): control group, IO group, Fe+iron-chelation (DFX, 125mg/kg) group and Fe+anti-oxidation (NAC, 40mmol/L) group. BM-MSCs were isolated from compact bone. The levels of iron particles, labile iron pool (LIP) and ROS in BM-MSCs were measured to confirm oxidative stress in the model. Cell proliferation was measured through population double time (DT) and by Cell Counting Kit-8(CCK-8) assay. The osteoblastic differentiation ability of BM-MSCs was assessed by alkaline phosphatase (ALP) activity, alizarin red staining and osteogenic differential genes assay. The adipogenic differentiation ability of BM-MSCs was detected by Oil-Red-O staining.ResultsCompared with control group, iron deposite increased significantly with higher levels of LIP and ROS in BM-MSCs of IO group (P<0.05). In IO group, the BM-MSCs showed a longer double time than that in control group (2.07±0.14dvs1.03±0.07d), which can be reversed to 1.52±0.07d by DFX or to 1.68±0.03d by NAC (P<0.05). IO inhibited osteogenic differentiation and mineralization of BM-MSCs, which could be attributed to decreased expression of osteogenic gene alkaline phosphatase (ALP), runt-related transcription factor 2 (RUNX2) and osteocalcin (OSN). The osteoblastic differentiation ability of BM-MSCs in IOgroup was suppressed by IO-induced ROS upregulation. NAC or DFX treatment could partially a tt enuate cell injury and inhibit the signaling pathway induced by excessive iron.ConclusionIO may impair the proliferation and di ff eretiation ability of murine BM-MSCs by enhancing the generation of ROS.
iron overload; mesenchymal stem cells; reactive oxygen species
R551.3
A
0577-7402(2015)02-0097-07
10.11855/j.issn.0577-7402.2015.02.03
2014-10-17;返回日期:2014-12-30)
(责任编辑:沈宁)
国家自然科学基金(81041043);天津市自然科学基金(13JCYBJC23400);天津市卫生局科技基金(2013KR07)
沈继春,医学硕士,副主任医师,副教授。主要从事贫血、出凝血疾病及白血病方面的研究
300162 天津 武警后勤学院附属医院血液科(沈继春);300192 天津医科大学第一中心临床学院血液科(张宇辰、赵明峰)
赵明峰,E-mail: zmfzmf@hotmail.com
